IGF-1基因转染骨髓基质细胞复合鸵鸟钙磷陶瓷骨促进狗牙周缺损组织再生的研究
朱国强,李袁飞,白玉众,吴织芬(中国人民解放军联勤保障部队第985医院烧伤整形科,太原 0000;山西医科大学第一医院肿瘤科;空军军医大学口腔医院牙周科;通讯作者,E-mail:76084@qq.com)
现代的组织工程主要研究对象为种子细胞、支架材料、生长因子[1]。其中生长因子的使用一直是研究的难点,因为局部使用生长因子存在体内作用时间短、成本高等缺点,不能方便、反复地使用也限制了生长因子的临床应用[2]。将载有生长因子的基因转染入种子细胞,使其持续表达生长因子,从而获得更为满意的生长因子剂量和浓度,进而克服直接使用生长因子带来的缺点。基于此设想,我们将获得的稳定高表达胰岛素样生长因子-1(insulin-like growth factor-1,IGF-1)的基因转染后的骨髓基质细胞(bone marrow stem cells,MSCs)作为种子细胞与新型的支架材料鸵鸟钙磷陶瓷骨(ostrich true bone ceramics,OTBC)复合,观察细胞生长状态后,将其置入狗的新鲜牙周组织缺损区,评价其对牙周组织再生的影响及作用。
1 材料与方法
1.1 主要试剂和仪器
IGF-1基因转染骨髓基质细胞由985医院中心实验室培养[3];鸵鸟钙磷陶瓷骨由空军军医大学口腔颌面外科实验室惠赠;S-520扫描电镜(日本);846复合麻醉剂由中国兽医大学研制生产;1-2岁、体质量15-20 kg的健康雄性杂种犬由空军军医大学西京医院实验动物中心提供;组织切片机(Leitz公司,德国);显微镜用测微尺(上海第三光学仪器厂)。
1.2 OTBC的预处理
将OTBC切割成5 mm×5 mm×3 mm大小,50 g/L次氯酸钠浸泡3 d,流水冲洗过夜,用蒸馏水超声漂洗,烘干后高压消毒备用。
1.3 细胞的收集和接种
将本实验室冻存转染有IGF-1基因的MSCs细胞[3],常规复苏后,用2.5 g/L胰蛋白酶消化,1 000 r/min离心7 min,收集细胞,用培养液漂洗2遍,将细胞浓度调整至5×106/ml,然后接种到OTBC上,并负压抽吸使细胞悬液充分进入OTBC的多孔间隙中,小心将负载细胞的OTBC移至24孔板中,标准环境下孵育培养,每24 h换液一次。
1.4 扫描电镜观察
将转染IGF-1的MSCs细胞复合入支架OTBC开始计时,在24,48,72 h各取1个标本,30 g/L戊二醛固定,乙腈系列脱水,真空干燥,喷金镀膜后扫描电镜观察。另设空白对照同法观察。
1.5 动物手术方法
1.5.1 实验分组 选用1-2岁的健康雄性杂种犬3只,以每只犬上颌两侧的第2,3前磨牙和下颌两侧的第2,3,4前磨牙为实验牙。将30颗狗牙随机配对分为3组:T-MSCs/OTBC组(IGF-1基因转染MSCs细胞复合OTBC支架组),MSCs/OTBC组(MSCs细胞复合OTBC支架组)、和OTBC组(无细胞复合的OTBC支架组),每组10牙。
1.5.2 动物手术过程 1-2岁的健康雄性杂种犬以846合剂(0.1-0.15 ml/kg)肌注麻醉、固定、消毒、铺巾后,翻开龈瓣。暴露颊侧根分叉部位的牙槽骨,用涡轮机裂钻制备根分叉区人工牙周组织缺损,水平向舌侧磨去根分叉区内的牙槽骨4 mm,垂直向磨去根分叉区牙槽骨约5 mm,在缺损区根面上作平齐于牙槽骨嵴的切迹,作为组织学观察的标志点。彻底刮除切迹以上暴露根面的牙周膜并做根面平整。冲洗牙周组织缺损术区,根据随机分组结果分别植入MSCs-OTBC、T-MSCs-OTBC和OTBC。间断缝合龈瓣,上塞治剂。术后给予肌注青霉素80万U/d,连续3 d,预防感染,术后1周内进流食。
1.5.3 取材及组织学测量 术后8周处死狗,进行颈动脉插管,4%多聚甲醛灌注固定,取下颌骨,按分组分段切取实验牙及牙槽骨,制备近远中向3-4 mm厚的牙及牙周组织块,脱钙2周,梯度乙醇脱水,过氯仿,浸蜡,石蜡包埋,制备7 μm厚的切片,改良Mallory三色法染色,作组织学观察,光镜下观察新生牙槽骨、新生牙骨质、新生牙周膜的生长情况。选根分叉中央的5张切片进行组织学测量。组织学测量指标包括:①骨缺损高度(defect height, DH):根分叉顶至根方切迹底间距离;②新生牙槽骨高度(new bone formation, NB):根方切迹底至新生牙槽骨冠方顶间距离;③新生牙骨质高度(new cementum formation, NC):根方切迹底至新生牙骨质冠方顶间距离;④新生结缔组织附着(new connective tissue, CT):根方切迹底至根分叉新生结缔组织顶的附着高度。
1.6 统计学处理
应用APSS10.0统计软件进行数据统计分析,对各组的DH、NB、NC及CT的组织学测量结果,采用多重比较方差分析,选取LSD进行两两之间比较,对数据进行统计,以P<0.05为差异有统计学意义。
2 结果
2.1 扫描电镜观察结果
OTBC材料为三维立体多孔网状结构,存在大量孔隙,孔隙之间相互交通,且排列有序,孔径约200-300 μm(见图1)。
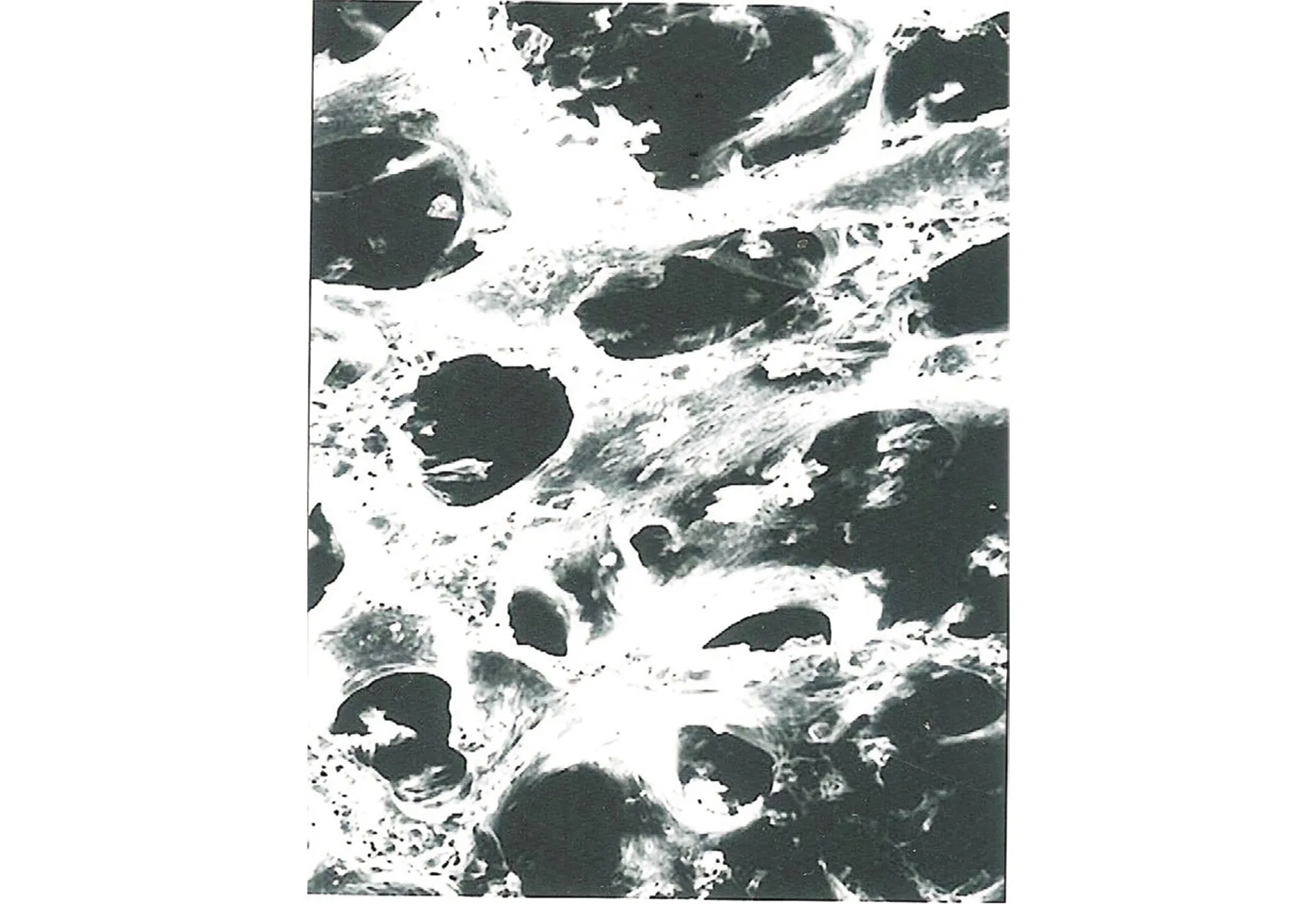
图1 OTBC材料电镜结果 (×1 000)Figure 1 OTBC by scanning electron microscope (×1 000)
T-MSCs/OTBC组24 h即可见细胞贴附良好,开始伸展,形态为梭形或多角形(见图2A)。48 h可见细胞生长与增殖,并分泌有大量细胞外基质。72 h可见细胞明显增多,并跨越微孔表面或向孔隙内分裂增殖,可见大量细胞外基质。此时细胞已连接成片,在微孔内成簇生长,细胞表面存在大量丝状纤维互相连接,细胞形态与24 h时无明显变化(见图2B)。

图2 IGF-1基因转染MSCs复合OTBC 24 h和72 h电镜结果 (×1 000)Figure 2 Electron microscopic results of recombination between MSCs transfected with IGF-1 and OTBC at 24 h and 72 h (×1 000)
2.2 实验牙一般观察
各组动物术后健康状况良好。实验牙部位均未见明显的牙石和软垢,牙龈无明显炎症。
2.3 组织学观察及测量结果
光镜下观察可见三组均有新生牙槽骨、新生牙周膜和新生牙骨质样组织生长,均可见OTBC脱钙后的残留,T-MSCs/OTBC组新生的牙槽骨几乎充满缺损区,未见长结合上皮长入,未发现骨粘连和根吸收等不良愈合,并发现混乱排序的韧带样软组织类似新生的牙周膜(见图3)。MSCs/OTBC组也有较明显的牙槽骨新生,但有少量结缔组织长入,可见少量的骨粘连和根吸收(见图4)。OTBC组牙周组织再生较少,部分牙位(3/10)可见骨粘连和不同程度的根吸收,均可见有结合上皮与结缔组织长入(见图5)。

△:新生的牙槽骨;:新生的牙周膜韧带样软组织;:OTBC材料残留图3 干预8周后T-MSCs/OTBC组牙周组织的改良Mallory三色法染色结果 (10×40)Figure 3 Modified Mallory trichromatic staining of periodontal tissue in T-MSCs/OTBC group at week 8 after treatment (10×40)

△:新生的牙槽骨;:少量骨粘连;:微量根吸收图4 8周后MSCs/OTBC组牙周组织的改良Mallory三色法染色结果 (10×40)Figure 4 Modified Mallory trichromatic staining of periodontal tissue in MSCs/OTBC group at week 8 after treatment (10×40)
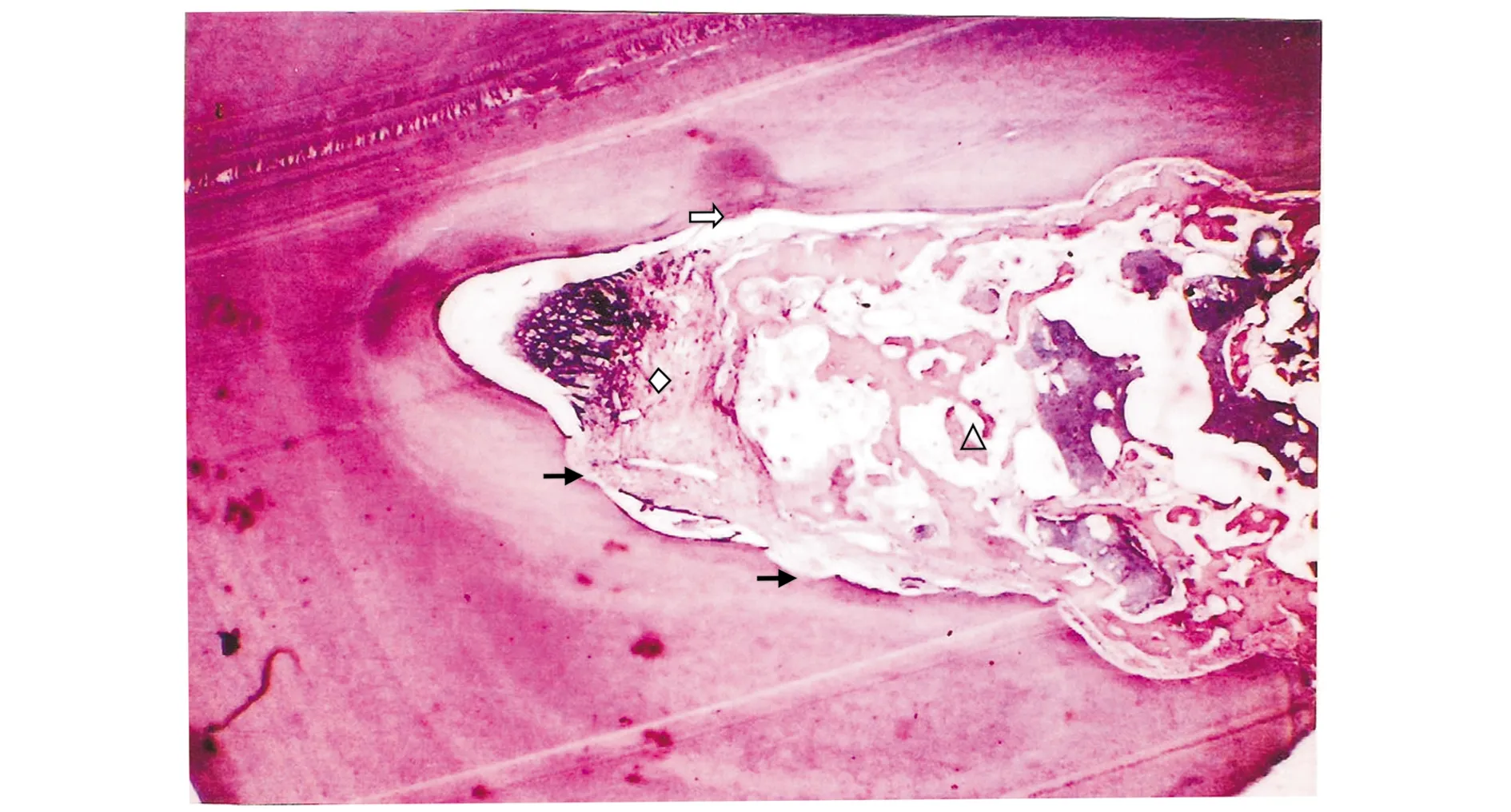
△:再生的牙周组织;:上皮与结缔组织;:骨粘连;:根吸收图5 8周后OTBC组牙周组织的改良Mallory三色法染色结果 (10×40)Figure 5 Modified Mallory trichromatic staining of periodontal tissue in OTBC group at week 8 after treatment (10×40)
组织学测量结果见表1。三组间DH差异无统计学意义(P>0.05),而NB、NC及CT等指标,在T-MSCs/OTBC组和MSCs/OTBC组均明显高于OTBC组,差异有统计学意义(P<0.05),T-MSCs/OTBC组和MSCs/OTBC组相比较除NB外,NC及CT指标差异无统计学意义(P>0.05)。

表1 各组DH、NB、NC及CT等指标的组织学测量结果 (mm)Table 1 Histological measurement of DH, NB, NC and CT in each group (mm)
3 讨论
组织工程逐渐成为牙周组织再生治疗的新策略,现代的组织工程学包括种子细胞/支架材料、生长因子/支架材料和种子细胞/生长因子/支架材料3种构建方式[4]。其中如何维持生长因子浓度和效果一直是研究重点及难点,如果种子细胞具有高表达细胞因子的能力,可在损伤组织短期内持续高表达生长因子,且不用反复操作添加生长因子,将解决如何使用和维持生长因子浓度等难题[5]。我们之前的实验证明,IGF-1基因转染骨髓基质细胞具有高表达IGF-1蛋白的能力,由于IGF-1的自分泌作用,该细胞也高表达内皮细胞生长因子(VEGF)、骨形成蛋白-2(BMP-2)、骨涎蛋白(BSP)、骨桥蛋白(OPN)、骨粘连素(ON)和Ⅰ型胶原[6,7]。我们猜测IGF-1基因转染骨髓基质细胞可以作用种子细胞,具备有分化成为成骨细胞、成牙骨质细胞、牙周膜细胞的潜质[8,9],还可以成为生长因子提供体,促进残存的成骨细胞、成牙骨质细胞、牙周膜细胞增殖,从而加速新生牙周组织的生成,加速修复缺损。我们实验结果也证明了我们的猜测,使用基因转染后的骨髓基质细胞8周即可修复再生牙槽骨、牙周膜和牙骨质,特别是形成了排列仍杂乱的牙周膜样组织,我们猜测可能是骨髓基质细胞分化成为牙周膜细胞,或周围或残留的牙周膜细胞在高表达IGF-1在内的的多因子作用下,随着新生的血管组织等游走而来,形成新生不规则的牙周膜。
我们选用的支架材料OTBC由鸵鸟骨制备而成,有独特的空隙结构,骨质由广泛分布的中小孔(200-300 μm)及微孔(60 μm)组成,孔隙交通极为丰富[10]。通过焦磷酸钠(Na4P2O7,NP)和羟基磷灰石(hydroxyapatite,HAP)热化学反应,OTBC主要成分为HAP/β-磷酸三钙(β-tricalcium phosphate,β-TCP)/NaCaPO4多相钙磷陶瓷,具有良好的生物活性和一定的可降解性,且钙磷比例与人骨比较接近,是一种新型的钙磷陶瓷类植骨材料,优良的组织工程支架材料[11,12]。我们将IGF-1基因转染的MSCs与之复合,24 h细胞已贴附、生长。随着时间的延长,细胞不断分裂增殖,分泌大量细胞外基质。将其植入狗机体后,未见炎症反应,并有牙周组织长入其中。说明OTBC作为支架材料,没有影响细胞与机体的正常生理功能,进一步证明其良好的生物相容性,可以作为牙周组织工程中的支架材料。
综上所述,动物实验证明IGF-1基因转染MSCs细胞复合OTBC可以明显促进人造牙周组织缺损区内新生牙槽骨、牙骨质和牙周膜的形成。虽然该方法是否对因牙周病导致组织缺损也有同样的效果还有待我们进一步研究,但是还是为我们提供了一种牙周组织再生性治疗的新思路,即将基因治疗与组织工程有机结合将有可能解决牙周组织功能性再生这一长久性的难题。

