甘草次酸抗肿瘤衍生物的设计、合成及其活性评价
高 丰,周 菲,陈红珊,亓金钗,李 桐,张梓杰,杨笑云,蔡德生,戴子琦,徐 冰,雷海民
(北京中医药大学,北京 102488)
恶性肿瘤严重威胁人类的生命并降低生活质量,世界卫生组织统计数据表明,2020年全球新发癌症病例1 929万例,死亡病例996万例,是目前世界上主要的公共卫生问题之一[1]。目前对于恶性肿瘤的主要治疗方法包括手术治疗、放化疗等,而细胞毒类药物仍是临床一线化疗药物的主体,但由于其毒性和不良反应大、耐药性强,已经难以满足临床治疗的需求[2-3]。近年来,对从天然产物中提取分离得到的有效成分进行结构修饰已成为国内外抗肿瘤药物研究的热点[4-8]。三萜类化合物是指具有6个异戊二烯基本结构单元的化合物,广泛分布于自然界中,其具有广泛的药理活性[9-10]。甘草次酸(GA)作为中药甘草中主要成分甘草酸的苷元[11],是最常见的五环三萜类化合物,廉价易得[12-13],但其母核抗肿瘤活性不强,高剂量长时间使用会导致如假性醛固酮增多症等不良反应,因此需要进行结构修饰来改善其活性[14-16]。
本课题组前期研究发现,在三萜类化合物中引入氨基酸片段可显著提高其抗肿瘤活性及水溶性[17-18],同时发现,GA母核C-30处酯化可以提高其抗肿瘤活性,特别是在C-30处引入苄基酯抗肿瘤活性最好[19-21]。研究表明,化合物的键合方式可能会影响其抗肿瘤活性,酰胺键既能提高衍生物的活性,又能提高其代谢稳定性[22-24]。
本研究以GA为母核,基于拼合原理,设计、合成出6个结构新颖的GA衍生物,通过四甲基偶氮唑蓝(MTT)法评价了其体外抗肿瘤活性,筛选出优势化合物;同时初步讨论了其构效关系;进一步通过4′,6-二脒基-2-苯基吲哚(DAPI)染色法观察了其对HepG2细胞形态的影响,研究思路和研究结果可为GA的后续结构修饰改造提供参考。
1 仪器与材料
1.1仪器 磁力搅拌器(德国IKA公司);SARRORIUS-BS124S型电子分析天平(德国赛多利斯股份有限公司);N-1300D-W型旋转蒸发仪(东京理化器械株式会社);X-5型显微熔点测定仪(北京泰克仪器有限公司);Bruker Avance 400型核磁共振仪(瑞士Bruker公司);SGW-2自动旋光仪(美国鲁道夫公司);Agilent Q-TOF质谱仪(美国安捷伦科技有限公司);Thermo 3111型CO2培养箱和Multiskan GO 酶标仪,均购自美国赛默飞世尔科技公司;Olympus倒置荧光显微镜(奥林巴斯株式会社)。
1.2试药 甘草次酸(GA,批号FY20Y011201,质量分数为98%,南通飞宇生物科技有限公司);1-boc-N-fmoc-L-组氨酸(批号GLS180111-36704,上海吉尔生化有限公司);氰基硼氢钠(批号C11502500,上海麦克林生化科技有限公司);溴化苄(批号KYEKR17)、醋酸铵(批号20110107)、三氧化铬(批号A14105)和1-羟基苯并三唑(HOBt,批号KSCIT12),均购自北京伊诺凯科技有限公司;1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(EDCI,批号C1926072)和哌啶(批号104094-4X100ML),均购自上海阿拉丁生化科技股份有限公司;4-二甲氨基吡啶(DMAP,批号1224275,上海晶纯生化科技股份有限公司);N,N-二异丙基乙胺(DIPEA,批号P1234338,上海阿达马斯试剂有限公司);二氯甲烷、无水硫酸钠、碳酸氢钠、三氟乙酸、浓硫酸、碳酸钾、二甲基亚砜(DMSO)和N,N-二甲基甲酰胺(DMF)等均为分析纯,均购自北京化工厂;四甲基偶氮唑蓝(MTT,批号20200606,上海阿拉丁生化科技股份有限公司);RPMI-1640培养基(批号AF29584257)、DMEM培养基(批号8120350)、2.5 g·L-1胰蛋白酶溶液(批号2122153)、磷酸盐缓冲盐(PBS,批号2177715)、胎牛血清(批号20030502)和4′,6-二脒基-2-苯基吲哚(DAPI染料,批号6709771),均购自北京拜尔迪生物科技有限公司;硅胶G薄层板(青岛海洋化工有限公司)。
1.3细胞株 人肝癌细胞HepG2、人肺癌细胞A549、人结肠癌细胞HCT-116、人正常肝细胞L02和大鼠心肌细胞H9C2,均购自北京协和医院细胞资源中心。
2 方法
2.1化学合成
2.1.1中间体30苄基酯甘草次酸(GA-BN) 称取GA (2 g,4.25 mmol)、溴化苄 (872.30 mg,5.1 mmol),置于50 mL茄形反应瓶中,加入DMF 20 mL,随后加入碳酸钾 (1 762.18 mg,12.75 mmol),80 ℃加热回流3 h,薄层色谱(TLC)监测GA反应完全,停止反应;DMF减压浓缩后加二氯甲烷溶解,将溶液转移至分液漏斗,依次用水和饱和食盐水 (15 mL)洗涤,无水硫酸钠脱水,减压浓缩后将产物置于硅胶柱上分离,得白色固体,即GA-BN。
2.1.2化合物1称取2.1.1项下制备的GA-BN (800 mg,1.43 mmol)和1-boc-N-fmoc-L-组氨酸 (819.41 mg,1.72 mmol),置于50 mL茄形反应瓶中,加入EDCI (412.16 mg,2.15 mmol)和DMAP (17.10 mg,0.14 mmol),室温搅拌6 h,TLC监测GA-BN反应完全,停止反应;将反应液转移至分液漏斗,依次用水和饱和食盐水 (15 mL) 洗涤,无水硫酸钠脱水,减压浓缩后将产物置于硅胶柱上分离,得白色固体,即化合物1。
2.1.3化合物2称取化合物1(800 mg,0.78 mmol),置于50 mL茄形反应瓶中,随后加入无水二氯甲烷 (15 mL)溶解,并在冰浴条件下缓慢加入三氟乙酸 (4 mL),TLC监测化合物1反应完全,停止反应;将反应液转移至分液漏斗,用饱和碳酸氢钠溶液萃取2次,无水硫酸钠脱水,减压浓缩后将产物置于硅胶柱上分离,得白色固体,即化合物2。
2.1.4化合物3称取化合物2(400 mg,0.44 mmol),置于50 mL茄形反应瓶中,加入DMF 20 mL和哌啶2 mL,室温搅拌,TLC监测化合物2反应完全,停止反应;将反应液转移至分液漏斗,依次用水和饱和食盐水 (15 mL)洗涤,无水硫酸钠脱水,减压浓缩后将产物置于硅胶柱上分离,得白色固体,即化合物3。见图1。

图1 化合物1~3的合成路线
2.1.5中间体30-苄基酯-3-羧基甘草次酸 (GO-BN) 称取GA-BN (1 g,1.79 mmol)及三氧化铬、浓硫酸,置于50 mL茄形反应瓶中,加入H2O 10 mL,冰浴下搅拌30 min,TLC监测GA-BN反应完全,停止反应;将反应液转移至分液漏斗,依次用水和饱和食盐水 (15 mL)洗涤,无水硫酸钠脱水,减压浓缩后将产物置于硅胶柱上分离,得白色固体,即中间体GO-BN。
2.1.6中间体30-苄基酯-3-氨基甘草次酸(GN-BN) 称取2.1.5项下制备的GO-BN (800 mg,1.43 mmol)和氰基硼氢钠 (108.11 mg,1.72 mmol)及醋酸铵 (1 102.24 mg,14.30 mmol),置于50 mL茄形反应瓶中,加无水甲醇 (20 mL),室温下搅拌12 h,TLC监测GO-BN反应完全,停止反应;将反应液转移至分液漏斗,依次用水和饱和食盐水 (15 mL)洗涤,无水硫酸钠脱水,减压浓缩后将产物置于硅胶柱上分离,得白色固体,即中间体GN-BN。
2.1.7化合物4称取2.1.6项下制备的GN-BN (600 mg,1.07 mmol)和1-boc-N-fmoc-L-组氨酸 (612.47 mg,1.29 mmol),置于50 mL茄形反应瓶中,加入EDCI (306.56 mg,1.61 mmol)和HOBt (216.87 mg,1.61 mmol)及DIPEA (345.08 mg,2.68 mmol),室温搅拌12 h,TLC监测GN-BN反应完全,停止反应;将反应液转移至分液漏斗,依次用水和饱和食盐水 (15 mL)洗涤,无水硫酸钠脱水,减压浓缩后将产物置于硅胶柱上分离,得白色固体,即化合物4。
2.1.8化合物5称取化合物4(300 mg,0.29 mmol),置于50 mL茄形反应瓶中,随后加入无水二氯甲烷15 mL溶解,并在冰浴条件下缓慢加入三氟乙酸4 mL,TLC监测化合物4反应完全,停止反应;将反应液转移至分液漏斗,用饱和碳酸氢钠溶液萃取2次,无水硫酸钠脱水,减压浓缩后将产物置于硅胶柱上分离,得白色固体,即化合物5。
2.1.9化合物6称取化合物5(200 mg,0.25 mmol),置于50 mL茄形反应瓶中,加入DMF 20 mL和哌啶2 mL,常温搅拌,TLC监测化合物5反应完全,停止反应;将反应液转移至分液漏斗,依次用水和饱和食盐水 (15 mL)洗涤,无水硫酸钠脱水,减压浓缩后将产物置于硅胶柱上分离,得白色固体,即化合物6。见图2。

图2 化合物4~6的合成路线
2.2体外抗肿瘤活性筛选 取处于对数生长期的细胞接种于96孔板中,每孔3×103个,将96孔板置于37 ℃、体积分数为5% CO2的细胞培养箱中培养。24 h后,给药组每孔加入100 μL含不同质量浓度化合物的培养液,空白组加入100 μL空白培养基,每组设置3个复孔,于培养箱中继续培养72 h后每孔加入20 μL质量浓度为5 mg·mL-1的MTT溶液,于培养箱中继续培养4 h,弃去上清液,每孔加入150 μL DMSO,轻度振荡溶解后,用酶标仪在490 nm波长处测定吸光度值A。用公式抑制率=[1-(A给药组-A空白组)÷(A对照组-A空白组)]×100%计算细胞生长抑制率。采用Graphpad Prism 5.0软件计算半数抑制浓度IC50值,实验平行重复3次。
2.3DAPI染色观察细胞核形态变化 取处于对数生长期的人肝癌细胞HepG2接种于24孔板中,每孔1.5×104个细胞,置于37 ℃、体积分数为5%CO2的细胞培养箱中培养24 h后,加入化合物6,终浓度分别为1、3、5 μmol·L-1,每组平行3个复孔,于培养箱中继续培养72 h,弃去培养基,用PBS缓冲液漂洗2遍,加入体积分数为4%的多聚甲醛固定10 min,随后弃去多聚甲醛,用PBS缓冲液漂洗2遍,加入DAPI染液,作用3 min,弃去剩余染液,PBS缓冲液漂洗2遍,于倒置荧光显微镜100倍下观察细胞核形态并拍照。
3 结果
3.1结构鉴定
化合物13β-[1-boc-N-fmoc-L-组氨酸]-11-氧代-齐墩果烷-12-烯-30-苄基酯 (benzyl 3β-[1-boc-N-fmoc-L-histidine]-11-oxo-olean-12-en-30-oate):白色固体,收率为57.1%;熔点为122.8 ℃,[α]D=+ 124 (c=0.3 mg·mL-1,MeOH);1H NMR (400 MHz,CDCl3):δ(ppm) 8.04 (s,1H,-NCHN-),7.77(d,2H,H-Ar of fmoc,J=8 Hz),7.61(m,2H,H-Ar of fmoc),7.41~7.26 (m,9H,H-Ar and 2×-CH2-of fmoc),7.18(s,1H,-CCHN-),5.53(s,1H,H-12),5.18,5.10(d,each,1H,Bn-CH2,J=12.0 Hz),4.66(m,1H,-NHCHCO-),4.52(m,1H,H-3),4.34(m,2H,-CHCH2O-),4.24 (m,1H,-CH-of fmoc),3.18~2.99 (m,2H,-CH2-of histidine),2.33(s,1H,H-9),2.04(m,1H,H-18),2.01~1.64,1.57~1.35,1.31~1.19,1.06~1.01(m,18H,methylene and methine of triterpenoid structure),1.61(brs,9H,3×-CH3of boc),1.33 (s,3H,H-29),1.16(s,3H,H-27),1.12(s,1H,H-25),1.09(s,3H,H-28),0.97(m,1H,H-5),0.84(s,3H,H-24),0.81(s,3H,H-23),0.73(s,3H,H-26)。13C NMR (400 MHz,CDCl3)δ(ppm)200.1 (C-11),176.3(C-30),171.4(his-COO),169.2(C-13),156.2 (boc-COO),146.9(fmoc-COO),144.1(-C=CCH-of fmoc),141.4 (-C=CCH- of fmoc),138.7(-CH=C-N-),136.9(-N=CH-N-),136.3 (Bn-Car),128.7 (Bn-Car),128.6,128.5(Bn-Car),128.4 (Bn-Car),127.8(fmoc-Car),127.2(fmoc-Car),125.4(fmoc-Car),120.1 (fmoc-Car),114.9 (-C=CNH-),85.9,82.2 (boc-q.C),67.3 (-CH2- of fmoc),66.3(Bn-CH2),61.7,55.7,54.2 (his-CHNH),48.4,47.3 (-CH- of fmoc),45.5,44.1,43.3,41.2,38.8,38.2,37.8,37.0,32.8,31.9,31.0,30.1,28.5,28.4,28.1,28.0,26.6,26.5,23.5,23.4,18.8,17.4,16.8,16.5。HRMS (ESI)m/z:1 020.570 6 [M+H]+,calcd.for C63H78N3O91 020.573 8。
化合物23β-[N-fmoc-L-组氨酸]-11-氧代-齐墩果烷-12-烯-30-苄基酯 (benzyl 3β-[N-fmoc-L-histidine]-11-oxo-olean-12-en-30-oate):白色固体,收率为55.3%;熔点为119.0 ℃,[α]D=+92 (c=0.3 mg·mL-1,MeOH);1H NMR (400 MHz,CDCl3):δ(ppm) 7.69 (m,2H,H-Ar of fmoc),7.50 (m,2H,H-Ar of fmoc and -CCHN-),7.39~7.29,7.24~7.17 (m,9H,H-Ar and 2×-CH2- of fmoc),5.57 (s,1H,H-12),5.20,5.10 (d,each,1H,Bn-CH2,J=12.0 Hz),4.57 (m,2H,-NHCHCO- and H-3),4.30 (m,2H,-CHCH2O-),4.12 (m,1H,-CH- of fmoc),3.42-2.90 (m,2H,-CH2- of histidine),2.33 (s,1H,H-9),2.06 (m,1H,H-18),2.03~1.35,1.29~1.20,1.04~1.00 (m,18H,methylene and methine of triterpenoid structure),1.31 (s,3H,H-29),1.15 (s,6H,H-27 and H-25),1.08 (s,3H,H-28),0.97 (m,1H,H-5),0.80 (s,6H,H-23 and H-24),0.72 (s,3H,H-26)。13C NMR (400 MHz,CDCl3)δ(ppm) 200.8 (C-11),176.4 (C-30),170.5 (his-COO),170.3 (C-13),143.7 (fmoc-COO),143.6 (-C=CCH- of fmoc),141.4 (-C=CCH- of fmoc),139.1 (-CH=CNH-),136.2 (Bn-Car),133.6 (-N=CH-NH-),128.7 (Bn-Car),128.6 (C-12),128.5 (Bn-Car),128.4 (Bn-Car),127.9 (fmoc-Car),127.2 (fmoc-Car),125.1 (fmoc-Car),120.1 (fmoc-Car),117.1 (-CH=CNH-),83.4 (C-3),67.6 (-CH2- of fmoc),66.4(Bn-CH2),61.7,55.0,53.6 (his-CHNH),48.4,47.0 (-CH- of fmoc),45.6,44.1,43.4,41.2,38.7,38.2,37.8,37.0,32.7,31.9,31.3,28.6,28.4,28.2,28.1,26.5,26.5,23.5,23.4,18.8,17.4,16.7,16.5。HRMS (ESI)m/z:920.519 0 [M+H]+,calcd.for C58H70N3O7920.521 4。
化合物33β-[L-组氨酸]-11-氧代-齐墩果烷-12-烯-30-苄基酯 (benzyl 3β-[L-histidine]-11-oxo-olean-12-en-30-oate):白色固体,收率为59.2%;熔点为156.2 ℃,[α]D=+ 116.67 (c=0.3 mg·mL-1,MeOH);1H NMR (400 MHz,CDCl3):δ(ppm) 7.54 (s,1H,-CCHN-),7.36 (m,5H,H-Ar),5.54 (s,1H,H-12),5.18,5.10 (d,each,1H,Bn-CH2,J=12.0 Hz),4.54 (m,1H,H-3),3.80 (m,2H,-NHCHCO-),2.82 (m,2H,-CH2- of histidine),2.33 (s,1H,H-9),2.04 (m,1H,H-18),2.01~1.34 (m,18H,methylene and methine of triterpenoid structure),1.15 (s,6H,H-29 and H-27),1.10 (s,3H,H-25),0.98 (m,1H,H-5),0.88 (s,3H,H-24),0.80 (s,3H,H-23),0.73 (s,3H,H-26)。13C NMR (400 MHz,CDCl3)δ(ppm) 200.1 (C-11),176.3 (C-30),170.5 (his-COO),169.4 (C-13),136.3 (-CH=CNH-),136.2 (Bn-Car),135.1 (-N=CH-NH-),128.7 (Bn-Car),128.6 (C-12),128.4 (Bn-Car),119.7 (-CH=CNH-),82.0,66.4 (Bn-CH2),61.8,55.1,54.7 (His-CHNH),48.4,45.5,44.1,43.3,41.2,38.9,38.3,37.8,37.0,32.8,31.9 31.3,29.8,28.6,28.4,28.2,26.6,26.5,23.8,23.4,18.8,17.5,17.0,16.5。HRMS (ESI)m/z:698.452 5 [M+H]+,calcd.for C43H59N3O5697.445 5。
化合物43β-[(1-boc-N-fmoc-L-组氨酸)酰基]-11-氧代-齐墩果烷-12-烯-30-苄基酯 (benzyl 3β-[(1-boc-N-fmoc-L-histidine)amino]-11-oxo-olean-12-en-30-oate):白色固体,收率为51.4%;熔点为139.5 ℃,[α]D=+124 (c=0.3 mg·mL-1,MeOH);1H NMR (400 MHz,CDCl3):δ(ppm) 8.05 (s,1H,-NCHN-),7.77 (d,2H,H-Ar of fmoc,J=8.0 Hz),7.60 (m,2H,H-Ar of fmoc),7.44~7.28 (m,9H,H-Ar and 2×-CH2- of fmoc),7.20 (s,1H,-CCHN-),5.53 (s,1H,H-12),5.21,5.10 (d,each,1H,Bn-CH2,J=12.0 Hz),4.48 (m,1H,-NHCHCO-),4.37 (m,2H,-CHCH2O-),4.23 (m,1H,-CH- of fmoc),3.60 (m,1H,H-3),3.12 (m,1H,-CH2- of histidine),2.98 (m,1H,-CH2- of histidine),2.33 (s,1H,H-9),2.04 (m,1H,H-18),2.01~1.65,1.58~1.38,1.32~1.20,0.93~0.76 (m,18H,methylene and methine of triterpenoid structure),1.60 (brs,9H,3×-CH3of boc),1.34 (s,3H,H-29),1.16 (s,6H,H-27 and H-25),1.09 (s,3H,H-28),1.08 (s,3H,H-24),0.97 (m,1H,H-5),0.72 (s,3H,H-23),0.65 (s,3H,H-26)。13C NMR (400 MHz,CDCl3)δ(ppm) 200.2 (C-11),176.4 (C-30),170.5 (his-CONH),169.2 (C-13),156.3 (boc-COO),146.9 (fmoc-COO),144.0 (-C=CCH- of fmoc),141.4 (-C=CCH- of fmoc),139.3 (-CH=C-N-),136.9 (-N=CH-N-),136.3 (Bn-Car),128.7 (Bn-Car),128.6 (C-12),128.5 (Bn-Car),128.4 (Bn-Car),127.9 (fmoc-Car),127.2 (fmoc-Car),125.3 (fmoc-Car),120.1 (fmoc-Car),115.0 (-C=CNH-),86.0 (boc-q.C),67.3 (-CH2-of fmoc),66.3 (Bn-CH2),61.8,56.7,55.6,55.2 (his-CHNH),48.4,47.2 (-CH-of fmoc),45.4,44.1,43.3,41.2,39.8,38.2,37.8,37.0,32.8,31.9,31.3,30.5,28.6,28.4,28.4,28.0,26.5,25.3,23.4,23.4,18.8,17.8,16.5,16.4。HRMS (ESI)m/z:1 019.587 2 [M+H]+,calcd.for C63H79N4O81 019.589 8。
化合物53β-[(N-fmoc-L-组氨酸)酰基]-11-氧代-齐墩果烷-12-烯-30-苄基酯 (benzyl 3β-[(N-fmoc-L-histidine)amino]-11-oxo-olean-12-en-30-oate):白色固体,收率为80.2%;熔点为122.5 ℃,[α]D=+120 (c=0.3 mg·mL-1,MeOH);1H NMR (400 MHz,CDCl3):δ(ppm) 7.77 (d,2H,H-Ar of fmoc,J=8.0 Hz),7.59 (m,2H,H-Ar of fmoc and -CCHN-),7.44~7.27 (m,9H,H-Ar and 2×-CH2- of fmoc),5.53 (s,1H,H-12),5.21,5.10 (d,each,1H,Bn-CH2,J=12.4 Hz),4.51 (m,1H,-NHCHCO-),4.36 (m,2H,-CHCH2O-),4.21 (m,1H,-CH-of fmoc),3.58 (m,1H,H-3),3.15 (m,1H,-CH2- of histidine),3.03 (m,1H,-CH2- of histidine),2.33 (s,1H,H-9),2.04 (m,1H,H-18),2.01~1.38,1.32~1.27,0.94~0.76 (m,18H,methylene and methine of triterpenoid structure),1.34 (s,3H,H-29),1.16 (s,6H,H-27 and H-25),1.08 (s,6H,H-28 and H-24),0.97 (m,1H,H-5),0.72 (s,3H,H-23),0.66 (s,3H,H-26)。13C NMR (400 MHz,CDCl3)δ(ppm) 200.4 (C-11),176.4 (C-30),171.0 (his-CONH),169.5 (C-13),143.9 (fmoc-COO),143.9 (-C=CCH- of fmoc),141.4 (-C=CCH- of fmoc),139.1 (-CH=CNH-),136.3 (Bn-Car),135.0 (-CH=CNH-),128.7 (Bn-Car),128.6 (C-12),128.5 (Bn-Car),128.4 (Bn-Car),127.9 (fmoc-Car),127.2 (fmoc-Car),125.3 (fmoc-Car),120.2 (fmoc-Car),117.5 (-CH=CNH-),67.4 (-CH2- of fmoc),66.4 (Bn-CH2),61.8,56.8,55.6,55.3 (his-CHNH),48.4,47.2,45.5,44.1,43.3,41.2,39.8,38.2,37.8,37.0,32.8,31.9,31.3,28.6,28.5,28.4,28.,26.5,26.5,25.2,23.4,18.8,17.8,16.6,16.3。HRMS (ESI)m/z:919.535 9 [M+H]+,calcd.for C58H71N4O6919.537 4。
化合物63β-[(L-组氨酸)酰基]-11-氧代-齐墩果烷-12-烯-30-苄基酯 (benzyl 3β-[(L-histidine)amino]-11-oxo-olean-12-en-30-oate):白色固体,收率为60.7%;熔点为276.6 ℃,[α]D=+166.67 (c=0.3 mg·mL-1,MeOH);1H NMR (400 MHz,CDCl3):δ(ppm) 7.58 (s,1H,-NCHN-),7.48 (s,1H,-CCHN-),7.36 (m,5H,H-Ar),5.54 (s,1H,H-12),5.18,5.10 (d,each,1H,Bn-CH2,J=12.0 Hz),3.67 (m,1H,-NHCHCO-),3.59 (m,1H,H-3),3.02 (m,2H,-CH2- of histidine),2.35(s,1H,H-9),2.04 (m,1H,H-18),1.92~1.25 (m,18H,methylene and methine of triterpenoid structure),1.16 (s,6H,H-27),1.11 (s,3H,H-29),1.09 (s,3H,H-25),0.97 (m,1H,H-5),0.82 (s,3H,H-24),0.77 (s,3H,H-23),0.72 (s,3H,H-26)。13C NMR (400 MHz,CDCl3)δ(ppm) 200.3 (C-11),176.5 (C-30),174.0 (his-CONH),169.4 (C-13),136.2 (-CH=CNH-),136.2 (Bn-Car),135.3 (-N=CH-NH-),128.7 (Bn-Car),128.6 (C-12),128.4 (Bn-Car),66.4 (Bn-CH2),61.8,56.6,55.6,55.0 (his-CHNH),48.4,45.5,44.1,43.3,41.2,38.9,38.3,37.8,37.1,32.8,31.9,31.3,29.8 (NHCHCH2),28.7,28.6,28.4,26.6,26.5,25.4,23.4,18.8,17.9,16.8,16.4。HRMS (ESI)m/z:697.469 9 [M+H]+,calcd.for C43H60N4O4696.461 5。
3.2体外抗肿瘤活性测定 通过MTT实验评价了合成的6种结构新颖的GA衍生物对3种肿瘤细胞的抗肿瘤活性及2种正常细胞的毒性,结果见表1。研究发现,C-3位以酰胺键连接的化合物活性均明显强于以酯键连接的化合物;脱掉Boc保护基后裸露出仲胺基对细胞毒性并无明显提升,而进一步将fmoc保护基脱掉后露出伯胺基后抗肿瘤活性得到明显提升,可推断出伯胺的暴露对GA衍生物的细胞毒活性起着重要的作用。其中化合物6对HepG2的抗肿瘤活性(IC50=2.98±0.69 μmol·L-1)优于阳性对照药索拉菲尼(IC50=7.07±0.30 μmol·L-1),且其对L02细胞的毒性(IC50=4.93±0.03 μmol·L-1)低于索拉菲尼(IC50=1.97±0.65 μmol·L-1)。

表1 甘草次酸衍生物对不同细胞的IC50
3.3DAPI染色观察细胞核形态变化 DAPI染料能与DNA特异性结合,在一定波长下发出荧光,所以该染料常用于细胞核形态学观察。DAPI染色结果见图3。由图3可知,空白对照组细胞数量较多,细胞核呈蓝色,形态完整;化合物6给药浓度为1 μmol·L-1时,细胞变化不明显,仅见少量细胞出现核形态变化;当给药浓度为3、5 μmol·L-1时,细胞数量明显减少,细胞核可见碎裂和固缩的现象,而细胞核破碎和固缩是肿瘤细胞凋亡的典型特征。由此可见,化合物6通过诱导人肝癌细胞HepG2凋亡发挥抗肿瘤作用。
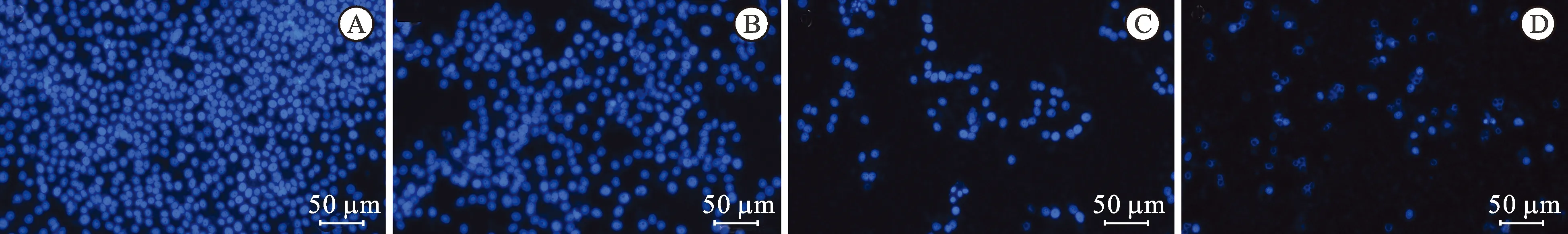
图3 化合物6对HepG2细胞DAPI染色图
4 讨论
GA作为抗癌先导化合物受到世界各国科学家的广泛关注,但其抗肿瘤活性并不明显。为了提高GA的细胞毒性,探讨键合方式及氨基酸中伯胺及仲胺基团对抗肿瘤活性的影响,本研究以GA为母核,在C-30位引入亲脂性基团苄基,同时在C-3位分别以酯键与酰胺键的成键方式引入小分子氨基酸,设计并合成出6个结构新颖的GA衍生物,利用MTT法筛选得到优势化合物6,其对人肝癌细胞HepG2的抑制作用强于阳性对照药索拉菲尼,同时对人正常肝细胞L02的毒性低于索拉菲尼,表现出一定的细胞毒选择性。DAPI染色进一步研究表明,其可通过诱导肿瘤细胞细胞核固缩、碎裂而使肿瘤细胞凋亡。本研究可为其他GA抗肿瘤衍生物的发现奠定基础。

