Seipin基因对动物脂肪储存调控作用的研究进展*
艾庆辉, 陈梦然, 陈秋池, 麦康森
(中国海洋大学 1.农业部水产动物营养与饲料重点实验室; 2.海水养殖教育部重点实验室,山东 青岛 266003)
真核生物主要以中性脂质如甘油三酯(TG)的形式储存能量[1],并且在机体需要时,将储存的脂质水解成甘油和脂肪酸,之后脂肪酸以β-氧化的形式提供能量。脂肪组织是动物体内储存脂质的主要部位,分为白色脂肪组织(White adipose tissue, WAT)和棕色脂肪组织(Brown adipose tissue, BAT)。其中,白色脂肪细胞内含一个巨大的脂滴(Lipid droplets, LDs),用于储存TG[2-3]。
机体内过多脂质积累会导致肥胖和脂肪肝等疾病[4],主要表现为成熟的脂肪细胞中LDs积累过多,且在非脂肪组织中出现了明显的LDs。因此,阐明脂肪分化和LDs细胞动力学的分子机制有助于寻找缓解脂肪异常沉积的靶点。近年来,人们筛选了很多与脂肪储存相关的基因,发现Seipin有调节脂肪分化和细胞LDs形成的功能[5-7]。Seipin突变导致先天性脂肪营养不良(BSCL)患者出现脂肪组织严重缺失的症状[5]。此外,Seipin缺乏的细胞中出现了形态异常的LDs[8-9]。因此,本文阐述了Seipin在调控脂肪分化和LDs形态方面的功能和分子机制。
与肥胖和脂肪肝等疾病类似,水产养殖中高脂饲料的使用同样会导致鱼类出现脂肪异常沉积,因此鱼类脂肪储存的调控研究受到广泛关注。目前,鱼类Seipin相关研究极其缺乏。本文也概述了Seipin在鱼类中的研究进展,并且提出了鱼类Seipin的研究方向。
1 Seipin的发现、分布和结构
人类Seipin(BSCL2)基因最早在2001被发现,是从先天性脂肪营养不良(BSCL)患者中鉴定得到的[5]。随后在检测对LDs形态发挥作用的基因筛查报告中,酵母Seipin同源基因Sei1p(Fld1p)被鉴定[10]。通过与人类Seipin基因比对,果蝇Seipin基因于2011年被鉴定[11]。在组织分布方面,哺乳动物中,Seipin在脑、睾丸和脂肪组织中表达量较高[5, 7, 12]。果蝇Seipin在脂肪体中表达量最高[11]。在亚细胞定位方面,Seipin是内质网(ER)膜蛋白,可以定位在ER-LD连接处[13]。
Seipin的N端和C端都面向细胞质,具有两个跨膜结构域和一个高度保守的管腔环[13],如图1所示。在不同的物种中,Seipin的N端和C端是不同的。由于翻译起始位点不同,人类Seipin基因编码的蛋白长度可以是398或462个氨基酸,其中较长的同工型在N端有额外的64个氨基酸。酵母Sei1p在二级结构和膜拓扑方面与人类Seipin具有较高的相似性。但是,酵母Sei1p仅包含少量氨基酸的Seipin结构域(N端12个氨基酸和C端11个氨基酸),而人类Seipin具有较长的胞质C端尾巴和同工型特异性的N端尾巴[14]。已有研究表明,在酵母中表达全长Seipin和缺乏胞质C端的截短Seipin均可以挽救LDs缺陷[8]。这表明Seipin域编码的核心功能通过进化得以保留。哺乳动物Seipin的C末端延伸可能赋予高级生物特有的其他功能。
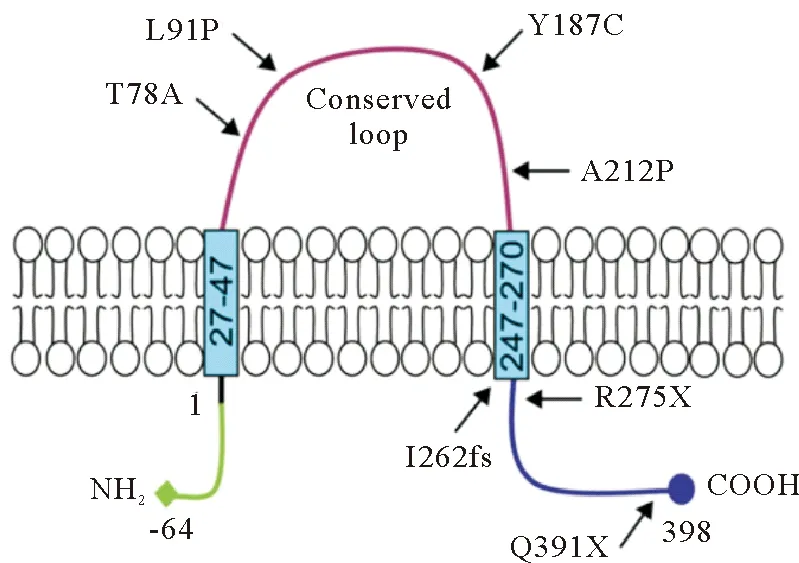
图1 人类Seipin的蛋白结构[15]
2 Seipin与脂肪分化
2.1 Seipin在脂肪分化中的作用
很多研究表明,Seipin在脂肪分化中发挥重要作用。Seipin-/-小鼠表现出严重的脂肪营养不良,WAT减少约90%,仅有少量脂肪存在于内脏和皮下组织[16-18]。此外,在小鼠和人原代脂肪细胞以及细胞系(C3H10T1/2、3T3-L1和MEF)脂肪分化过程中,Seipin基因的mRNA表达量显著增加[7, 19]。上述结果说明Seipin参与脂肪细胞分化过程。并且,Seipin主要在脂肪细胞分化后期发挥功能。从Seipin-/-小鼠中分离MEF,诱导其形成脂肪。结果发现,在缺乏Seipin的情况下,MEF细胞能够启动早期脂肪生成和LDs形成,并且脂肪形成相关基因pparγ和c/ebpα的表达量升高。然而,突变型MEF细胞不能发育为成熟的功能性脂肪细胞[17]。与上述研究结果一致,Seipin基因敲低的C3H10T1/2或3T3-L1细胞系中表现了显著的成脂缺陷,并伴随脂肪形成后期pparγ、c/ebpα和srebp1cmRNA水平降低[7, 12, 20]。因此,Seipin在维持脂肪细胞成熟过程中发挥重要作用。
Seipin在BAT中的调控功能似乎与在WAT中不同。Seipin-/-小鼠的BAT大量减少,剩余的BAT中包含少量的小LDs及巨型LDs[17]。然而,已有研究表明BAT形成不需要Seipin[21-22]。在棕色脂肪细胞系中,Seipin敲低对其分化几乎没有影响[22]。Seipin可能不直接影响棕色脂肪细胞的分化,而是通过其他途径间接影响其功能。Seipin-/-小鼠棕色脂肪细胞中cAMP / PKA介导的脂解作用增加,从而导致棕色脂肪形成过程中脂质含量降低[21]。因此,Seipin缺乏对WAT和BAT形成有不同的调节机制。可能是由于WAT和BAT本身存在差异, WAT主要功能是储存TG,而BAT中含大量线粒体,其储存TG较少。需要进一步的研究来揭示这种差异作用的分子机制。
2.2 Seipin调控脂肪分化的机制
Seipin调控脂肪分化的机制与其结构密切相关。C端结构域对Seipin调节脂肪分化至关重要[20]。这种调节涉及Seipin的C端与14-3-3β蛋白直接作用,从而在脂肪细胞形成过程中募集cofilin-1来重塑肌动蛋白细胞骨架[23]。该模型可以解释C端截短导致脂肪营养不良的原因,如I262fs、R275X和Q391X突变患者Seipin的基因C端部分或完全丢失[24-26]。但是,C端结构完整如A212P突变患者导致脂肪营养不良的原因仍不清楚。一种可能的机制是,A212P突变可能与前体脂肪细胞阶段的炎症途径激活有关[27];另一种可能是A212P突变导致二级蛋白结构破坏,从而导致核心序列不能感知脂肪水平[20, 23]。因此,Seipin通过其蛋白结构影响脂肪分化的机制仍有待进一步研究。
此外,PPARγ可以挽救Seipin缺陷模型中脂肪细胞分化和代谢紊乱[18]。噻唑烷二酮(TZD)类药物(包括吡格列酮和罗格列酮)是PPARγ激动剂。吡格列酮在BSCL2患者的MEF中诱导脂肪形成标记aP2的表达[28],并且可以改善Seipin-/-小鼠的胰岛素抵抗和肝脏脂肪变性[29]。临床上,TZD已被证明可促进HIV诱导的获得性脂肪营养不良中的脂肪恢复[30-31]。已有研究表明,Seipin缺乏可以通过PPARγ影响脂肪分化。在3T3-L1细胞中,Seipin可以与甘油-3-磷酸酰基转移酶(GPATs)相互作用并降低其活性。在Seipin缺乏细胞中,GPATs活性增加导致磷脂酸(PA)水平升高[32]。而PA已被证明是PPARγ的竞争性抑制剂,因此PA升高抑制PPARγ进而抑制脂肪分化。综上所述,Seipin可能通过调节PPARγ影响脂肪分化。
3 Seipin与LDs
3.1 Seipin调控LDs形态
已有很多研究表明Seipin除了调控脂肪分化,也在LDs形成中发挥重要作用。酵母全基因组筛选确定Seipin同源基因Sei1p是LDs形态的关键调控因子[8, 10]。在缺少Sei1p的情况下,酵母细胞中LDs形态发生变化,约30% Sei1p缺失酵母细胞中包含1个或几个巨型LDs;约60% Sei1p缺失酵母细胞中包含较小的聚集LDs;剩余10% Sei1p缺失酵母细胞中LDs非常小[8]。在其他Seipin缺陷模型中也观察到了异常的LDs形态。BSCL2患者淋巴母细胞和成纤维细胞系中体积较小且聚集的LDs数量增加[10, 33]。全身Seipin敲除小鼠的白色脂肪细胞出现小的LDs[16-17]。然而,有一些研究表明Seipin缺失细胞倾向于形成巨型LDs。巨型LDs存在于Seipin缺陷的睾丸[34]以及Seipin-/-MEFs分化的脂肪细胞中[17-18]。此外,Seipin缺乏的其他类型细胞如A431细胞[35]和3T3-L1细胞[32]等,经长时间油酸孵育后,也倾向于形成巨型LDs。因此,Seipin是调节LDs形态的重要因素。虽然在不同类型的Seipin缺陷细胞中LDs形态存在差异,但是主要出现了LDs较小以及部分LDs异常增大的表型。Seipin缺乏是如何引起LDs形态的剧烈变化?目前,已经提出了三种可能的机制:(1)调节ER-LD连接处;(2)调节LDs表面的磷脂;(3)调节ER稳态。
3.2 Seipin与LDs成熟
在LDs生物发生的早期,Sei1p缺陷会阻碍LDs的从头形成,并伴随着未包装TG在ER膜积聚[36]。Seipin及其同源基因可以定位在ER-LD连接处[10, 13],可能在LDs生物发生的不连续步骤中发挥作用。在果蝇S2细胞中,Seipin可以在ER和新生的小LDs的接触部位形成可移动的位点,从而促进脂质从ER转移到新生的LDs。如果没有Seipin,新生LDs便无法生长,从而导致大量初生LDs积累[9]。因此,Seipin可能不是在LDs生物发生的初始过程如晶状体形成和TG液滴出芽中发挥功能,而是在新生LDs的成熟过程中起调节作用,促进LDs的扩展,这一推论也可以解释Seipin缺陷细胞中出现许多小LDs的现象。目前,Seipin在ER-LD连接处作用机制还有待确定。最新的研究表明,Seipin支持结构均匀的ER-LD接触的形成,并促进TG从ER传递至LDs[37]。推测Seipin缺乏导致ER磷脂稳态被破坏,进而影响ER-LD连接处的完整性。
3.3 Seipin与磷脂
很多结果显示磷脂可能是连接Seipin和LDs形态的关键。Seipin缺失细胞可能通过改变磷脂的长度来增加LDs聚集和融合。已有研究表明,Sei1p缺失细胞中磷脂上的脂肪酰基链被缩短且更饱和[8],从而使LDs更容易融合形成巨型LDs。目前,关于Seipin调节磷脂长度的分子机制研究较少。
此外,PA作为一种常见的磷脂,其在Seipin调节LDs形态中发挥重要作用。Sei1p缺失菌株中可以观察到与LDs相邻的ER中PA积累,并且通过人类Seipin的表达可以逆转[38]。PA是一种可以改变膜曲率的锥形脂质,可以促进膜融合[39-40]。因此,Seipin缺失可能导致局部PA积累,进而促进LDs融合和生长。与此推测一致,在3T3-L1细胞中,敲低Seipin会显著增加细胞PA含量[41]。尽管Seipin的过表达对成脂诱导前3T3-L1细胞中PA几乎没有影响[32],但在脂肪细胞分化后,过表达Seipin会降低细胞PA[41]。与野生型小鼠相比,全身Seipin敲除和生殖细胞特异性敲除小鼠的睾丸中PA含量和PA/PL比率更高[34]。综上所述,PA升高可能是Seipin缺陷细胞中LDs异常增大的主要原因。
Seipin调节PA代谢的机制已有一些研究。Seipin似乎没有酶活性,这表明它的功能可能是结构性的,也可能是由相互作用的蛋白来发挥功能[42]。人类Seipin蛋白的结构解析结果表明,全长Seipin及其管腔结构域都可以结合阴离子磷脂[43]。这一结果提示Seipin可能通过特殊结构域直接结合PA,进而调节PA代谢。此外,很多研究表明,Seipin与Lipin1[44]、1-酰基甘油-3-磷酸O-酰基转移酶2(AGPAT2)[45]和GPATs[32]等存在相互作用。(1)Lipin1作为Mg2+依赖性的磷脂酸磷酸酶,可以将PA转化为二酰基甘油(DAG)。降低Lipin1会导致巨型LDs形成[46-47]。Lipin1与Seipin存在相互作用,相互作用域位于Seipin的C和N末端[41]。在3T3-L1细胞分化的第2天,敲低Seipin减少了Lipin1与ER结合的量,并增加局部PA的积累[41]。因此,Seipin可能在ER-LD连接处促进Lipin1功能。在Seipin缺乏的情况下,Lipin1表达降低进而导致PA增加。(2)AGPAT2将溶血磷脂酸(LPA)转化为PA,它位于PL和TG的生物合成途径中Lipins的上游[14]。人类Seipin可以与AGPAT2相互作用,且与Seipin和Lipin1相互作用不同,Seipin与AGPAT2相互作用依赖Seipin腔环和第一个跨膜结构域(与N端相邻)[45]。目前Seipin与AGPAT2相互作用对PA影响的研究未见报道,仍有待深入探究。(3)在酵母中,Sei1p最主要的相互作用蛋白是Gatlp(GPATs)[32]。作为PA生物合成中的限速步骤,GPATs可以将3-磷酸甘油转化为LPA[48]。Seipin缺陷细胞中增加的GPATs活性与异常增大的LDs形态有关。在3T3-L1细胞中,Seipin可以与GPAT3和GPAT4共免疫沉淀,该实验证明Seipin与GPATs相互作用并影响其活性[32]。与Seipin与Lipin1和AGPAT2相互作用促进其功能不同,Seipin与GPATs的相互作用导致GPATs功能的抑制。因此,在Seipin缺陷细胞中升高的GPATs活性通过增加PA,进而调控LDs形态[32]。综上所述,Seipin可能通过直接结合PA或与其他蛋白相互作用间接影响PA来调控LDs的形态。
3.4 Seipin和ER稳态
Seipin除了通过影响磷脂从而调控LDs形态外,也可以通过影响ER稳态来调控LDs形态。Sei1p的缺失会导致ER异常扩增[49]。荧光显微镜和电子显微镜显示,LDs在Sei1p缺陷细胞中的迁移受损,可能是由于ER结构异常[50]。LDs迁移障碍会导致TG积累,进而导致巨型LDs形成。ER是细胞内储存钙的主要细胞器,钙稳态的损害会导致内质网应激、细胞功能障碍甚至死亡[51]。肌浆网/内质网Ca2+-ATPase(SERCA)将胞质钙泵入ER内腔,并保持ER内腔和细胞质之间的钙浓度梯度。已有研究表明Seipin和SERCA存在相互作用[52]。Seipin缺陷会导致钙泵活性降低和SERCA功能丧失。目前,Seipin如何调节ER稳态仍不是很清楚。推测Seipin可能通过直接与蛋白相互作用调控ER稳态进而影响LDs形态;也可能通过调控磷脂的变化间接改变ER功能和钙稳态,进而影响LDs形态。
4 Seipin在鱼类中的研究进展
由于脂肪具有蛋白质节约效应,因此,高脂饲料在水产养殖中广泛使用[53]。但长期使用高脂饲料可能导致鱼类出现脂肪异常沉积等问题。系统研究Seipin在鱼类脂肪储存中的功能,有助于了解鱼类脂质积累的调控机理,有望为在生产实践中缓解鱼类脂质的异常沉积提供策略。目前,鱼类中Seipin的相关研究较少。在鱼类中,仅有斑马鱼(Daniorerio)Seipin基因被鉴定报道[54],但在大黄鱼(Larmichthyscrocea)、半滑舌鳎(Cynoglossussemilaevis)和大马哈鱼(Oncorhynchustshawytscha)等多数鱼类的基因组数据中已标记到Seipin基因。此外,鱼类Seipin的功能未见报道,仅有斑马鱼作为模式生物研究人类Seipin功能的少量研究。在斑马鱼幼鱼中表达人类Seipin N-糖基化突变体(N88S),突变体斑马鱼头部TG水平降低,同时躯干TG水平升高[55]。Seipin是进化保守的ER蛋白,其功能在各物种间似乎也比较保守,所以上述结果也一定程度说明鱼类Seipin可能与其机体脂肪储存相关。但是,鱼类Seipin对脂肪储存的影响和机制仍不清楚。因此,Seipin在鱼类中相关研究有待进一步开展。
5 展望
最近的研究已确定Seipin在脂肪储存中发挥重要作用。Seipin的基本生化功能似乎在物种间是保守的,但是在一些物种如鱼类中研究还是较少。为了缓解养殖鱼类脂肪异常沉积,促进水产养殖业健康可持续发展,Seipin的科学应用有很大前景。此外,不同鱼类脂肪储存有其特异性,但主要储存于肝脏、腹腔和肌肉等部位。因此,今后研究应选取代表性鱼类探究其主要储存脂肪的部位中Seipin是否发挥作用。并且,更多研究应集中在Seipin的上游调控机制,旨在为寻找缓解鱼类脂肪异常沉积的策略提供理论依据。
此外,Seipin在LDs成熟过程中发挥作用的分子机制仍需更多研究。尽管一些证据支持Seipin在磷脂代谢中的作用,但缺乏明确的机制。因此,今后的研究应采用更多模型系统,如不同物种及其细胞系来解决以下一些问题:Seipin本身是酶、辅因子还是转运蛋白?Seipin在不同组织中是否具有不同的生物学功能?对Seipin功能的进一步了解不仅可以提供对调控脂肪分化和LDs动力学机制的重要见解,也有望为缓解脂肪异常储存提供新策略。

