枸杞西洋参复合物提高小鼠免疫力效果的研究
张艳珍,王 菲,单 斌,王 亮,曹文秀
(1.青海省轻工业研究所,青海 西宁 810001;2.青海省保健食品行业协会,青海 西宁 810001)
西洋参,又称花旗参,在我国种植面积广泛。西洋参味苦,性凉,入心、肺、肾经,具有能滋阴补气、清热生津等功效[1]。西洋参中含有人参皂苷、多糖、甾醇、氨基酸、蛋白质等多种活性物质[2],现代医学研究表明,西洋参对中枢神经系统、心血管系统、内分泌系统、免疫系统以及对抗癌症都具有积极的影响[3-4]。枸杞是我国名贵药材,味甘、性平,有滋肝补肾、益精明目等功效[5-6]。研究表明,枸杞的主要活性物质有枸杞多糖、多酚及类胡萝卜素类等,具有降糖、降脂、增强免疫力的功效[7]。绞股蓝作为传统中药在我国有悠久的药用历史,是一种药食同源的植物,有“第二人参”之称[8]。据《本草纲目》记载,绞股蓝具有常用于治疮疖、虫咬,也具有凉血解毒、利小便等药效。绞股蓝含有皂苷、多糖、黄酮类等有效成分[9],具有很好的药理活性包括神经保护、 抗氧化、抗肿瘤、免疫调节、血脂调节等[10]。中医理论观点表明,机体免疫力低下是机体正气不足导致的身体各方面机能减退,难以抵御外邪的一系列正虚症状,主要治法为扶助正气、固本培元[11]。本研究依照《保健食品检验与评价技术规范》中有关增强免疫力功能的检测方法,研究枸杞西洋参复合物增强免疫力的效果。
1 材料与方法
1.1 受试材料
本研究所用的材料为枸杞西洋参复合物,由陕西佰草源生物科技有限公司提供,本品由西洋参、枸杞及绞股蓝等为原料制成,人体推荐量5.0g/d,折合枸杞生药4.2g/d,西洋参生药1.6g/d,绞股蓝生药6.0g/d。
1.2 试验动物
由北京维通利华试验动物技术有限公司提供SPF级雄性昆明种小鼠200只,体重18-22g。200只雌性小鼠(共五组分8项试验),每组用40只小鼠并随机分为4小组,每小组10只小鼠。一组进行迟发型变态反应(DTH);二组为小鼠测定和淋巴器官/体重比值测定和碳廓清试验;三组为ConA诱导的小鼠脾淋巴细胞转化试验和NK细胞活性测定;四组为抗体生成细胞检测和血清溶血素测定;五组为小鼠腹腔巨噬细胞吞噬鸡红细胞试验。设计0.417g/kg.BW、0.833g/kg.BW、1.667g/kg.BW枸杞西洋参复合物低、中、高三个剂量组,其剂量分别相当于人体推荐量的20倍、10倍、5倍,另设一个阴性对照组(蒸馏水)。各组动物按照剂量每天灌胃样品一次,灌胃容量均为20ml/kg.BW,阴性对照组灌等量蒸馏水,连续灌胃30d后开始试验。
1.3 试验方法
1.3.1ConA诱导的小鼠脾淋巴细胞转化试验(MTT法)
小鼠经口灌服枸杞西洋参复合物和蒸馏水30d 后,颈椎脱臼处死。无菌取脾,制备脾细胞悬液。将细胞悬浮于2.0ml的完全培养液中,用台酚蓝染色计数活细胞数(95%)以上,用RPMI1640培养液调整细胞浓度为3×106个/ml。按照程序中MTT法进行淋巴细胞增值反应,最后在Thermo酶标仪570nm测定OD值,计算ConA+与ConA-各孔的光密度差值,各剂量组结果与溶剂对照组比较进行方差分析。
1.3.2 小鼠迟发型变态反应(DTH)测定
样品小鼠在第26d时腹腔注射,注射2%(v/v)SRBC(0.2ml/只)进行致敏,于免疫后第四天每鼠左右足跖部皮下注射20%(v/v)SRBC(20μl/只)进行攻击。并与攻击前和攻击后24h分别测量每鼠足跖同一部位厚度,同一部位测三次,取平均值。计算攻击前、后足跖厚度差值,各剂量组结果与阴性对照组比较进行方差分析。
1.3.3 血清溶血素的测定
样品小鼠在第26d时腹腔注射,注射2%(v/v)SRBC(0.2ml/只),于免疫后4-5d摘眼球采血,分离血清。用生理盐水将血清倍比稀释,将不同稀释度的血清分别置于微量血凝板内,每孔100μl,再加入100μl 0.5%(v/v)SRBC悬液,混匀,装入湿润的平盘内加盖,于37℃温箱孵育3h进行血清溶血素测定。统计血球凝集度,计算相应抗体积数。
1.3.4小鼠腹腔巨噬细胞吞噬鸡红细胞试验(半体内法)
各组小鼠均腹腔注射20%(v/v)鸡红细胞悬液1ml/只,间隔30min,颈椎脱臼处死小鼠,经腹腔注入生理盐水2ml/只,转动鼠板1min后吸出腹腔洗液1ml平均分滴于2片载玻片上,放入垫有湿纱布的搪瓷盒内,37℃温育30min。孵毕,再用生理盐水漂洗、晾干。以1∶1的丙酮甲醇溶液固定,4% Giemsa-磷酸缓冲液染色,再用蒸馏水漂洗晾干。镜检,油镜下计数100个巨噬细胞,计按照以下公式求出吞噬率、吞噬指数。
1.3.5 小鼠碳廓清试验
小鼠末次给药结束后1h,给各组小鼠尾静脉注射印度墨汁(生理盐水4.0倍稀释)10ml/kg.BW,于注射墨汁后2min及10min分别准时内眦静脉丛采血各20μl,并迅速加入到2ml 0.1%碳酸钠溶液中并摇匀。以碳酸钠溶液作为空白对照,紫外分光光度计600nm波长处测光密度值(OD)。将小鼠处死后取肝脏和脾脏,用滤纸吸干脏器表明血污,分别称重。按照以下公式计算吞噬指数(a),受试样品组的吞噬指数显著高于对照组,可判定结果阳性。
K为未经校正吞噬指数,OD1为t1时(2min)血标本光度度值,OD2为t2时(10min)血标本光密度值。
1.3.6抗体生成细胞检测(Jerne改良玻片法)
样品小鼠在第26d时腹腔注射,注射2%(v/v)SRBC(0.2ml/只),将SRBC免疫5d后的小鼠颈椎脱臼处死,取出脾脏,放在盛装有Hank’s液的小平皿中,轻轻磨碎脾脏,制成细胞悬液,经200目筛网过滤,离心10min(1000r/min),用Hank’s液洗2遍,最后将细胞悬浮在5ml RPMI1640培养液中,计数到细胞,并将细胞浓度调整为5×106个/ml。
空斑的测定:将表层培养基(1g琼脂糖加双蒸水至100ml)加热溶解后,放入45-50℃水浴保温,与等量pH 7.2-7.4、2倍浓度的Hank’s液混合后进行分装,每管0.5ml,再向管内加50μl 10%(v/v)SRBC(用SA缓冲液配制),20μl脾细胞悬液(5×106个/ml),迅速混匀,倾倒于已刷琼脂糖薄层的玻片上,做平行片,待琼脂凝固后,将玻片水平扣放在片架上,放入二氧化碳培养箱中孵育1.5h,然后用SA缓冲液稀释补体(1∶8)加入玻片架凹槽内,继续育温1.5h后,计数溶血空斑数。各剂量组结果与阴性对照组比较进行方差分析。
1.3.7 NK细胞活性测定
试验前24h将靶细胞进行传代培养。用前以Hank’s液洗3次,用RPMI1640完全培养液调整细胞浓度为4×105个/ml。
无菌取脾,置于盛有适量无菌Hank’s液的小平皿中,用镊子轻轻将脾磨碎,制成单细胞悬液。过200目筛网,用Hank’s液洗2次,每次离心10min(1000r/min)。弃上清将细胞浆弹起,加入0.5ml灭菌水20s,裂解红细胞后再加入0.5ml 2倍Hank’s液及8ml Hank’s液,离心10min(1000r/min),用1ml含10%小牛血清的RPMI1640完全培养液重悬,用1%冰醋酸稀释后计数(活细胞数应该在95%以上),用台盼蓝染色计数活细胞数(应在95%以上),最后用RPMI1640完全培养液调整细胞浓度为2×107个/ml。
分别取靶细胞和效应细胞各10μl,加入U型96孔培养板中:靶细胞自然释放孔加靶细胞和培养液各100μl,靶细胞最大释放孔加靶细胞和1% NP40各10μl;上述各项均设三个平行孔,于37℃、5% CO2培养箱中培养4h,然后将96孔培养板以(1500r/min)离心5min,每孔吸取上清100μl置平底96孔培养板中,同时加入LDH基质液100μl,反应8min,每孔加入1mol/L的HCL 30μl,在酶标仪490nm处测定光密度值(OD)。按照下式计算NK细胞活性,各剂量组结果显著高于阴性对照组判定结果阳性。
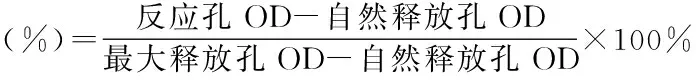
2 试验结果
2.1 各剂量组枸杞西洋参复合物对小鼠体重的影响
本试验中不同剂量枸杞西洋参复合物在ConA诱导的小鼠脾淋巴细胞转化试验、小鼠迟发型变态反应(DTH)、血清溶血素的测定、小鼠腹腔巨噬细胞吞噬鸡红细胞试验、小鼠碳廓清试验、抗体生成细胞检测及NK细胞活性测定的五组实验中,各剂量组小鼠各期体重无明显变化,且与阴性对照组比较,无显著差异。见表1-5。由此可见,剂量对小鼠体重的作用效果较小。

表1 各剂量组枸杞西洋参复合物对试验一组小鼠体重的影响(x±s)
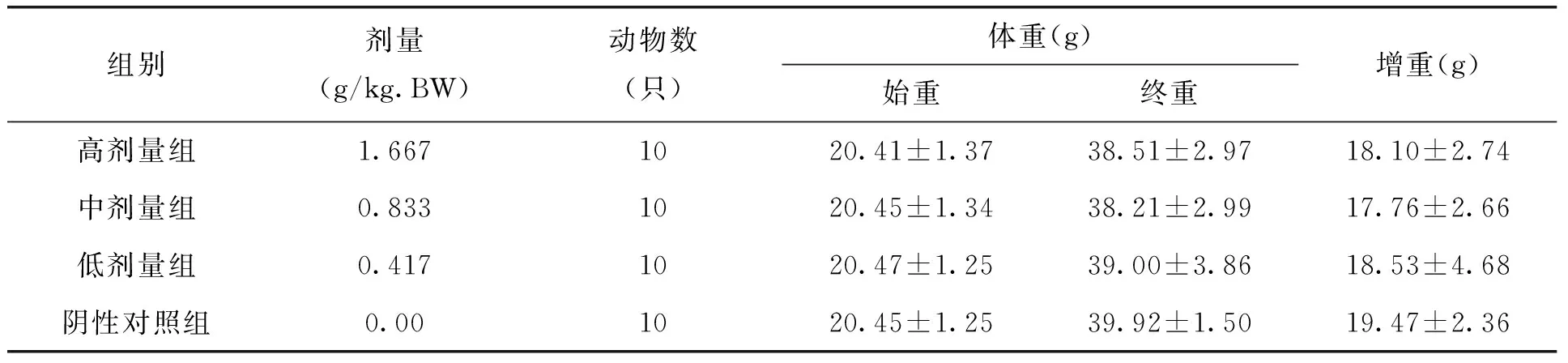
表2 各剂量组枸杞西洋参复合物对试验二组小鼠体重的影响(x±s)

表3 各剂量组枸杞西洋参复合物对试验三组小鼠体重的影响(x±s)

表4 各剂量组枸杞西洋参复合物对试验四组小鼠体重的影响(x±s)
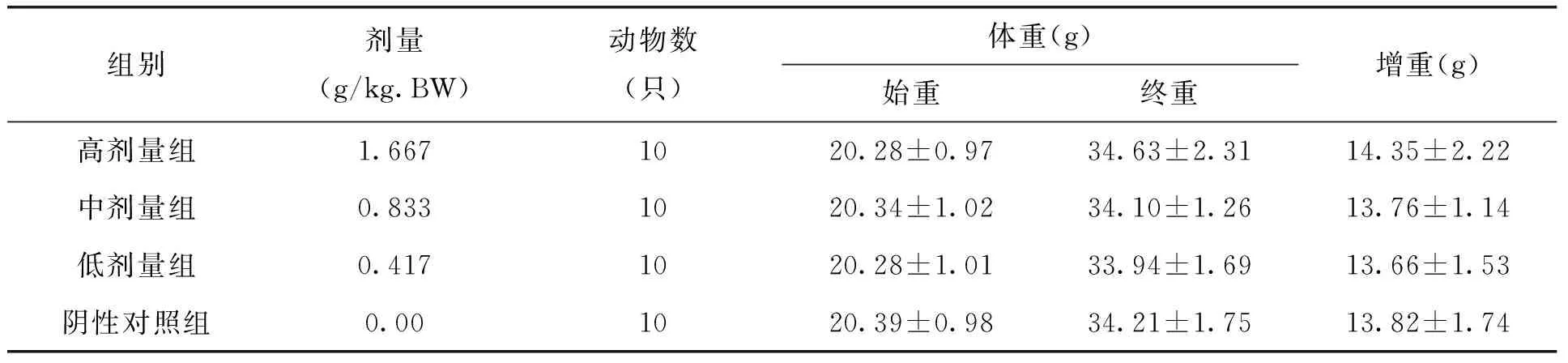
表5 各剂量组枸杞西洋参复合物对试验五组小鼠体重的影响(x±s)
2.2 各剂量组枸杞西洋参复合物对小鼠淋巴器官/体重比值的影响
由表6中试验数据可以看出,各剂量组枸杞西洋参复合物对小鼠胸腺/体重比值和脾脏/体重比值无明显影响,且与阴性对照组比较,无显著差异(P>0.05),由此可见,不同剂量的枸杞西洋参复合物对小鼠淋巴器官和体重的影响整体相对较小。
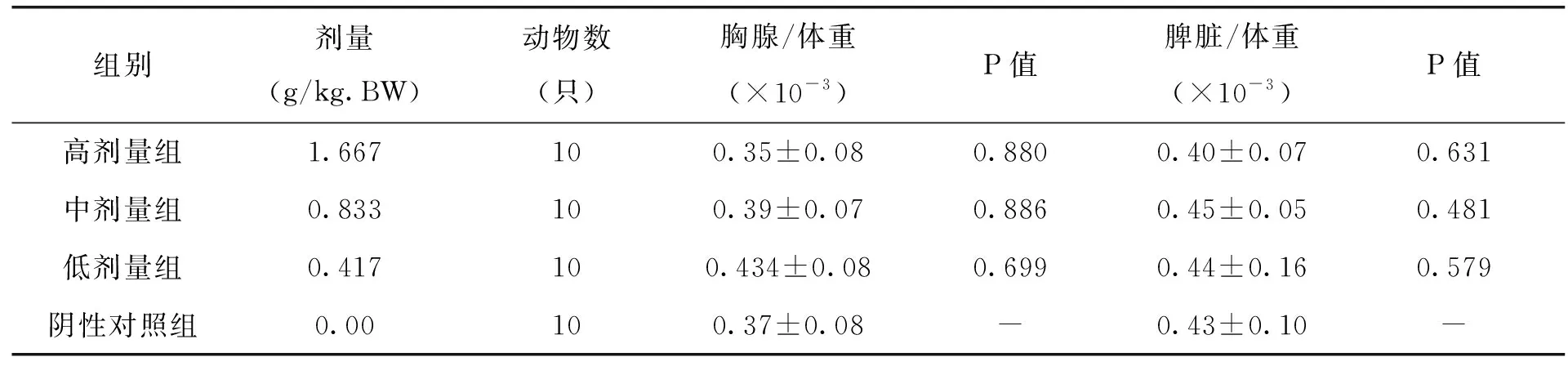
表6 各剂量组枸杞西洋参复合物对小鼠淋巴器官/体重比值的影响(x±s)
2.3 各剂量组枸杞西洋参复合物对小鼠脾淋巴细胞转化能力及小鼠迟发型变态反应的影响
由表7中试验数据可以看出,与阴性对照组比较,处理组随着枸杞西洋参复合物剂量的增加,能够显著增强ConA诱导的小鼠脾淋巴细胞转化能力,说明枸杞西洋参复合物剂量越高,越能加强淋巴细胞增值。另外,足跖厚度差值的实验数据可以看出,各剂量组小鼠组足跖厚度差值明显增大,与对照组差异显著(P<0.05),说明枸杞西洋参复合物的剂量对小鼠的足趾厚度影响较大。
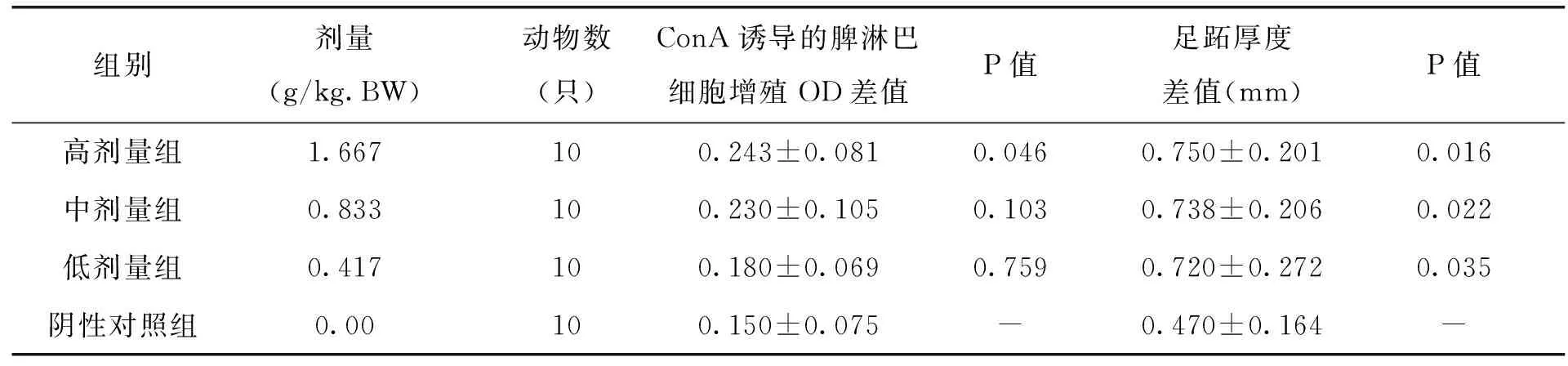
表7 各剂量组枸杞西洋参复合物对ConA诱导的小鼠脾淋巴细胞转化能力及小鼠迟发型变态反应的影响(x±s)
2.4 各剂量组枸杞西洋参复合物对小鼠血清溶血素水平的影响
由表8中的试验结果可以看出,随着枸杞西洋参复合物剂量的升高,小鼠体内血清溶血素(抗体积数)逐渐增加,且显著高于阴性对照组,说明枸杞西洋参复合物剂量的增加能够有效提升小鼠的血清溶血素水平,其中高剂量组的效果最佳。可以猜测,随着剂量的再次增加,其抗体积数可能还会增加,但是同样也可能带来一定的副作用。
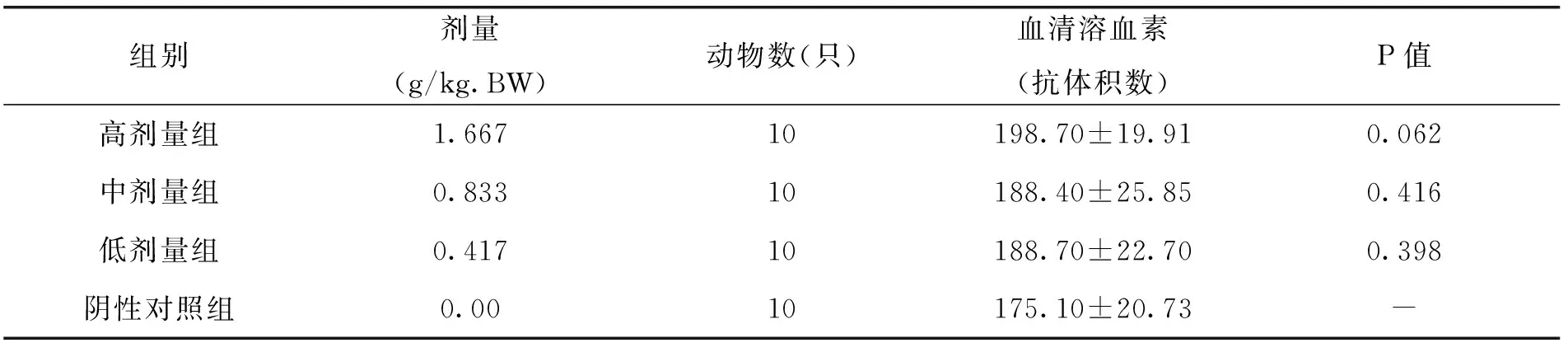
表8 各剂量组枸杞西洋参复合物对小鼠血清溶血素水平的影响(x±s)
2.5 各剂量组枸杞西洋参复合物对小鼠腹腔巨噬细胞吞噬鸡红细胞能力的影响
由表9中试验结果可以看出,随着枸杞西洋参复合物剂量的增加,小鼠腹腔巨噬细胞吞噬百分率逐渐增大,且与阴性对照组比较,高剂量组吞噬率、吞噬指数显著升高,差异显著(P<0.05),说明枸杞西洋参复合物剂量的增加是对小鼠腹腔的巨噬细胞吞噬能力有积极的影响效果。
2.6 各剂量组枸杞西洋参复合物对小鼠碳廓清功能的影响
由表10中试验结果可以看出,随着枸杞西洋参剂量的增加,小鼠碳廓清功能作用逐渐显著试验小鼠的吞噬指数a逐渐增加,其中与阴性对照组比较,高、中剂量组能显著提高小鼠碳廓清吞噬指数,差异显著(P<0.05),说明枸杞西洋参复合物对小鼠的碳廓清功能这一方面具有明显的增强作用,可以有效提升吞噬指数a。
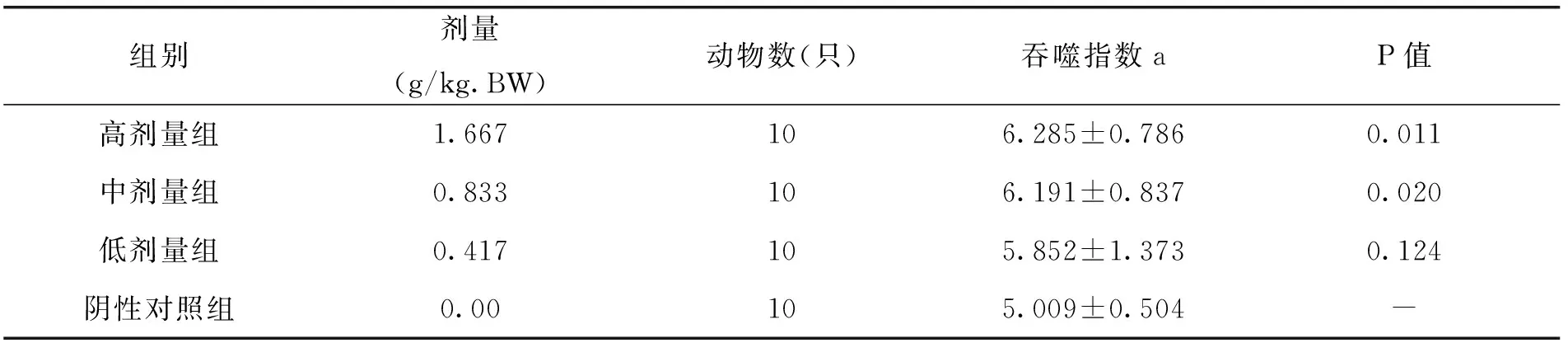
表10 各剂量组枸杞西洋参复合物对小鼠碳廓清功能的影响(x±s)
2.7 各剂量组枸杞西洋参复合物对小鼠抗体生成细胞功能的影响
由表11中的试验结果可以看出,随着枸杞西洋参复合物剂量的增加,小鼠抗体生成细胞功能作用不断提升,其中,低、中、高剂量的枸杞西洋参复合物处理组与阴性对照组的溶血空斑数相比,差异不显著。但枸杞西洋参复合物对小鼠的小鼠抗体生成细胞功能这一方面具有一定的作用。
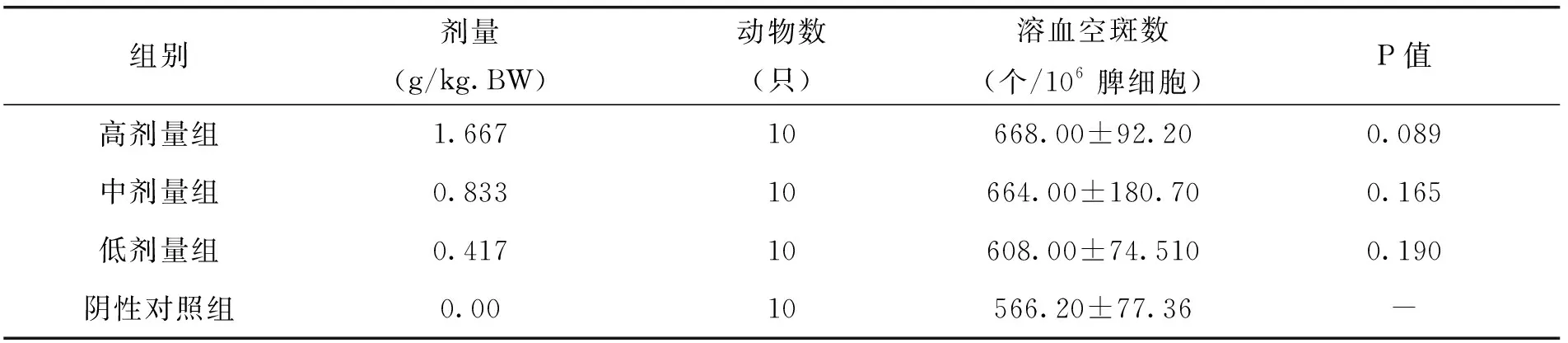
表11 各剂量组枸杞西洋参复合物对小鼠抗体生成细胞功能的影响(x±s)
2.8 各剂量组枸杞西洋参复合物对小鼠NK细胞活性的影响
由表12中的试验结果可以看出,随着枸杞西洋参复合物剂量的增加,小鼠NK细胞活性显著升高,与阴性对照组比较,高、中剂量组小鼠NK细胞活性均显著升高,与阴性对照相比,差异极显著(P<0.01)。说明枸杞西洋参复合物对小鼠NK细胞活性具有一定的促进作用。
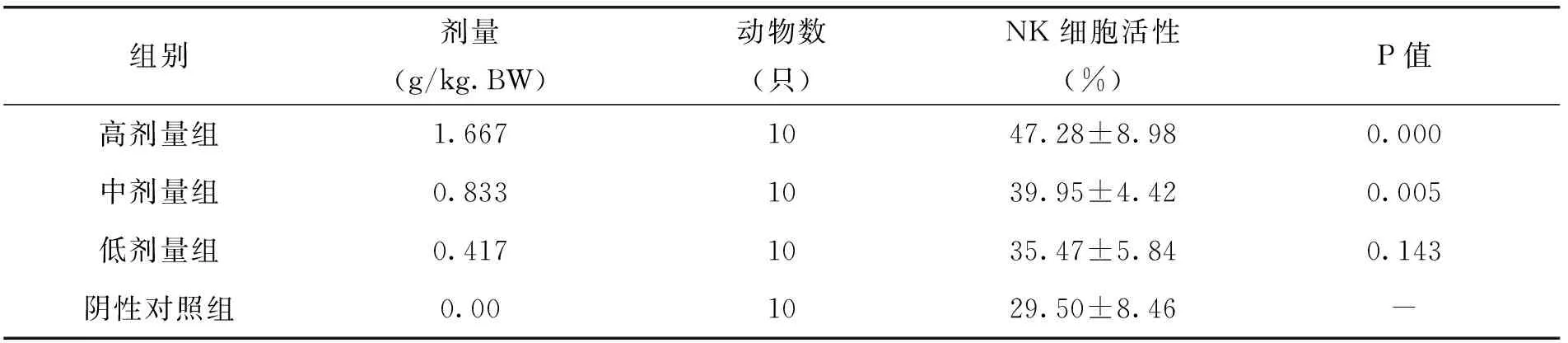
表12 各剂量组枸杞西洋参复合物对小鼠NK细胞活性的影响(x±s)
3 结论
免疫指的是机体识别、清除外来物质,并将其排出体外的一种生理学功能,分为特异性免疫与非特异性免疫,免疫与机体的亚健康状态有密切的关系[12]。研究数据表明,西洋参、枸杞及绞股蓝均具有增强免疫力的功效。为验证枸杞西洋参复合物对机体是否具有免疫调节功能,本研究按照《保健食品检验与评价技术规范》中有关增强免疫力功能的检测方法,研究了枸杞西洋参复合物对小鼠免疫功能的影响。
试验结果表明,与阴性对照组比较,各剂量组对小鼠各期体重、小鼠胸腺/体重比值和脾脏/体重比值无明显影响,各剂量组小鼠抗体积数及溶血空斑数均高于对对照组,但差异无显著性(P>0.05)。与阴性对照组比较,高剂量组能够显著增强ConA诱导的小鼠脾淋巴细胞转化能力,差异显著(P<0.05)。与阴性对照组比较,高剂量组吞噬率、吞噬指数显著升高,差异显著(P<0.05)。与阴性对照组比较,各剂量组小鼠组足跖厚度差值显著增高,差异显著(P<0.05)。与阴性对照组比较,高、中剂量组能显著提高小鼠碳廓清吞噬指数及NK细胞活性,差异显著(P<0.05)。
根据《保健食品功能学评价程序和检验方法》中增强免疫力实验结果判定标准,枸杞西洋参复合物对细胞膜免疫功能测定以及机体免疫功能测定结果均为阳性,认为该产品具有增强免疫力的作用。本研究可为后续相关产品的开发及广泛应用提供有力的佐证,为其进一步临床应用及资源开发提供科学依据。

