miR-374-5p调控Bax影响缺氧诱导心肌细胞凋亡的分子机制
朱磊 付攀 王立莎
(湖北医药学院附属襄阳市第一人民医院 1心血管内科,湖北 襄阳 441000;2放射影像科)
心肌梗死(MI)是致死率最高的心血管疾病之一,持续性的心肌缺血引起的缺氧是引起心肌梗死时细胞凋亡的主要原因〔1〕。因此,如何有效地增强心肌细胞活力、减少心肌细胞凋亡、改善血流障碍是治疗心肌梗死的重要策略。B细胞淋巴瘤(Bcl)-2相关X蛋白(Bax)基因是Bcl-2家族成员之一,其编码的Bax蛋白通过诱导细胞色素c的释放,激活含半胱氨酸的天冬氨酸蛋白水解酶(caspase)-3介导的细胞凋亡信号通路,促进细胞凋亡〔2,3〕。研究表明芹菜素和黄芩茎叶总黄酮通过下调Bax表达对缺血或缺氧造成的心肌细胞凋亡有一定的保护作用〔4,5〕。miRNAs是一类内源性非编码小RNA,在转录后水平参与调控各种生物学过程。何淑芳等〔6〕在用芯片法筛选缺氧处理诱导大鼠心肌细胞差异表达的miRNA时发现,缺氧可以下调大鼠心肌细胞中miR-374-5p的表达。但miR-374-5p对缺氧诱导的大鼠凋亡的影响且miR-374-5p能否介导Bax表达参与对缺氧诱导的大鼠凋亡的调控目前并不清楚。本实验以H9c2细胞缺氧处理建立细胞模型,旨在探讨miR-374-5p对缺氧诱导心肌细胞凋亡的影响及其可能的调控机制。
1 材料与方法
1.1主要实验材料、试剂与仪器 大鼠心肌细胞H9c2和CP-R073购自ATCC;胎牛血清、DMEM培养基及1%青/链霉素购自美国Hyclone公司;LipofectamineTM2000相关转染试剂和Trizol试剂购自美国Invitrogen公司。miR-NC、miR-374-5p、pcDNA3.1、pcDNA3.1-Bax、WT-Bax和MUT-Bax由上海生工生物工程有限公司构建和测序;miR-374-5p、Bax、U6和GAPDH引物购自广州锐博公司;双荧光素酶报告基因检测试剂盒购自美国Promega公司;RIPA裂解液、二喹啉甲酸(BCA)蛋白定量试剂盒、四甲基偶氮唑蓝(MTT)试剂、DMSO、聚偏氟乙烯(PVDF)膜、Western洗涤液及封闭液购自北京索莱宝生物技术公司;Bax、GAPDH、细胞周期蛋白(Cyclin)D1、Bcl-2和p21等鼠抗人一抗购自美国Santa Cruz公司;Annexin V/PI试剂盒购自贝博生物公司;辣根过氧化物酶(HRP)标记的抗鼠二抗购自武汉博士德公司。凝胶成像系统购自BIO-RID公司;荧光定量聚合酶链反应(PCR)仪购自美国ABI公司;流式细胞仪购自美国BD公司;酶标仪购于美国Awareness Technology公司。
1.2细胞培养与转染 用含有10%胎牛血清和1%青/链霉素的DMEM培养基在37℃、CO2体积分数5%的培养条件下培养心肌细胞(H9c2和CP-R073),当细胞约铺满瓶底的80%时,用胰酶处理后进行传代培养。细胞转染:取对数期生长良好的H9c2细胞,调整细胞浓度,以2×105个/孔细胞数接种于96孔培养板,当细胞融合度达到50%时,利用LipofectamineTM2000将miR-NC和miR-374-5p分别转染H9c2细胞,于细胞培养箱常规培养24 h,随后进行缺氧处理8 h后进行后续实验。将心肌细胞H9c2和CP-R073分别在缺氧条件(37℃、5%CO2和95%N2)下培养8 h,以缺氧处理的H9c2细胞建立心肌细胞缺氧模型,实验分为6组:H9c2常氧培养组(不做处理)、H9c2缺氧培养组(缺氧处理)、缺氧+miR-374-5p组(转染miR-374-5p后,进行缺氧处理)、缺氧+miR-NC组(转染miR-NC后,进行缺氧处理)、缺氧+miR-374-5p+pcDNA3.1-Bax组(转染miR-374-5p和pcDNA3.1-Bax后,进行缺氧处理)和缺氧+miR-374-5p+pcDNA3.1组(转染miR-374-5p和pcDNA3.1后,进行缺氧处理)。
1.3qRT-PCR检测 按照Trizol试剂使用说明书分别从各组细胞中提取总RNA,将RNA逆转录为cDNA,随后以cDNA为模板进行qRT-PCR扩增。U6和GAPDH分别作为miR-374-5p和Bax mRNA的内源性对照,用2-ΔΔCt方法计算目标基因的相对表达量。
1.4MTT检测 取各处理组H9c2细胞,分别于转染完成后24 h、48 h和72 h时间点每孔加入20 μl的MTT溶液,室温反应4 h后吸去孔内上清液,每孔再加入150 μl的DMSO,震荡5 min至完全溶解。用酶标仪在490 nm波长处测定各孔的OD值(以空白孔进行调零)。
1.5流式细胞术检测 取各组H9c2细胞,用胰酶(不含EDTA)消化后离心,弃上清收集各组细胞,用磷酸盐缓冲液(PBS)漂洗细胞后,加入300 μl的1×结合缓冲液吹打重悬细胞,然后加入5 μl的Annexin V-FITC混匀,室温避光孵育15 min,随后加入5 μl的PI染色,补加200 μl的1×结合缓冲液后用流式细胞仪进行检测。
1.6Western印迹检测 收集各组细胞后加入RIPA细胞裂解液裂解细胞,离心后收集细胞总蛋白,用BCA法进行蛋白定量。用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离蛋白,将蛋白转至PVDF膜上,用洗涤液洗膜后加入封闭液室温封闭2 h,吸尽封闭液后加入相应的稀释好的抗Bax、GAPDH、CyclinD1和P21的特异性抗体4℃孵育过夜,用洗涤液后,加入HRP标记的二抗(1∶500)室温孵育膜2 h,用洗膜液洗膜3次后,用化学发光显色系统进行显色,用凝胶成像系统进行拍照,并利用ImageJ软件分析各蛋白质的相对表达量(以GAPDH作为内参)。
1.7双荧光素酶报告基因检测 利用靶基因预测数据库Targetscan网站(http://www.targetscan.org/vert/)预测miR-374-5p的靶基因。发现miR-374-5p的5′端可与Bax的3′-UTR特异性结合,猜测Bax是miR-374-5p的靶基因。为验证这一猜想,构建野生型WT-Bax和突变型MUT-Bax的Bax 3′-UTR荧光素酶报告载体。利用LipofectamineTM2000将miR-374-5p和miR-NC分别与WT-Bax和MUT-Bax共转染H9c2细胞。转染48 h后,利用双荧光素酶报告基因检测试剂盒测点各组H9c2细胞的荧光素酶活性。
1.8统计学分析 采用SPSS19.0软件进行t检验、单因素方差分析。
2 结 果
2.1miR-374-5p在正常培养及缺氧处理的大鼠心肌细胞H9c2和CP-R073中的表达 与H9c2常氧培养组miR-374-5p的表达水平(0.86±0.08)相比,H9c2缺氧培养组表达显著降低(0.34±0.03,P<0.05);与CP-R073常氧培养组miR-374-5p的表达水平(0.73±0.07)相比,CP-R073缺氧培养组表达显著降低(0.52±0.05,P<0.05)。表明缺氧处理可抑制大鼠心肌细胞中miR-374-5p的表达。
2.2过表达miR-374-5p对缺氧培养的大鼠心肌细胞H9c2增殖的影响 与miR-NC组相比,miR-374-5p组缺氧培养的大鼠心肌细胞H9c2中miR-374-5p表达显著增加(P<0.05),表明成功构建了过表达miR-374-5p的H9c2细胞株。与miR-NC组相比,miR-374-5p组缺氧培养的大鼠心肌细胞H9c2在24 h、48 h和72 h时间点细胞增殖活力显著上升,CyclinD1蛋白表达显著升高,P21蛋白表达显著降低(P<0.05)。见图1、表1。表明过表达miR-374-5p可减轻缺氧处理对大鼠心肌细胞的增殖抑制。

图1 过表达miR-374-5p对缺氧培养的H9c2细胞增殖蛋白表达的影响

表1 过表达miR-374-5p对缺氧处理的H9c2细胞增殖及凋亡的影响
2.3过表达miR-374-5p对缺氧处理的大鼠心肌细胞H9c2凋亡的影响 与miR-NC组相比,miR-374-5p组缺氧处理的H9c2细胞的凋亡率显著降低,促凋亡蛋白Bax的表达显著降低,抗凋亡蛋白Bcl-2的表达显著升高(P<0.05)。见表1、图2、图3。表明过表达miR-374-5p可减弱缺氧处理对大鼠心肌细胞的促凋亡作用。

图2 过表达miR-374-5p对缺氧处理的H9c2细胞凋亡的影响

图3 过表达miR-374-5p对缺氧处理的H9c2细胞凋亡蛋白表达的影响
2.4miR-374-5p靶向调控Bax miR-374-5p与WT-Bax的3′UTR之间存在特异性结合位点。见图4。野生型Bax基因荧光素酶表达载体WT-Bax和miR-374-5p mimics共转染H9c2细胞后,miR-374-5p组H9c2细胞荧光素酶活性较再转染miR-NC组明显降低(P<0.05);而突变型Bax基因荧光素酶表达载体MUT-Bax和miR-374-5p mimics共转染H9c2细胞后,miR-374-5p组H9c2细胞荧光素酶活性较再转染miR-NC组差异不显著(P>0.05)。见表2。与miR-NC组比较,miR-374-5p组H9c2细胞Bax mRNA和Bax蛋白的表达量显著减低;与anti-miR-NC组比较,anti-miR-374-5p组H9c2细胞Bax mRNA和Bax蛋白的表达量显著升高(P<0.05)。见图5、表3。表明Bax是miR-374-5p的靶基因,miR-374-5p可负性调控Bax的表达。

图4 Bax的3′UTR含有miR-374-5p的互补序列

表2 双荧光素酶报告实验

1~4:miR-NC组,miR-374-5p组,anti-miR-NC组,anti-miR-374-5p组图5 miR-374-5p调控Bax的表达

表3 miR-374-5p调控Bax的表达
2.5过表达Bax能逆转miR-374-5p对缺氧处理的大鼠心肌细胞H9c2增殖的促进作用 与miR-374-5p+pcDNA3.1相比,miR-374-5p+pcDNA3.1-Bax组缺氧处理的大鼠心肌细胞H9c2在24 h、48 h和72 h时间点细胞增殖活力显著下降,CyclinD1蛋白表达显著降低,P21蛋白表达显著升高(P<0.05)。见图6、表4。表明过表达Bax能逆转miR-374-5p对缺氧处理的H9c2细胞增殖的促进作用。
2.6过表达Bax能逆转miR-374-5p对缺氧处理的大鼠心肌细胞H9c2凋亡的抑制作用 与miR-374-5p+pcDNA3.1组相比,miR-374-5p+pcDNA3.1-Bax组缺氧处理的H9c2细胞的凋亡率显著升高,Bax蛋白的表达显著升高,Bcl-2蛋白的表达显著降低。见表4,图7。表明过表达Bax能逆转miR-374-5p对缺氧处理的大鼠心肌细胞H9c2的凋亡抑制作用。

1,2:miR-NC组,miR-374-5p组,下图同图6 过表达Bax能逆转miR-374-5p对缺氧处理的H9c2细胞增殖蛋白的表达

表4 过表达Bax能逆转miR-374-5p对缺氧处理的H9c2细胞增殖及凋亡的影响
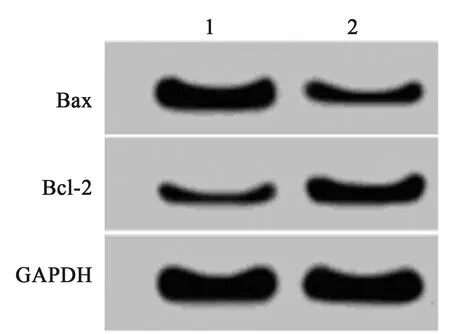
图7 过表达Bax能逆转miR-374-5p对缺氧处理的H9c2细胞凋亡蛋白的表达
3 讨 论
研究表明miRNA通过调控心肌细胞的凋亡,在心肌缺氧/复氧和缺血/再灌注等过程中发挥重要作用〔7〕。miRNA-340-5p通过调控Act1/NF-κB通路对缺氧/复氧引起的心肌细胞凋亡具有抑制作用〔8〕;miRNA-133a通过下调凋亡蛋白Bcl-xl和Bcl-xs的表达减少再灌注后心肌细胞凋亡,对缺血处理的心肌具有保护作用〔9〕;然而,miR-145-5p靶向双特异性磷酸酶6诱导缺血再灌注后细胞凋亡〔10〕。miR-374-5p是心肌细胞中异常低表达的miRNA之一,有报道称,在七氟烷预处理后大鼠心肌缺血再灌注模型中,miRNA-374通过激活PI3K/Akt通路抑制SP1发挥保护作用;miR-374还可通过抑肌营养不良蛋白(dtna)介导的Notch1轴活性,对胸硬膜外麻醉小鼠心肌缺血再灌注损伤的保护作用〔11,12〕。Bax被认为是最重要的促凋亡基因,缺氧诱导的心肌细胞凋亡是在对多种凋亡相关基因的调控下进行的。多项研究表明,通过抑制Bax基因表达,可减轻缺氧诱导的心肌细胞损伤〔13,14〕。
CyclinD1和P21是主要的细胞周期调控蛋白,CyclinD1通过与CDKs结合,促进Rb的磷酸化,进而通过调控一系列核内过程,促进细胞增殖〔15〕;P21则通过抑制CyclinD1/CDKs复合物的活性抑制细胞增殖〔16〕。Bax和Bcl-2是两种结构相似作用相反的可溶性蛋白,当细胞凋亡信号发出时,Bax通过胞质进入线粒体,与线粒体膜上的Bcl-2结合形成二聚体发挥作用〔17,18〕。当Bcl-2表达较高时,形成异源二聚体(Bax/Bcl-2)抑制细胞凋亡;当Bax表达较高时,形成同源二聚体(Bax/Bax)促进细胞凋亡。miR-374-5p可能通过下调P21和Bax表达,上调CyclinD1和Bcl-2表达,发挥促进H9c2细胞增殖,促进细胞凋亡的作用。本研究结果提示miR-374-5p通过下调Bax表达抑制缺氧诱导心肌细胞凋亡。
综上,miR-374-5p在缺氧诱导的大鼠心肌细胞中低表达,且miR-374-5p可通过靶向下调Bax表达抑制缺氧诱导的心肌细胞凋亡。

