UHPLC法结合超滤法测定连钱草中3种成分的血浆蛋白结合率
陈伟康 刘德鸿 熊明朋 袁惠 周国平
中图分类号 R969.1;R927.2 文献标志码 A 文章编号 1001-0408(2021)22-2720-04
DOI 10.6039/j.issn.1001-0408.2021.22.06
摘 要 目的:建立测定连钱草中迷迭香酸、咖啡酸、绿原酸血浆蛋白结合率的方法。方法:采用超高效液相色谱法结合超滤法测定连钱草中迷迭香酸、咖啡酸、绿原酸在新西兰兔体内的血浆蛋白结合率。以Phenomenex Luna? C18为色谱柱,以乙腈(A)-0.1%甲酸溶液(B)为流动相进行梯度洗脱,流速为0.5 mL/min,柱温为45 ℃,检测波长为327 nm,进样量为3 μL。结果:在低、中、高质量浓度下,迷迭香酸的血浆蛋白结合率分别为(97.78±1.67)%、(94.32±1.42)%、(95.12±1.51)%(n=3),咖啡酸的血浆蛋白结合率分别为(90.12±2.33)%、(89.53±1.98)%、(90.23±1.56)%(n=3),绿原酸的血浆蛋白结合率分别为(63.23±2.12)%、(67.87±1.06)%、(62.34±1.34)%(n=3)。結论:所建方法操作简单、分析时间较短,可用于测定连钱草中迷迭香酸、咖啡酸、绿原酸的血浆蛋白结合率。
关键词 连钱草;迷迭香酸;咖啡酸;绿原酸;血浆蛋白结合率;超高效液相色谱;超滤法;兔
Determination of Plasma Protein Binding Rate of 3 Components from Glechoma longituba by UHPLC Combined with Ultrafiltration
CHEN Weikang,LIU Dehong,XIONG Mingpeng,YUAN Hui,ZHOU Guoping(Jiangxi Institute for Drug Control/NMPA Key Laboratory of Quality Evaluation of Chinese Patent Medicine/Jiangxi Province Engineering Research Center of Drug and Medical Device Quality, Nanchang 330029, China)
ABSTRACT OBJECTIVE: To establish a method for the determination of plasma protein binding rate of rosmarinic acid, caffeic acid and chlorogenic acid from Glechoma longituba. METHODS: UHPLC method combined with ultrafiltration method was adopted to determine the plasma protein binding rate of rosmarinic acid, caffeic acid and chlorogenic acid from G. longituba in the plasma of New Zealand rabbits. The determination was performed on a Phenomenex Luna? C18 column with mobile phase consisted of acetonitrile (A)-0.1% formic acid solution (B) (gradient elution) at the flow rate of 0.5 mL/min. The column temperature was set at 45 ℃, and the detection wavelength was 327 nm. The sample size was 3 μL. RESULTS: At low, medium and high concentrations, the plasma binding rates of rosmarinic acid were (97.78±1.67)%, (94.32±1.42)%, (95.12±1.51)%, respectively (n=3); those of caffeic acid were (90.12±2.33) %, (89.53±1.98)%,(90.23±1.56)%, respectively (n=3); those of chlorogenic acid were (63.23±2.12)%, (67.87±1.06)%, (62.34±1.34)%, respectively (n=3). CONCLUSIONS: Established method is easy to operate and shorter time for analysis. It can be used to determine the plasma protein binding rate of rosmarinic acid, caffeic acid and chlorogenic acid in G. longituba.
KEYWORDS Glechoma longituba; Chlorogenic acid; Caffeic acid; Rosmarinic acid; Plasma protein binding rate; UHPLC; Ultrafitration; Rabbit
连钱草又名活血丹、钹儿草、佛耳草,为唇形科植物活血丹Glechoma longituba(Nakai)Kupr.的干燥地上部分[1]。该药材具有利湿通淋、清热解毒、散瘀消肿的作用,被临床广泛用于治疗热淋、石淋、湿热黄疸、疮痈肿痛、跌打损伤等症[2]。现有研究显示,连钱草的化学成分众多,主要包括有机酸类、黄酮类、萜类和挥发油类等,其中有机酸类成分含量以迷迭香酸最高,其次为咖啡酸、绿原酸[3]。上述3种有机酸类成分具有抗炎、抗病毒、治疗胆汁淤积等作用,为连钱草治疗肝炎、黄疸的主要成分[4-10]。目前关于迷迭香酸、咖啡酸、绿原酸的药理学研究较多,但同时测定三者血浆蛋白结合率的相关研究较少。血浆蛋白结合率是药物进入人体后,与血浆中白蛋白结合的药物量占全部药物总量的百分比,是药动学的重要参数之一。药物与血浆蛋白的结合将直接影响体内游离药物的浓度,从而影响药物的吸收、分布、代谢和消除,最终影响其药效学行为[11]。本研究拟采用超高效液相色谱(UHPLC)法结合超滤法测定连钱草中迷迭香酸、咖啡酸、绿原酸在新西兰兔体内的血浆蛋白结合率,为阐明该药材中有效成分的血浆蛋白结合特性提供参考。
1 材料
1.1 主要仪器
本研究所用主要仪器包括1290 InfinityTM型UHPLC仪及配备的二元高压梯度泵、柱温箱、自动进样器、二极管阵列检测器、ChemStation C.01.03工作站(美国Agilent公司),Milli-Q Direct16型超纯水仪(美国Millipore公司),Amicon Ultra-0.5 10K型超滤离心管(截留分子量10 000 Da,德国Merck公司),Micro 17型台式高速离心机(美国Thermo Fisher Scientific公司),Vortex WX型涡旋混合器(意大利VELP公司),Transferpette S型微量移液器(德国Brand公司),BP225D型电子天平[赛多利斯科学仪器(北京)有限公司],HH-6型数显恒温水浴锅[国华(常州)仪器制造有限公司]等。
1.2 主要药品与试剂
连钱草采自江西省九江市,经江西省药品检验检测研究院周国平主任中药师鉴定为唇形科植物活血丹G. longituba(Nakai)Kupr.的干燥地上部分;迷迭香酸对照品(批号111871-202007,纯度98.1%)、咖啡酸对照品(批号110885-200102,纯度>99.9%)、绿原酸对照品(批号110753-202018,纯度96.1%)均购自中国食品药品检定研究院;乙腈(色谱纯)购自美国Sigma-Aldrich公司;甲酸(色谱纯)购自美国TEDIA公司;其余试剂均为分析纯或实验室常用规格,水为超纯水。
1.3 实验动物
本研究所用动物为普通级新西兰兔,雌雄各半,体质量为2.5~3.0 kg,购自赣州市畜牧研究所,实验动物生产许可证号为SCXK(赣)2018-0009。本研究方案符合动物实验的相关伦理要求。
2 方法
2.1 血浆采集
取新西兰兔耳动脉血,置于肝素钠一次性采血管中,以1 000×g离心3 min,取上清液,即得血浆,于-18 ℃下冷冻,备用。
2.2 磷酸盐缓冲液的配制
分别称取氯化钠8.00 g、氯化钾0.20 g、磷酸氢二钠1.44 g、磷酸二氢钾0.24 g,置于1 000 mL量瓶中,加水溶解并稀释至刻度,摇匀,用0.5%氢氧化钠溶液调pH为7.4,即得磷酸盐缓冲液(PBS)。
2.3 混合对照品系列溶液和混合质控样品的配制
分别称取迷迭香酸、咖啡酸、绿原酸对照品各10.0 mg,加70%甲醇溶解并稀释,制成上述成分质量浓度均为1 mg/mL的混合对照品贮备液。精密吸取上述混合对照品贮备液适量,加入兔空白血浆超滤液稀释,制成质量浓度分别为1、3、10、25、50、100、200、300、400 μg/mL的混合对照品系列溶液。另精密吸取上述混合对照品贮备液适量,加入兔空白血浆稀释,制成质量浓度分别为1、3、50、300 μg/mL的混合质控样品。
2.4 供试品溶液的配制
取连钱草药材,粉碎,過四号筛,精密称取粉末1.0 g,置于具塞锥形瓶中,精密加入PBS 20 mL,超声(功率500 W,频率40 kHz)处理30 min,滤过,即得连钱草提取液(参考文献[12]采用高效液相色谱法测定,迷迭香酸、咖啡酸、绿原酸的质量浓度分别为261.3、155.3、72.5 μg/mL),作为高质量浓度的供试品溶液。精密吸取上述提取液3、4 mL,分别置于5 mL量瓶中,加PBS稀释至刻度,摇匀,分别作为低、中质量浓度的供试品溶液(低质量浓度的供试品溶液中迷迭香酸、咖啡酸、绿原酸的质量浓度分别为156.8、93.2、43.5 μg/mL,中质量浓度的供试品溶液中迷迭香酸、咖啡酸、绿原酸的质量浓度分别为209.0、124.2、58.0 μg/mL)。
2.5 色谱条件
以Phenomenex Luna? C18(150 mm×2 mm,3 μm)为色谱柱,以乙腈(A)-0.1%甲酸溶液(B)为流动相进行梯度洗脱(0~1.0 min,5%A;1.0~20.0 min,5%A→21%A);流速为0.5 mL/min;柱温为45 ℃;检测波长为327 nm;进样量为3 μL。
2.6 方法学考察
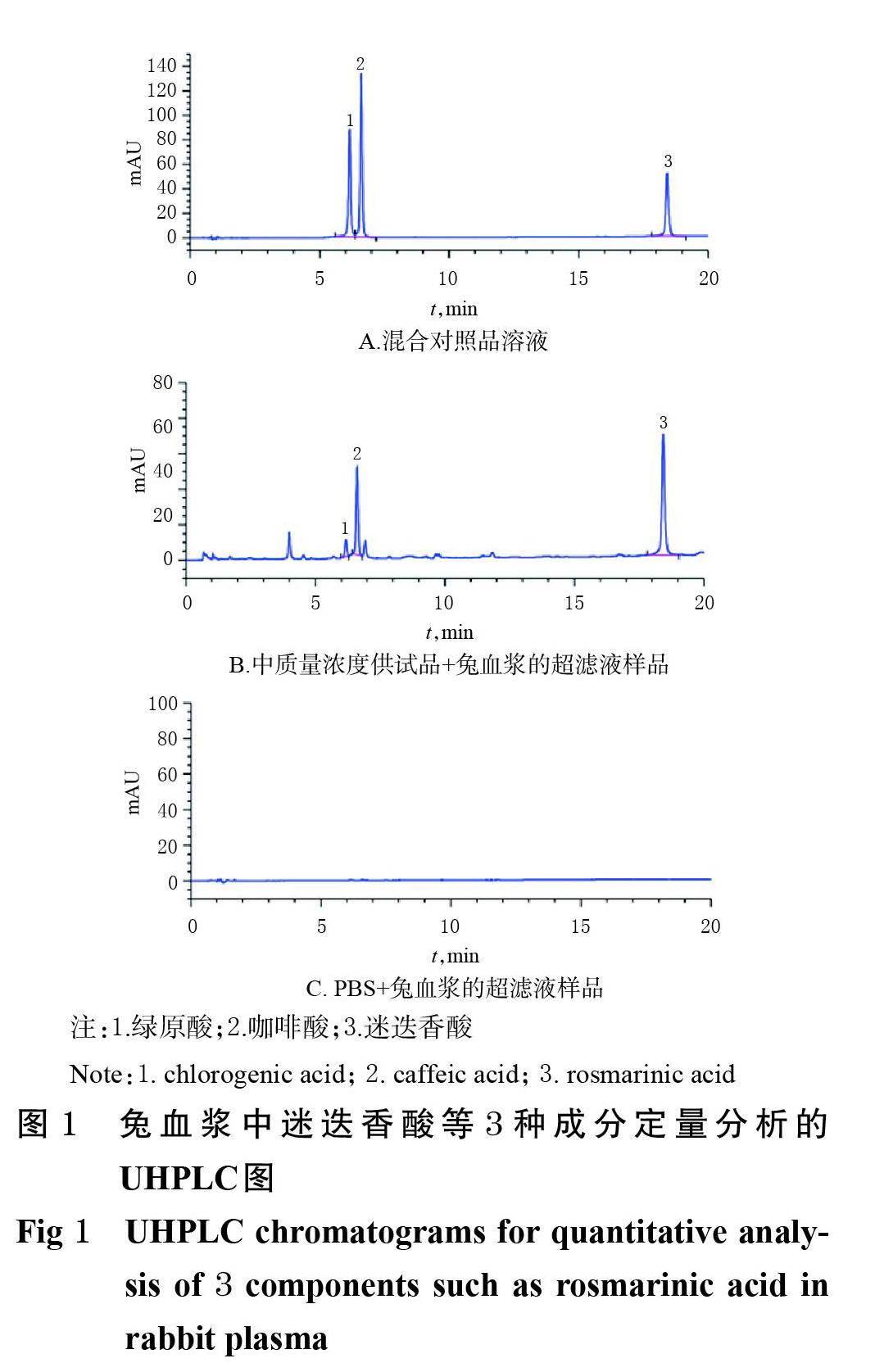
2.6.1 专属性试验 取混合对照品溶液(溶剂为70%甲醇,迷迭香酸、咖啡酸、绿原酸的质量浓度分别为185.0、224.2、156.0 μg/mL)、“2.7”项下中质量浓度供试品+兔血浆的超滤液样品、PBS+兔血浆的超滤液样品(即空白样品)各适量,按“2.5”项下色谱条件进样分析,记录色谱图。结果显示,迷迭香酸、咖啡酸、绿原酸色谱峰的分离度良好,内源性物质对测定无干扰,表明本方法专属性良好。兔血浆中迷迭香酸等3种成分定量分析的超高效液相色谱图见图1。
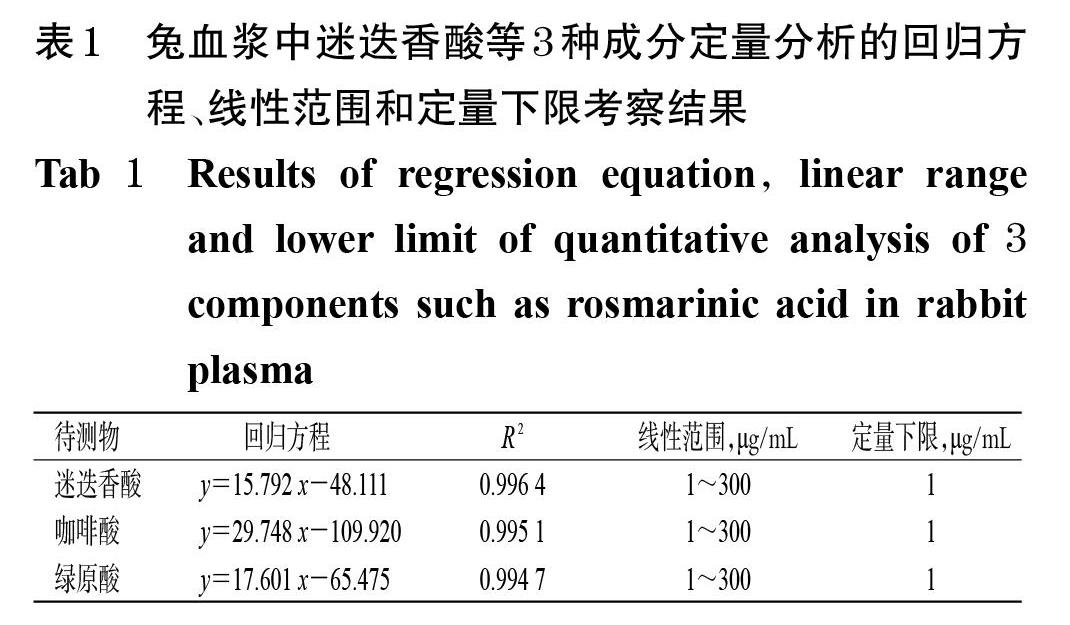
2.6.2 线性关系和定量下限考察 取“2.3”项下混合对照品系列溶液,于37 ℃水浴中孵育40 min,取孵育液0.5 mL转移至超滤离心管中,以14 000×g离心10 min,取超滤液按“2.5”项下色谱条件进样分析,记录峰面积。以待测物的质量浓度(x)为横坐标、峰面积(y)为纵坐标,分别拟合迷迭香酸、咖啡酸、绿原酸的回归方程,并以线性范围下限作为待测物的定量下限。兔血浆中迷迭香酸等3种成分定量分析的回归方程、线性范围和定量下限考察结果见表1。
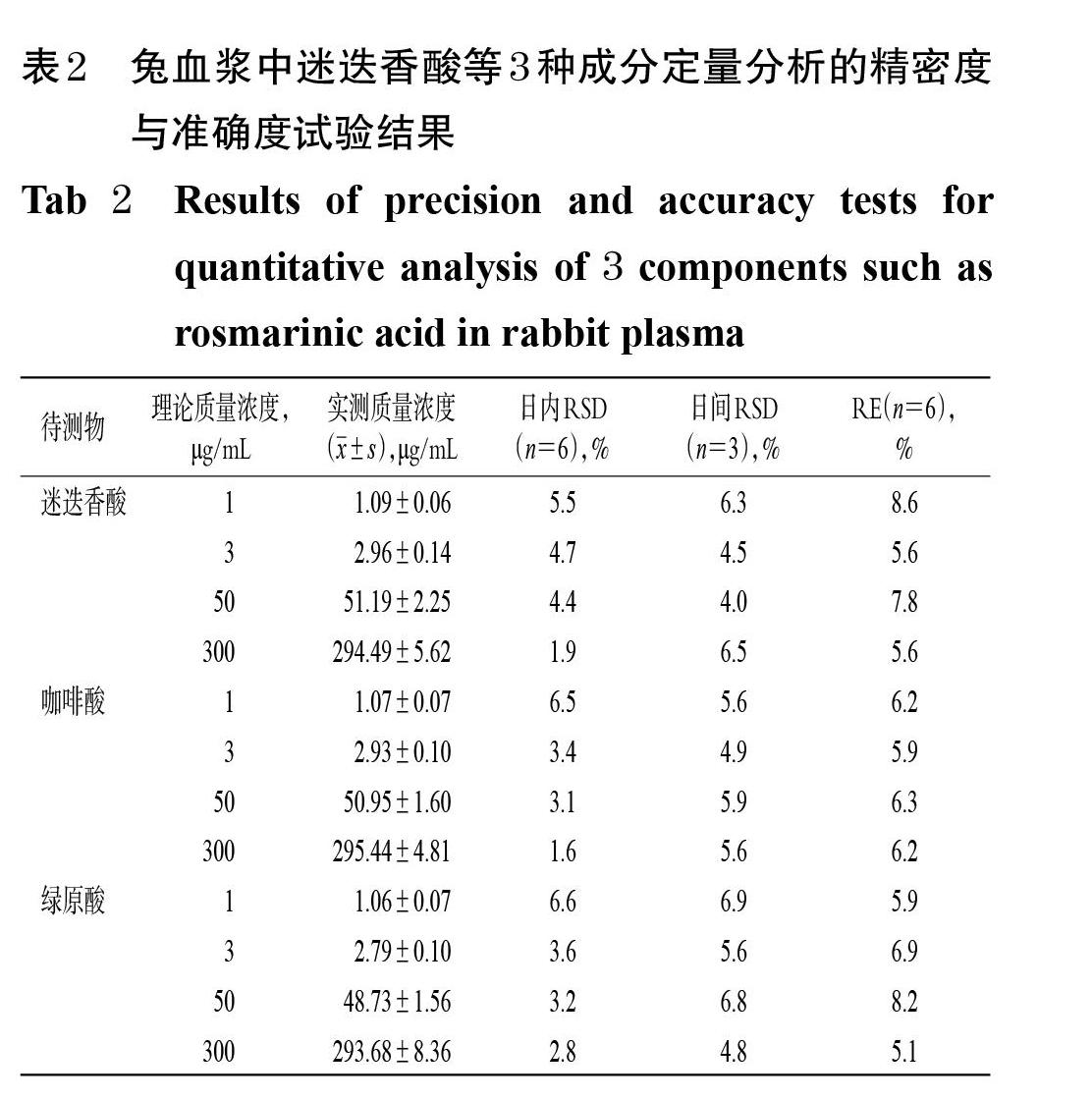
2.6.3 精密度与准确度试验 取“2.3”项下定量下限质量浓度(1 μg/mL)以及低、中、高质量浓度(3、50、300 μg/mL)的混合质控样品适量,于37 ℃水浴中孵育40 min,取孵育液0.5 mL转移至超滤离心管中,以14 000×g离心10 min,取超滤液按“2.5”项下色谱条件连续进样6次,考察日内精密度;连续测定3 d,考察日间精密度。以实测质量浓度与理论质量浓度的相对误差(RE)来考察准确度。兔血浆中迷迭香酸等3种成分定量分析的精密度与准确度试验结果见表2。
2.6.4 稳定性试验 取“2.3”项下低、中、高质量浓度(3、50、300 μg/mL)的混合质控样品各9份,于37 ℃水浴中孵育40 min,取孵育液0.5 mL转移至超滤离心管中,以14 000×g离心10 min,取超滤液,分别置于4 ℃下冷藏24 h、室温下放置12 h、反复冻融(-20~25 ℃)3次后,按“2.5”项下色谱条件进样分析,考察稳定性。结果显示,上述条件下迷迭香酸、咖啡酸、绿原酸峰面积的RSD均小于10%,表明各混合质控样品在上述条件下的稳定性良好。
2.7 血浆蛋白结合率的测定
精密吸取“2.4”项下低、中、高质量浓度的供试品溶液各200 μL,分别置于2 mL离心管中,加入兔血浆300 μL,涡旋30 s使混合均匀,于37 ℃水浴中孵育40 min,取孵育液0.5 mL转移至超滤离心管中,以14 000×g离心10 min,取超滤液按“2.5”项下色谱条件进样分析,记录峰面积,代入随行回归方程计算超滤液中迷迭香酸、咖啡酸、绿原酸的质量浓度,并根据下列公式计算血浆蛋白结合率:血浆蛋白结合率(%)=(供试品溶液中待测物的质量浓度-超滤液中待测物的质量浓度)/供试品溶液中待测物的质量浓度×100%。每个质量浓度平行操作3份。连钱草中迷迭香酸等3种成分的兔血浆蛋白结合率测定结果见表3。
3 讨论
迷迭香酸、咖啡酸、绿原酸均为酚酸类化合物,其最大吸收波长分别为329、323、327 nm[13-15]。三者最大吸收波长相近,经本课题组前期研究证实,无论选择上述任意波长对3种成分检测的灵敏度影响均不大,因绿原酸的最大吸收波长在三者中间,因此选择327 nm作为本研究的检测波长。
本课题组前期比较了等度洗脱和梯度洗脱对迷迭香酸、咖啡酸、绿原酸色谱峰的影响,结果显示,梯度洗脱在分离效果和分析时间方面均优于等度洗脱,故选择梯度洗脱。此外,本研究采用UHPLC仪,其洗脱梯度变化不宜过快、分析时间不宜过短,因为洗脱梯度变化过快或分析时间过短可使咖啡酸的色谱峰与其他杂质色谱峰重合,大大影响定量分析的准确性。
本课题组前期比较了不同柱温(25、35、45 ℃)对迷迭香酸、咖啡酸、绿原酸色谱峰分离的影响,结果显示,柱温对三者色谱峰分离度的影响并不显著,但当柱温为45 ℃时,三者的分析时间明显缩短且柱压更低,因此选择45 ℃作为定量分析的柱温。
本研究采用德国Merck公司Amicon Ultra-0.5 10K型超滤离心管,其能在高速离心的状态下于较短的时间(10~30 min)内截留分子量大于10 000 Da且与血浆蛋白结合的化学成分,而小分子化学成分则可通过超滤膜,从而实现样品的快速前处理。常用的平衡透析半透膜法则需要12~48 h才能完成小分子成分与大分子成分的分离,同时还存在操作复杂、消耗样品量大、不稳定成分易变质等不足[16]。与平衡透析半透膜法比较,超滤法分析时间短、操作简单,因此本研究选择超滤法作为血浆样品处理方法。
血浆蛋白结合率测定结果显示,连钱草中迷迭香酸、咖啡酸的血漿蛋白结合率较高(>80%),推测连钱草与其他药物联用时,可能通过竞争性结合血浆蛋白,抑制其他药物与血浆蛋白的结合,使其他药物在血液中的浓度升高。
综上所述,本研究所建方法操作简单、分析时间较短,可用于测定连钱草中迷迭香酸、咖啡酸、绿原酸的血浆蛋白结合率。
参考文献
[ 1 ] 中国科学院中国植物志编辑委员会.中国植物志:第65卷:第2册[M].北京:科学出版社,1977:316.
[ 2 ] 国家药典委员会.中华人民共和国药典:一部[S]. 2020年版.北京:中国医药科技出版社,2020:177.
[ 3 ] 吴西,周雷罡,邓维,等.连钱草化学成分及药理作用研究进展[J].药品评价,2021,18(1):4-7.
[ 4 ] VILLALVA M,JAIME L,AGUADO E,et al. Anti-inflammatory and antioxidant activities from the basolateral fraction of caco-2 cells exposed to a rosmarinic acid enriched extract[J]. J Agric Food Chem,2018,66(5):1167-1174.
[ 5 ] BISHT A,DICKENS M,RUTHERFURD-MARKWICK K,et al. Chlorogenic acid potentiates the anti-inflammatory activity of curcumin in LPS-stimulated THP-1 cells[J]. Nutrients,2020,12(9):2706.
[ 6 ] PACIELLO F,DI PINO A,ROLESI R,et al. Anti-oxidant and anti-inflammatory effects of caffeic acid:in vivo evidences in a model of noise-induced hearing loss[J]. Food Chem Toxicol,2020,143:111555.
[ 7 ] SWARUP V,GHOSH J,GHOSH S,et al. Antiviral and anti-inflammatory effects of rosmarinic acid in an experimental murine model of Japanese encephalitis[J]. Antimicrob Agents Chemother,2007,51(9):3367-3370.
[ 8 ] ABAIDULLAH M,PENG S,SONG X,et al. Chlorogenic acid is a positive regulator of MDA5,TLR7 and NF-kappaB signaling pathways mediated antiviral responses against Gammacoronavirus infection[J]. Int Immunopharmacol,2021,96:107671.
[ 9 ] LIN S Y,WANG Y Y,CHEN W Y,et al. Hepatoprotective activities of rosmarinic acid against extrahepatic cholestasis in rats[J]. Food Chem Toxicol,2017,108(Pt A):214-223.
[10] ZHU L,WANG L,CAO F,et al. Modulation of transport and metabolism of bile acids and bilirubin by chlorogenic acid against hepatotoxicity and cholestasis in bile duct ligation rats:involvement of SIRT1-mediated deacetylation of FXR and PGC-1α[J]. J Hepatobiliary Pancreat Sci,2018,25(3):195-205.
[11] 关瑾,丁爽,刘芷含,等.药物-血浆蛋白结合率测定方法的研究进展[J].中国新药杂志,2014,23(10):1149-1153.
[12] 邓渝,陈友生,王茜,等. HPLC法同时测定连钱草中4个酚酸类成分的含量[J].药物分析杂志,2018,38(4):643- 647.
[13] 張福君,张冬璇. UPLC法同时测定冠心丹参胶囊中紫草酸和迷迭香酸的含量[J].中国药房,2016,27(18):2560- 2562.
[14] 阮治纲,林君. HPLC法测定蒲地蓝消炎口服液中咖啡酸的含量[J].中国药师,2010,13(9):1356-1357.
[15] 陈言. HPLC法测定不同产地金银花中绿原酸和木犀草苷的含量[J].北方药学,2019,16(2):3-4.
[16] 刘睿,谢跃生,潘桂湘,等.药物血浆蛋白结合率测定方法的研究进展[J].天津中医药,2007,24(6):526-528.
(收稿日期:2021-07-10 修回日期:2021-10-22)
(编辑:邹丽娟)

