车前子多糖对乳腺癌细胞增殖、迁移和侵袭的影响及其机制
陈高 杨晓婷 王曦 金湛 朱瑞 甘椿椿 周道堂 姚水洪

摘 要 目的:研究車前子多糖对乳腺癌细胞增殖、迁移和侵袭的影响,并初步探究其作用机制。方法:以人乳腺癌细胞MDA-MB-231为对象,采用MTT法检测不同质量浓度车前子多糖(8、16、32、64 mg/L)对细胞增殖能力的影响并计算细胞存活率;采用划痕实验、Transwell侵袭实验分别检测不同质量浓度车前子多糖(8、16 mg/L)对细胞迁移和侵袭能力的影响;采用Western blot法检测转移及上皮间质转化(EMT)相关蛋白[基质金属蛋白酶2(MMP-2)、MMP-9、上皮黏钙素(E-cadherin)、神经黏钙素(N-cadherin)、波形蛋白(vimentin)]的表达情况。结果:MTT实验结果显示,车前子多糖32、64 mg/L组细胞的存活率均较对照组显著降低(P<0.05或P<0.01),故以不影响细胞存活率的8、16 mg/L作为后续实验给药浓度。与对照组比较,车前子多糖8、16 mg/L组细胞的相对迁移率(12、24 h)、相对侵袭率以及MMP-2、MMP-9、N-cadherin、vimentin蛋白的相对表达量均显著降低(P<0.05或P<0.01),E-cadherin蛋白的相对表达量均显著升高(P<0.05或P<0.01)。结论:车前子多糖能够在体外抑制乳腺癌细胞MDA-MB-231的增殖,并可能通过抑制转移及EMT相关蛋白的表达来抑制该细胞的迁移和侵袭。
关键词 车前子多糖;乳腺癌;MDA-MB-231细胞;增殖;迁移;侵袭
ABSTRACT OBJECTIVE: To study the effects of Plantago asiatica polysaccharide on the proliferation, migration and invasion of breast cancer cells, and to investigate its mechanism preliminarily. METHODS: Using human breast cancer cell MDA-MB-231 as subjects, MTT method was adopted to detect the effects of different concentrations of P. asiatica polysaccharide (8, 16, 32, 64 mg/L) on the cell proliferation ability, and survival rate of the cells was calculated. Scratch test and Transwell invasion test were used to detect the effects of different concentrations of P. asiatica polysaccharide (8, 16 mg/L) on cell migration ability and invasion ability. Western blot assay was used to detect the expression of epithelial-mesenchymal transition (EMT)-related proteins
[matrix metalloproteinase-2 (MMP-2), MMP-9, E-cadherin, N-cadherin, vimentin]. RESULTS: Results of MTT assay showed that survival rate of the cells in 32, 64 mg/L P. asiatica polysaccharide groups were significantly lower than control group (P<0.05 or P<0.01), so that 8, 16 mg/L, which did not affect the cell survival rate, were used as the follow-up drug concentrations. Compared with control group, relative mobility (12, 24 h), relative invasion rate and relative expression of MMP-2, MMP-9, N-cadherin and vimentin protein were decreased significantly in 8, 16 mg/L P. asiatica polysaccharide groups (P<0.05 or P<0.01), while relative expression of E-cadherin protein was increased significantly (P<0.05 or P<0.01). CONCLUSIONS: P. asiatica polysaccharide can inhibit the proliferation of breast cancer cells MDA-MB-231, and inhibit the migration and invasion of the cells by regulating the expression of metastasis and EMT-related proteins.
KEYWORDS Plantago asiatica polysaccharide; Breast cancer; MDA-MB-231 cells; Proliferation; Migration; Invasion
近年来,乳腺癌的发病率已居女性恶性肿瘤之首,其患者数量已占各种恶性肿瘤患者总数的7%~10%,已成为影响女性健康的主要原因之一,也是引起女性死亡的重要病因[1]。研究证实,乳腺癌患者死亡的关键因素与乳腺癌细胞迁移和侵袭有关,故筛选能够有效抑制肿瘤细胞迁移和侵袭的抗肿瘤药物成为相关研究的热点之一[2]。车前子Plantaginis Semen是车前属植物车前Plantago asiatica L.或平车前Plantago depressa Willd.的干燥成熟种子,始见于《神农本草经》,其性微寒,味淡、甘,具有渗湿止泻、明目、祛痰等功效[3]。多糖为车前子的主要有效部位,目前国内外有关车前子多糖的研究主要集中于其调节血糖、血脂和润肠通便等作用方面[4-6],而关于其在抗肿瘤方面的研究报道较为少见。研究表明,车前子多糖在H22肝癌移植瘤小鼠体内表现出一定的抗肿瘤活性[7],但有关其对乳腺癌细胞的影响尚缺乏系统研究。鉴于此,本研究拟以车前子多糖为干预物,分析其对人乳腺癌细胞MDA-MB-231增殖、迁移和侵袭的影响,并初步探究其作用机制,以期为车前子多糖抗肿瘤作用的阐释以及乳腺癌的临床治疗提供参考。
1 材料
1.1 主要仪器
本研究所用主要仪器包括3111型CO2培养箱(美国Thermo Fisher Scientific公司)、PowerPac Basic型电泳仪(美国Bio-Rad公司)、3300 Mini型化学发光成像系统(上海勤翔科学仪器有限公司)、BG-XM496型酶标仪(厦门百谷生物工程有限公司)、XJL-101型正置显微镜(上海皆准仪器设备有限公司)、X715 XK-8型转移脱色摇床(江苏新康医疗器械有限公司)、SW-CJ-2FD型超净工作台(苏州净化设备有限公司)、BSA124S-CW型电子天平和MDF-U3386S型超低温冰箱(上海巴玖實业有限公司)等。
1.2 主要药品与试剂
车前子药材(批号Y1805060)购自衢州南孔中药有限公司,经衢州职业技术学院医学院魏自太副教授鉴定为车前科植物车前P. asiatica L.的干燥成熟种子。
DMEM/F12培养基(批号04541,两者体积比1 ∶ 1)、胎牛血清(批号M2128)均购自美国Hyclone公司;青霉素-链霉素双抗(批号20190103)购自美国Gibco公司;RIPA裂解液(批号P0013C)、BCA蛋白浓度测定试剂盒(批号P0024)、胰酶(批号C0201)均购自上海碧云天生物技术有限公司;MTT试剂(批号M2128)、二甲基亚砜(DMSO,批号M3321)均购自美国Sigma公司;苏木精-伊红(HE)试剂盒(批号20181212)、Matrigel胶(批号20181101)均购自北京索莱宝科技有限公司;兔源基质金属蛋白酶2(MMP-2)多克隆抗体(批号#87809)、兔源MMP-9多克隆抗体(批号#13667)、兔源上皮钙黏附蛋白(E-cadherin)单克隆抗体(批号#3195)、兔源神经钙黏附蛋白(N-cadherin)多克隆抗体(批号#13116)、兔源波形蛋白(vimentin)多克隆抗体(批号#5741)、甘油醛-3-磷酸脱氢酶(GAPDH)多克隆抗体(批号#5174)、辣根过氧化物酶标记的山羊抗兔IgG二抗(批号#7074)均购自美国CST公司;ECL显影液(批号102030719)购自美国Bio-Rad公司;其余试剂均为分析纯或实验室常用规格,水为纯化水。
1.3 细胞
人乳腺癌细胞MDA-MB-231购自中国科学院上海生命科学研究院细胞资源中心。
2 方法
2.1 车前子多糖及其药液的制备
取车前子药材25 g,加入35倍量(mL/g)的水,沸水浴中回流提取6 h,滤过,浓缩至原体积的1/2;加入95%乙醇(使乙醇体积分数达60%),醇沉6 h,滤过;将沉淀烘干即得车前子多糖,得率为6.58%(即100 g生药可提取得6.58 g多糖)。临用前,将车前子多糖用pH 7.2的磷酸盐缓冲液(PBS)混悬,制得质量浓度约1 000 mg/L(以多糖提取物质量计)的药液,备用。
2.2 细胞的培养
将MDA-MB-231细胞接种于含胎牛血清(10%)、青霉素(200 U/mL)、链霉素(200 U/mL)的DMEM/F12培养基(以下简称“完全培养基”)中,于37 ℃、5%CO2培养箱中培养(培养条件下同)。每间隔2天换液1次,待80%~90%细胞融合之后,以胰酶(0.25%)消化并传代,继续培养,取对数期细胞用于后续实验。
2.3 细胞存活率的检测
采用MTT法进行检测。收集“2.2”项下对数期细胞适量,经胰酶消化、吹打,以1 500 r/min离心5 min,弃去上清液;细胞用完全培养基重悬并调整密度至2×104 mL-1,按800个/孔接种并培养于96孔板中。待细胞贴壁后,将其随机分为对照组和车前子多糖不同质量浓度组(8、16、32、64 mg/L,以多糖提取物质量计,下同;剂量参考文献[7]设置),同时设置不含药物、不含细胞的空白培养基组,每组设4个复孔。其中,对照组加入完全培养基,药物组加入含相应质量浓度车前子多糖的完全培养基。细胞培养48 h后,弃去培养基,每孔加入5 mg/L的MTT试剂20 μL;继续培养4 h后,吸弃上清液,每孔加入DMSO 100 μL,振摇10 min。使用酶标仪于570 nm波长处检测各孔的光密度(OD)并计算细胞存活率:细胞存活率(%)=(待测组细胞OD570 nm-空白培养基组OD570 nm)/(对照组OD570 nm-空白培养基组OD570 nm)×100%。上述实验重复3次。
2.4 细胞迁移能力的检测
采用细胞划痕实验进行检测。收集“2.2”项下对数期细胞适量,经胰酶消化、吹打,以1 500 r/min离心5 min,弃去上清液;细胞用完全培养基重悬并调整密度至2×105 mL-1,按6×105个/孔接种并培养于6孔板中。待细胞长成单层之后,用200 μL枪头在每孔底部中央作一划痕,用PBS清洗后,将细胞随机分为对照组和车前子多糖不同质量浓度组(8、16 mg/L;剂量参考“2.3”项下结果设置,下同),每组设置3个复孔。其中,对照组加入完全培养基,药物组加入含相应质量浓度车前子多糖的完全培养基。分别于细胞培养0、12、24 h时使用正置显微镜观察并拍照,使用Image J 1.52V软件分析并计算相对迁移率:相对迁移率=(待测组细胞不同培养时间较0 h时的迁移距离/对照组细胞不同培养时间较0 h时的迁移距离)×100%。上述实验重复3次。
2.5 细胞侵袭能力的检测
采用Transwell侵袭实验进行检测。收集“2.2”项下对数期细胞适量,经胰酶消化、吹打,以1 500 r/min离心5 min,弃去上清液;细胞用完全培养基重悬并调整密度至2×104 mL-1,接种200 μL于Transwell小室上层,下层加入含青霉素(200 U/mL)、链霉素(200 U/mL)、不含血清的DMEM/F12培养基500 μL。将细胞随机分为对照组和车前子多糖不同质量浓度组(8、16 mg/L),每组平行3份。细胞培养24 h后,取出小室,弃去上层液体,用甲醇固定5 min;细胞以PBS清洗3次,依次用苏木精和伊红试剂各染色5 min。用水洗去残留的染料,再用棉签擦去未穿过Matrigel胶和聚碳脂膜的细胞后,使用正置显微镜观察并随机选取5个视野拍照,记录染色阳性细胞数(即发生侵袭细胞的数量)并计算相对侵袭率:相对侵袭率=(待测组侵袭细胞数/对照组侵袭细胞数)×100%。上述实验重复3次。
2.6 细胞中转移及上皮间质转化(EMT)相关蛋白表达水平的检测
采用Western blot法进行检测。收集“2.2”项下对数期细胞适量,经胰酶消化、吹打,以1 500 r/min离心5 min,弃去上清液;细胞用完全培养基重悬并调整密度至3×105 mL-1,按6×105个/孔接种并培养于6孔板中。待细胞贴壁后,将其随机分为对照组和车前子多糖不同质量浓度组(8、16 mg/L),每组设3个复孔。其中,对照组加入完全培养基,药物组加入含相应质量浓度车前子多糖的完全培养基。细胞培养48 h后,弃去培养基,用RIPA裂解液裂解后,于4 ℃下以8 000 r/min离心3 min,收集上清液,采用BCA法测定蛋白的浓度。取上述蛋白样品,于100 ℃下加热8 min使变性;取变性蛋白适量,经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳分离后转膜,以5%脱脂奶粉室温封闭30 min;加入MMP-2、MMP-9、E-cadherin、N-cadherin、vimentin、GAPDH一抗(稀释比例均为1 ∶ 1 000),4 ℃下孵育过夜;用TBST溶液清洗3次,加入相应二抗(稀释比例为1 ∶ 3 000),室温下孵育2 h;用TBST溶液清洗3次,经ECL显色后,使用化学发光荧光成像系统成像。采用Image J 1.52V软件进行分析,以目标条带与内参GAPDH蛋白条带灰度值的比值表示目标蛋白的相对表达量,并以各组蛋白相对表达量与对照组蛋白相对表达量的比值作为最终结果。上述实验重复3次。
2.7 统计学方法
采用SPSS 22.0软件对数据进行统计分析。所有数据均以x±s表示,多组间比较采用单因素方差分析,组间两两比较采用LSD检验。检验水准α=0.05。
3 结果
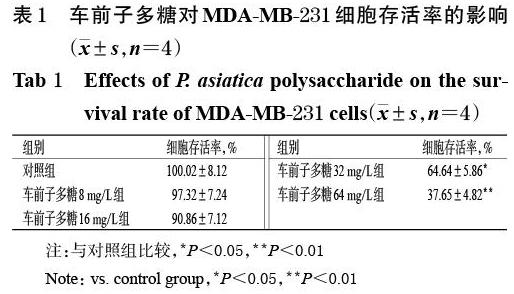
3.1 车前子多糖对MDA-MB-231细胞存活率的影响
与对照组比较,车前子多糖32、64 mg/L组细胞的存活率均显著降低(P<0.05或P<0.01);而车前子多糖8、16 mg/L组细胞的存活率与对照组比较,差异均无统计学意义(P>0.05),详见表1。鉴于此,本研究将8、16 mg/L作为后续研究的给药浓度。
注:与对照组比较,*P<0.05,**P<0.01
Note: vs. control group,*P<0.05,**P<0.01
3.2 车前子多糖对MDA-MB-231细胞迁移能力的影响
培养12 h时,8、16 mg/L的车前子多糖使细胞相对迁移率分别降至约20%和9%;培养24 h时,8、16 mg/L的车前子多糖使细胞的相对迁移率分别降至约24%和5%。在上述各时间点,各药物组细胞的相对迁移率均显著低于对照组(P<0.01),且有随药物质量浓度增加而降低的趋势,详见图1、表2。
3.3 车前子多糖对MDA-MB-231细胞侵袭能力的影响
与对照组比较,各药物组的侵袭细胞数明显减少,其相对侵袭率均显著降低(P<0.05或P<0.01),且有随药物质量浓度增加而降低的趋势,详见图2、表2。
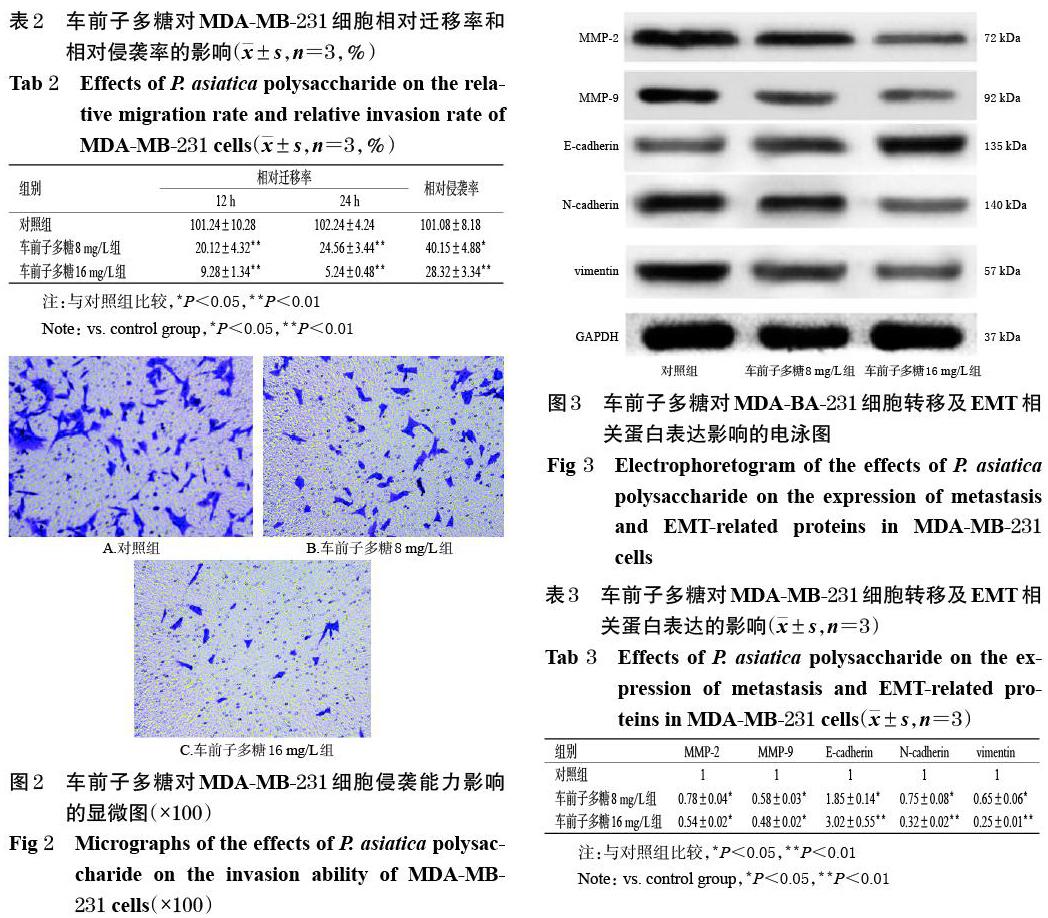
3.4 车前子多糖对MDA-MB-231细胞转移及EMT相关蛋白表达的影响
与对照组比较,各药物组细胞中MMP-2、MMP-9、N-cadherin、vimentin蛋白的相对表达量均显著降低(P<0.05或P<0.01),E-cadherin蛋白的相对表达量均显著升高(P<0.05或P<0.01),且均有随药物质量浓度增加而降低或升高的趋势,详见图3、表3。
4 讨论
现阶段乳腺癌的治疗方式主要以化疗为主,但是常规的化疗药物对乳腺癌细胞和正常细胞的选择性不佳,并容易对心脏、肾脏等重要组织器官产生器质性损伤,故有必要进一步挖掘有效的治疗药物[8]。车前子的主要有效成分为车前子多糖,该多糖是其种皮外表细胞壁含有的黏液质(为一种亲水性胶体)[9]。多糖在动植物和微生物细胞中分布甚广,其药理活性相关研究的进展迅速,已初步证实其具有包括抗病毒、抗凝血、抗氧化等在内的多种生物活性[10-12]。本研究从车前子中提取车前子多糖,考察其对人乳腺癌细胞MDA-MB-231增殖、迁移和侵袭能力的影响。首先,通过MTT实验发现,较高质量浓度(32、64 mg/L)的车前子多糖对该细胞增殖具有明显的抑制作用。根据细胞增殖实验结果,本研究选择了对细胞无显著抑制作用的8、16 mg/L作为后续实验的给药浓度,進一步通过划痕实验和Transwell侵袭实验探讨了车前子多糖对细胞迁移和侵袭能力的影响。结果显示,不同质量浓度的车前子多糖均能显著抑制细胞的增殖和迁移,且有浓度依赖趋势。
转移是恶性乳腺癌最重要的生物学特征,是肿瘤转移的必需步骤,同时也是近年来肿瘤患者病死率较高的主要原因之一[13-14]。因此,肿瘤的转移机制成为近年来相关领域的研究热点之一。有研究指出,肿瘤细胞侵袭、转移的关键因素是细胞外基质(EMC)以及基底膜的降解,而其中发挥关键作用的则是MMP家族[15]。据报道,乳腺癌细胞中MMP-2、MMP-9蛋白的表达量显著高于癌旁正常组织,同时这两种MMP的高表达与乳腺癌细胞转移密切相关[16]。MMP-2和MMP-9具有促进基底膜和EMC分解的作用,有利于乳腺癌细胞的迁移和侵袭。有研究表明,多种中药提取物具有抑制肿瘤细胞转移的作用,例如海参提取物能够抑制前列腺癌细胞转移,山茱萸提取物能够抑制乳腺癌细胞转移,且部分提取物的这种作用是通过抑制MMP-2和MMP-9的表达来实现的[17-19]。EMT是乳腺癌细胞转移的重要机制,可促进恶性肿瘤细胞的侵袭、转移及耐药,其主要特征为上皮细胞的极性丧失,进而导致细胞间的黏附性减弱,使细胞最终表现出间质细胞的形态和特性[16,20]。EMT发生的标志性事件是上皮细胞特征的丧失,如间充质标志蛋白vimentin、N-cadherin的表达上调,以及E-cadherin和其他细胞黏附分子的表达下调[21]。本研究结果显示,不同质量浓度的车前子多糖均能显著下调转移相关蛋白MMP-2、MMP-9的表达,下调EMT相关蛋白N-cadherin、vimentin的表达,同时上调E-cadherin的表达,且有浓度依赖趋势。这表明车前子多糖能够抑制MDA-MB-231细胞间极性的丧失,阻止其向间质细胞形态发展,即阻止其EMT的发生。
综上所述,车前子多糖能够在体外抑制人乳腺癌细胞MDA-MB-231的增殖,并可能通过抑制转移及EMT相关蛋白的表达来抑制其迁移和侵袭。但有关车前子多糖在抗乳腺癌方面的其他相关机制以及对其他肿瘤细胞的影响,尚有待进一步的探讨。
参考文献
[ 1 ] SIEGEL R,MILLER K D,JEMAL A. Cancer statistics 2016 CA[J]. CA Cancer J Clin,2016,66(1):7-30.
[ 2 ] 罗娇,周莉.外泌体在乳腺癌脑转移诊断和治疗中的研究进展[J].肿瘤,2020,40(5):361-370.
[ 3 ] 国家药典委员会.中华人民共和国药典:一部[S]. 2015年版.北京:中国医药科技出版社,2015:68-69.
[ 4 ] 王东,袁昌鲁,林力,等.车前子多糖对小肠运动障碍小鼠的影响[J].中华中医药学刊,2008,26(6):1188-1189.
[ 5 ] 李冲冲,龚苏晓,许浚,等.车前子化学成分与药理作用研究进展及质量标志物预测分析[J].中草药,2018,49(6):1233-1246.
[ 6 ] 冯亚龙.车前子拮抗芳烃受体介导的肾纤维化物质基础及作用机制研究[D].西安:西北大学,2019.
[ 7 ] 冯娜,王素敏.车前子多糖抗肿瘤作用的实验研究[J].天津药学,2018,30(6):1-4.
[ 8 ] 林嘉燕,张建国.乳腺癌新辅助化疗疗效的评估方法及其进展[J].东南大学学报(医学版),2019,38(4):727-731.
[ 9 ] 谢明,杨爽爽,王亮亮,等.中药车前子的研究进展[J].黑龙江医药,2015,28(3):474-476.
[10] 贾伟,毛淑敏,张盼盼,等.金银花多糖体内抗病毒作用研究[J].辽宁中医药大学学报,2018,20(6):25-27.
[11] 李德海,顾佳林,孙常雁,等.提取技术对酸性黑木耳多糖抗凝血活性的影响[J].华南理工大学学报(自然科学版),2018,46(6):93-102.
[12] 王储炎,程俊文,祝超.黑芝菌发酵产生胞外多糖的工艺优化及其抗氧化活性[J].浙江农业学报,2018,30(11):1938-1945.
[13] 崔一鸣,周斌,李斐斐,等.益肺清化颗粒对人肺癌PG细胞增殖、迁移与侵袭能力的影响[J].中华中医药杂志,2014,29(11):3592-3595.
[14] 宋方方,张玲,陈可欣.迁移侵袭抑制蛋白对肿瘤细胞侵袭转移的调节[J].中华劳动卫生职业病杂志,2013,31 (12) :944-947.
[15] 张小博,李艳会,李开良,等. VEGF、MMP-2、MMP-9在胰腺癌中的表达及临床意义[J].中国老年学杂志,2014,34(2):327-329.
[16] LI H,QIU Z,LI F,WANG C,et al. The relationship between MMP-2 and MMP-9 expression levels with breast cancer incidence and prognosis[J]. Oncol Lett,2017,14(5):5865-5870.
[17] 袁磊,周凯,苏畅,等.海参提取物TBL-12抑制激素非依赖性前列腺癌细胞的增殖和转移[J].热带医学杂志,2019,19(3):261-265,后插4.
[18] 谢静静,张金花,金剑英,等.山茱萸提取物对乳腺癌细胞MDA-MB-231侵袭和转移的抑制作用及机制研究[J].浙江中西医结合杂志,2020,30(5):369-374,后插3-后插4.
[19] IM I,PARK K R,KIN S M,et al. The butanol fraction of guava (Psidium cattleianum Sabine) leaf extract suppres- ses MMP-2 and MMP-9 expression and activity through the suppression of the ERK1/2 MAPK signaling pathway[J]. Nutri Cancer,2012,64(2):255-266.
[20] KURIOKA K,WATO M,ISEKI T,et al. Differential expression of the epithelial mesenchymal transition factors Snail,Slug,Twist,TGF-β,and E-cadherin in ameloblastoma[J]. Med Mol Morphol,2017,50(2):68-75.
[21] CHAFFER C L,SAN JUAN B P,LIM E,et al. EMT,cell plasticity and metastasis[J]. Cancer Metastasis Rev,2016,35(4):645-654.
(收稿日期:2020-08-31 修回日期:2021-05-13)
(編辑:张元媛)

