芒柄花黄素对喉癌TU686细胞生长、增殖和凋亡的影响
刁玉佩,李 萍,郭明坤,王 乐
喉具有发声、吞咽、呼吸等关键作用,喉部发生病变将会给患者带来严重的生理障碍及心理负担。因此,喉癌被称为高度精神创伤性癌症[1]。其发病率呈逐年上升的趋势,虽然目前的治疗手段在一定程度上能延长患者生存期,但存在副作用明显、预后效果差、5年生存率低、患者生活质量低等问题[2]。因此,在提高患者生存率的前提下,寻找安全有效的喉癌治疗方法具有重要意义。芒柄花黄素(formononetin, FMN),别名刺芒柄花素,是一种天然异黄酮,在保肝[3-4]、降糖[5]、抗炎[6]、抗肿瘤[7-8]等方面具有重要作用。FMN对多种癌细胞具有显著的抑制作用,本文应用体外实验检测FMN对喉癌细胞的影响,探讨其对肿瘤细胞的抑制作用及诱导细胞凋亡的可能机制,为喉癌的临床治疗提供新线索。
1 材料与方法
1.1 细胞人喉癌TU686细胞(贴壁生长)购自中国科学院上海细胞研究所,采用含有10%胎牛血清(FBS)和1%青霉素-链霉素的RPMI 1640培养基在37 ℃ 5%CO2条件下培养。
1.2 主要试剂FMN(上海佳和生物公司);RPMI 1640、10%胎牛血清、青霉素-链霉素双抗(美国Gibco公司);PBS缓冲液、0.25%胰蛋白酶、0.1%结晶紫水溶液、4%多聚甲醛(上海阿拉丁生化公司);超氧化物歧化酶(superoxide dismutase, SOD)测定试剂盒、丙二醛(malondialdehyde, MDA)测定试剂盒(南京建成生物工程研究所);线粒体膜电位荧光探针JC-1(美国AAT Bioquest公司);二喹啉甲酸(BCA)蛋白定量检测试剂盒、细胞计数(CCK-8)试剂盒、RIPA裂解液及实验中相关抗体(武汉赛维尔生物公司)。
1.3 主要仪器Navios流式细胞分析仪(美国Beckman Coulter公司);ECO1.8超净工作台、CO2培养箱,T25培养瓶(美国Thermo Scientific公司);D3024R低温高速离心机(大龙兴创实验仪器公司);EPS300电泳仪、VE180微型垂直电泳、VE186转移垂直电泳槽(上海天能科技公司)。
1.4 方法
1.4.1细胞培养 提前将完全培养基(RPMI 1640+10%FBS+1%青霉素-链霉素)置于37 ℃水浴中预热;当取出冷冻保存的人喉癌TU686细胞株后,经37 ℃水浴快速融化,转移至已加入完全培养基的离心管中,1 000 r/min离心5 min后弃上清,用完全培养基重悬,吹打混匀后移至T25培养瓶,置于37 ℃ 5%CO2细胞培养箱中培养,每3天更换1次培养基。待细胞铺满瓶底超过80%,可用0.25%胰蛋白酶消化传代。取对数生长期细胞用于后续实验。
1.4.2CCK-8法检测细胞活力 取对数生长期的喉癌TU686细胞,经消化、离心、重悬后,将细胞稀释至每毫升5×104个,每孔100 μL接种于96孔板,即控制每孔5 000个细胞,设置3个复孔,置培养箱培养24 h(37 ℃ 5%CO2)。每孔加入10 μL不同浓度的FMN(浓度分别为0、1.25、2.5、5、10、20、40、80、160 μmol/L)培养24 h后,加入10 μL CCK-8试剂,放置培养箱孵育1 h后用酶标仪测定450 nm处的吸光度值(OD)。根据说明书指示计算细胞的相对活力,筛选合适剂量。
1.4.3克隆形成法检测细胞生长 取对数生长期的喉癌TU686细胞,经消化、离心、重悬后,将细胞稀释至每毫升5×104个,按每孔100 μL接种于6孔板,置培养箱培养24 h(37 ℃ 5%CO2),弃培养液,分别加入浓度为0、10、20、40 μmol/L的FMN,7天后弃溶液,用PBS溶液洗涤细胞2次,用4%多聚甲醛固定细胞20 min,弃固定液,用0.1%结晶紫染色15 min,洗去染色液,室温晾干。用Epson Perfection V200扫描仪拍照,用软件计数,并计算克隆细胞形成率。
1.4.4Western blot法检测细胞增殖标志物相关蛋白表达 取对数生长期的喉癌TU686细胞,经消化、离心、重悬后,将细胞稀释至每毫升5×104个,按每孔100 μL接种于96孔板,置培养箱培养24 h(37 ℃ 5%CO2),弃培养液,分别加入浓度为0、10、20、40 μmol/L的FMN,每组设置3个复孔,药物作用48 h,用预冷的PBS洗涤,加入裂解液处理30 min,收集细胞,离心15 min(4 ℃、12 000 r/min),收集上清液。按照BCA试剂盒说明进行蛋白定量。取样后进行聚丙烯酰胺凝胶电泳、转膜、封闭、洗膜、一抗、二抗处理后,加入显色剂进行检测。
1.4.5流式细胞术检测细胞凋亡 取对数生长期的喉癌TU686细胞,消化、稀释、分组等操作同1.4.4,药物作用48 h,收集细胞,经1 000 r/min离心5 min后弃上清,加入Annexin V-FTTC溶液重悬细胞,避光孵育10 min,离心弃上清液,PI冰盒中避光孵育10 min,洗去染色液,用流式细胞仪检测细胞凋亡率。
1.4.6流式细胞术检测线粒体膜电位的变化 取对数生长期的喉癌TU686细胞,消化、稀释、分组等操作同1.4.4,药物作用48 h,收集细胞,经1 000 r/min离心5 min后弃上清,根据线粒体膜电位检测试剂盒说明进行操作,加入JC-1荧光探针染液,置于培养箱20 min(37 ℃ 5%CO2),洗去染色液,用流式细胞仪检测。
1.4.7试剂盒检测线粒体氧化应激标志物 取对数生长期的喉癌TU686细胞,消化、稀释、分组等操作同1.4.4,药物作用48 h,收集细胞,将细胞悬浮于PBS中,反复冻融3次破坏细胞膜,分别按照SOD及MDA试剂盒说明进行操作。
1.4.8Western blot法检测凋亡相关蛋白表达 取对数生长期的喉癌TU686细胞,消化、稀释、分组等操作同1.4.4,应用Western blot法检测p53、Caspase-9、Caspase-3相应抗体的表达,具体操作同上。

2 结果
2.1 不同浓度FMN对喉癌TU686细胞活力的影响本实验设置不同浓度FMN(0、1.25、2.5、5、10、20、40、80、160 μmol/L),结果显示与FMN 0 μmol/L组相比,FMN 10 μmol/L组对TU686细胞活力的抑制作用较小,差异无统计学意义(P>0.05)。随药物浓度的增加,自20 μmol/L开始,FMN对TU686细胞活力的抑制作用增加,差异有显著性(P<0.05,图1)。

图1 不同浓度FMN对喉癌TU686细胞活力的影响
2.2 不同浓度FMN对喉癌TU686细胞生长的影响本实验根据CCK-8实验筛选结果,设置不同浓度FMN(0、10、20、40 μmol/L),结果显示与FMN 0 μmol/L组相比,FMN 10 μmol/L组细胞克隆形成率与之相近,差异无统计学意义(P>0.05);浓度为20 μmol/L时,细胞克隆形成率降低,FMN对细胞生长的抑制作用增加,差异有显著性(P<0.05);随药物浓度的增加,浓度为40 μmol/L时,克隆细胞形成率不足20%,FMN对细胞生长的抑制作用最佳(图2)。上述结果提示,FMN能够降低喉癌TU686细胞的克隆形成率,对细胞生长具有抑制作用。

图2 不同浓度FMN对喉癌TU686细胞生长的影响:
2.3 不同浓度FMN对喉癌TU686细胞增殖的影响实验结果显示,FMN浓度为0 μmol/L及10 μmol/L时,Ki-67、PCNA蛋白相对表达水平相近,差异无统计学意义(P>0.05);浓度为20 μmol/L时,Ki-67、PCNA蛋白相对表达水平降低,FMN对细胞增殖的抑制作用增加,差异有显著性(P<0.05);随着药物浓度的增加,浓度为40 μmol/L时FMN对细胞的增殖抑制作用最强(图3)。上述结果提示,FMN能够降低喉癌TU686细胞Ki-67、PCNA蛋白的表达,对细胞增殖具有抑制作用。
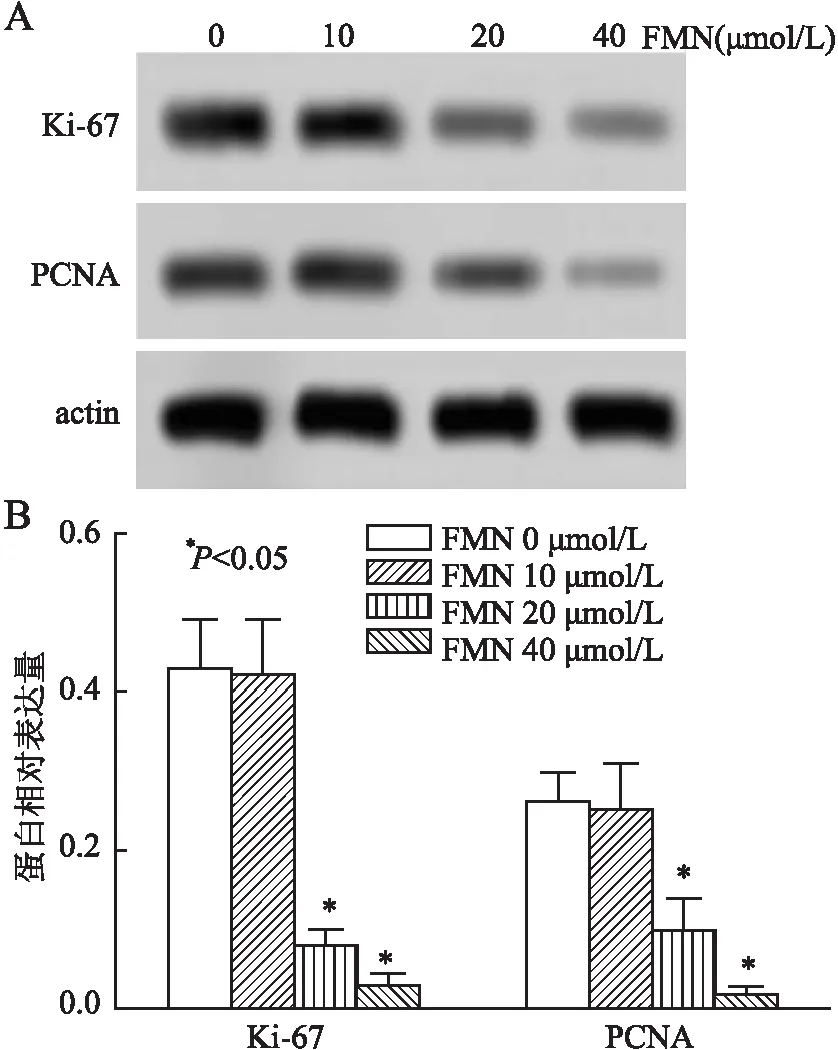
图3 不同浓度FMN对喉癌TU686细胞增殖的影响:
2.4 不同浓度FMN对喉癌TU686细胞凋亡的影响实验结果显示,FMN浓度为0 μmol/L及10 μmol/L时,细胞凋亡率水平相近,差异无统计学意义(P>0.05);与0 μmol/L组相比,浓度为20 μmol/L时,细胞凋亡率上升,FMN对细胞凋亡的诱导作用增加,差异有显著性(P<0.05);随药物浓度的增加,浓度为40 μmol/L时FMN对细胞的诱导凋亡作用最强(图4)。上述结果提示,FMN能够提高喉癌TU686细胞的凋亡率,对细胞凋亡具有诱导作用。

图4 不同浓度FMN对喉癌TU686细胞凋亡的影响:
2.5 不同浓度FMN对喉癌TU686细胞线粒体膜电位的影响活性线粒体损伤是细胞凋亡早期阶段的显著特征,其中包括膜电位的改变。与FMN 0 μmol/L组相比,随药物浓度逐渐增加,绿色荧光细胞百分比增加,表明线粒体膜电位下降,其中20、40 μmol/L组促进线粒体膜的去极化(图5)。上述结果提示FMN对喉癌TU686细胞具有诱导凋亡的作用,可能是通过降低膜电位,促进线粒体膜去极化。

图5 不同浓度FMN对喉癌TU686细胞线粒体膜电位的影响:
2.6 FMN对喉癌TU686细胞线粒体氧化应激标志物的影响与FMN 0 μmol/L组相比,随药物浓度逐渐增加,除FMN 10 μmol/L组差异无统计学意义外,余两组(FMN 20、40 μmol/L)细胞内的抗氧化酶SOD活性显著下降(P<0.05),过氧化代谢产物MDA的含量显著上升(P<0.05,图6),说明体内氧化和抗氧化作用失衡,发生氧化应激作用,细胞线粒体受到损伤。上述结果提示,FMN对喉癌TU686细胞具有诱导凋亡的作用,可能是通过氧化应激反应,促进线粒体损伤。

图6 不同浓度FMN对喉癌TU686细胞线粒体
2.7 不同浓度FMN对喉癌TU686细胞凋亡相关蛋白表达的影响与FMN 0 μmol/L组相比,随着药物浓度逐渐增加,除FMN 10 μmol/L组差异无统计学意义外,余两组(FMN 20、40 μmol/L)的p53、Cleaved cas9/cas9及Cleaved cas3/cas3表达均显著上升(P<0.05,图7)。提示FMN诱导喉癌TU686细胞凋亡可能与p53依赖性线粒体凋亡途径有关。

图7 不同浓度FMN对喉癌TU686细胞p53信号通路
3 结论
喉癌的发病率位居头颈部恶性肿瘤的第2位[9],其发病早期的主要临床表现为声音嘶哑及嗓内异物感,而晚期的主要特征是颈部淋巴结转移[10]。喉、下咽、气管及咽旁间隙解剖学上相连,功能上相辅,一旦发生肿瘤则可彼此相损,严重威胁患者生命[11]。FMN药理作用广泛,其中抗肿瘤作用显著。Zhang等[12]的研究指出FMN可通过改变ERK磷酸化水平及调控Caspase-3和BAX/BCL-2蛋白的表达诱导卵巢癌细胞的凋亡;Wu等[7]研究发现FMN通过调控miR-21和PTEN抑制人膀胱癌细胞的增殖和侵袭;刘红兵等[13]研究表明FMN可通过下调p-AKT和BCL-2表达、上调BAX表达促进胃癌细胞凋亡。FMN能抑制多种癌细胞,表明其具有治疗肿瘤的潜力。
本组应用不同浓度的FMN处理喉癌TU686细胞,一段时间后细胞活力、细胞形成率及Ki-67、PCNA蛋白表达均显著降低,提示FMN对喉癌TU686细胞的生长和增殖具有一定的抑制作用。该结果与Kim等[14]报道的FMN可以抑制癌细胞生长、增殖的结果相吻合。本实验用流式细胞术检测喉癌TU686细胞凋亡情况,结果显示随着FMN浓度增加,细胞凋亡率显著上升,提示FMN能够提高喉癌TU686细胞的凋亡率,对细胞凋亡具有诱导作用。本实验进一步检测线粒体膜电位的变化及氧化应激水平,其中线粒体膜电位的变化是能量代谢变化的标志,是凋亡发生的重要环节[15],而SOD与MDA是重要的抗氧化-氧化平衡指标,间接测定膜系统的损伤程度[16]。本组结果提示,FMN能诱导喉癌TU686细胞凋亡,其机制与降低膜电位,促进线粒体膜去极化,刺激氧化应激反应,促进线粒体损伤有关。该结果与李宁等[17]研究细胞凋亡与线粒体相关性的结论一致。
转录因子p53可调节一系列靶分子,参与细胞周期、生长、增殖、应激反应等生物过程[18]。当细胞接收到凋亡刺激信号时,诱发BAX等促凋亡蛋白活化,线粒体两侧膜电位下降,促进凋亡小体的生成,并通过自我剪切方式活化Caspase-9,Caspase-9进一步对下游Caspase-3进行活化,Cleaved cas3进一步破坏细胞骨架及管家基因的功能,影响正常细胞信号传递及周期调节,从而使细胞出现核凝结、核裂解等凋亡形态学上的改变[19-20]。本实验结果显示,p53、Cleaved cas9/cas9及Cleaved cas3/cas3均显著上升。因此,FMN可能通过以下几种凋亡途径诱导TU686细胞凋亡:p53高表达导致BCL-2/BAX表达失调诱导的线粒体途径凋亡(p53依赖性);线粒体膜通透性转运(MPT)导致的线粒体途径凋亡(非p53依赖性);p53高表达通过死亡受体/配体途径导致的非线粒体途径凋亡。
综上所述,FMN在喉癌中发挥抗肿瘤作用,能够抑制喉癌TU686细胞的生长和增殖,并促进细胞凋亡。因FMN作用后p53、Cleaved cas9/cas9及Cleaved cas3/cas3的表达上调,猜测其机制很可能与p53依赖性线粒体凋亡途径相关。本组后续实验会进一步对该途径中BCL-2/BAX及APAF1的表达进行检测以明确凋亡机制。

