四元复合型缓蚀剂在中性NaCl溶液中对碳钢的缓蚀作用
程正骏,段立东,池 伸,艾俊哲
(长江大学 化学与环境工程学院,荆州 434023)
海水作为一种丰富的可开发资源,代替淡水可缓解能源、淡水资源匮乏等问题[1]。作为工业用水和进行海水淡化时,海水对金属设备及材料的腐蚀一直是一个需要解决的问题[2]。多年来,针对海水中构筑物等的腐蚀防护研究从未停止,如采用电化学保护和耐蚀材料、开发非金属材料、添加缓蚀剂等技术,这些技术的应用一定程度解决了一些问题。
在海水环境中,缓蚀剂技术的发展有目共睹,由于其拥有操作方便、成本低、环境适用性和针对性强等特点被广泛应用[3-5]。英国学者CLAY于1946年最早提出以甲醛作为海水中碳钢的缓蚀剂[6]。此后,各国学者对海水环境中的缓蚀剂进行了大量研究。但这些研究多以提高缓蚀剂的缓蚀率为目的,鲜少考虑缓蚀剂对环境的污染问题,而重金属盐类、磷酸盐、亚硝酸盐等缓蚀剂的广泛使用,对环境产生了巨大危害。20世纪末期,随着绿色缓蚀剂的兴起和发展,海水缓蚀剂开始朝环境友好的方向发展[7]。在实际生产和工程应用中,单一缓蚀剂的缓蚀效果并不理想,将缓蚀剂复配使用则可达到理想的缓蚀效果[8-12]。柳鑫华等[13]研究表明复配缓蚀剂40 mg/L钼酸盐+10 mg/L有机磷酸盐PBTCA+40 mg/L聚环氧琥珀酸+3 mg/L锌离子对碳钢在海水中的缓蚀率达90%以上;陈振宁等[14]针对在3.5% NaCl溶液中的L921A钢复配研究了一种有机/无机复配缓蚀剂,缓蚀率超过97%;黄琳等[15]将600 mg/L钨酸钠+120 mg/L月桂酰肌氨酸钠(SLS)进行复配,缓蚀率增至95.5%,两者具有协同增效作用;MA等[16]研究了海水干湿交替环境中复配缓蚀剂50 mg/L聚天冬氨酸(PASP)+100 mg/L Na2WO4+100 mg/L ZnSO4·7H2O的缓蚀效果,其缓蚀率为92.6%。复合缓蚀剂技术以其绿色、高效、针对性强的特点显示了其独特的优势。
本工作根据低毒、环保、高效的思路设计了复配缓蚀剂,结合相关研究经验,选择将有机膦酸盐(FPA)、葡萄糖酸盐(FPB)、锌盐(FPC)和还原剂(FPD)进行复配,采用正交试验,筛选出性能优良的海水缓蚀剂(HZY03)配方,同时采用电化学技术和表面形貌观察、腐蚀产物分析等方法对该缓蚀剂的作用机制进行了分析探讨。
1 试验
试验材料为Q235钢,主要化学成分(质量分数)为:0.18% C,0.02% Mn,0.45% Si,0.02% S,0.03% P,余量为铁。失重试验和SEM(扫描电子显微镜)观察用试样尺寸为40 mm×13 mm×2 mm,XRD(X射线衍射)分析试样尺寸为50 mm×35 mm×2 mm,所有试样试验前均用SiC水砂纸(400~1 200号)逐级打磨至光滑,蒸馏水冲洗、丙酮除油、无水乙醇脱水干燥,试样表面各处的表面粗糙度一致。最后用精度为0.1 mg的电子天平称量。试验介质为3.5% NaCl(质量分数,下同)溶液,pH为7.8,试验温度为45,80 ℃。
采用旋转挂片法对Q235钢进行腐蚀失重试验,旋转速率为75 r/min,试验溶液为不含和含150 mg/L缓蚀剂的3.5% NaCl溶液,试验时间24 h,之后取出试片并记录试片表面状态及腐蚀产物分布。采用自制酸清洗液(100 mL盐酸+10 g六次甲基四胺+1 000 mL去离子水)清除试样表面腐蚀产物。酸洗时间3 min,将试样从酸洗液中取出后立即用蒸馏水冲洗,然后迅速放入3%(质量分数)NaOH溶液中中和余酸,最后用无水乙醇脱水干燥称量。根据式(1)计算腐蚀速率,根据式(2)计算缓蚀率。

(1)
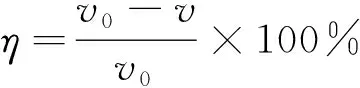
(2)
式中:vcorr为均匀腐蚀速率,mm/a;m1和m2分别为试验前后试样的质量,g;S为试样的总面积,cm2;t为试验时间,h;ρ为试样的密度,g/cm3;η为缓蚀率,%;v0和v分别为缓蚀剂添加前后试样的腐蚀速率,mm/a。
电化学测试在CHI660C电化学工作站上完成。采用三电极体系,其中工作电极为环氧树脂封装的Q235钢,工作面积1 cm2,参比电极为配有鲁金毛细管的饱和甘汞电极(SCE),辅助电极为Pt电极。电极在溶液中先浸泡30 min至开路电位稳定,极化曲线测量时电位扫描由阴极向阳极进行,扫描速率为0.5 mV/s,扫描范围为-200~200 mV(相对开路电位),试验溶液为3.5% NaCl溶液,温度45 ℃,在试验溶液中加入不同量的缓蚀剂,根据Tafel曲线外推得到腐蚀电流密度评价缓蚀剂的缓蚀率,如式(3)所示:
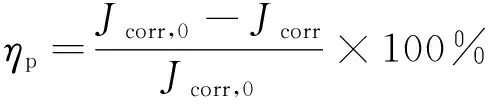
(3)
式中:Jcorr,0和Jcorr分别为加入缓蚀剂前后的腐蚀电流密度。
电化学阻抗谱(EIS)测试的频率为10-2~105Hz,正弦波电压扰动信号的振幅为10 mV,试验溶液为含不同量缓蚀剂的3.5% NaCl溶液,温度45 ℃。利用ZSimpWin软件对阻抗谱进行数据模拟,并按式(4)计算缓蚀率:
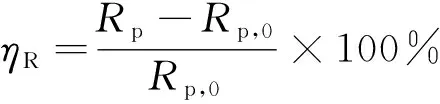
(4)
式中:Rp,0和Rp分别代表添加缓蚀剂前后的极化电阻。
采用MIRA3 TESCAN扫描电子显微镜对腐蚀前后(腐蚀时间为24 h)的试样进行表面形貌表征。采用Empyrean X射线衍射仪对在不含和含150mg/LHZY03缓蚀剂中腐蚀6h的试样进行分析。
2 结果与讨论
2.1 缓蚀剂的配方
根据缓蚀剂配方的初步筛选结果,利用正交试验确定FPA、FPB、FPC及FPD四种有效组分的最优复配浓度,设计四因素三水平的正交试验,其因素水平如表1所示。
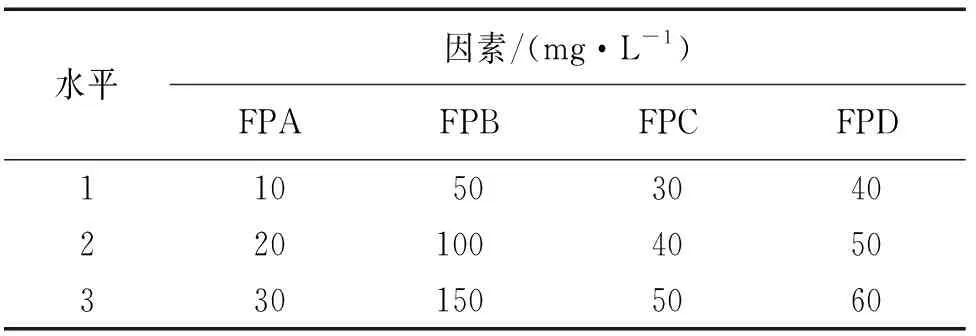
表1 正交试验水平因素表Tab. 1 Horizontal factors of orthogonal experiment
采用失重法测试试样在含不同量缓蚀剂试验溶液中的腐蚀速率,结果表明,未加入缓蚀剂溶液中的试样腐蚀最严重,腐蚀速率为0.536 2 mm/a,空白体系中表面腐蚀产物不断增加,溶液呈淡黄色,而加入缓蚀剂后试样表面光亮。由表2可知:各因素的极差大小排序为FPB(2.51)>FPC(2.31)>FPD(0.9)>FPA(0.83),由此可知缓蚀剂中有效组分FPB、FPC含量的变化会对缓蚀效果产生较大的影响。对四元复配缓蚀剂各组分缓蚀率随含量的变化进行分析,对FPB而言,K1>K3>K2,所以FPB的含量选择50 mg/L最合适;同理:FPC、FPD、FPA的最优组合质量浓度分别为50 mg/L、40 mg/L和10 mg/L。即FPA∶FPB∶FPC∶FPD(质量比)=1∶5∶5∶4。

表2 正交试验结果Tab. 2 Results of orthogonal experiment
按此最优浓度复配组成的缓蚀剂HZY03呈棕黄色、澄清透明、水溶性好。在NaCl溶液中加入该复配缓蚀剂后,溶液呈无色澄清状的均相体系。该缓蚀剂溶液中Q235钢的腐蚀速率降低至0.043 0 mm/a,缓蚀率可达91.96%。下文中所用缓蚀剂皆为HZY03缓蚀剂。
2.2 缓蚀剂浓度的影响
由图1可见:当缓蚀剂质量浓度低于100 mg/L时,随着缓蚀剂量的增加缓蚀率基本呈直线上升;当缓蚀剂质量浓度大于100 mg/L时,继续增加缓蚀剂的量,缓蚀率变化不大。此外,由宏观腐蚀形貌可见:当缓蚀剂的加入量小于100 mg/L时,试样的腐蚀较为严重,表面粗糙且存在淡黄色的锈斑;当HZY03的加入量到达100 mg/L后,试样表面光亮,边缘存在微量的蚀斑,这可能是因为氯离子具有较强的穿透性,对局部微小区域的缓蚀膜造成破坏;当缓蚀剂加入量到达150 mg/L后,试样表面光亮洁净,边缘的微小锈斑消失,缓蚀效果良好。为了节约成本同时获得较高的缓蚀率,本试验最终确定缓蚀剂的加入量为150 mg/L,此时其对Q235钢在3.5% NaCl溶液中的缓蚀率达91.96%。

图1 缓蚀剂加入量对缓蚀率及试样腐蚀速率的影响Fig. 1 Effect of inhibitor concentrations on inhibition and corrosion rates of samples
2.3 温度的影响
由表3可见:随着温度的升高,未加缓蚀剂体系中试样的腐蚀速率降低。这是因为在3.5% NaCl溶液中发生的是氧去极化腐蚀,从动力学考虑,一方面温度的升高有助于溶解氧的扩散和电导率的增加,腐蚀加速;另一方面温度的升高也会降低溶液中溶解氧的含量,从而抑制腐蚀的阴极反应[17]。由表3可见,随着温度的升高,试样在空白溶液中的腐蚀速率由0.536 2 mm/a降至0.458 0 mm/a,后者起到了主导作用,从而抑制了腐蚀。不同温度下缓蚀剂的缓蚀效果大体趋势一致,均随着缓蚀剂量的增加而增大,且在其加入量为150 mg/L时达到最大值,在45 ℃和80 ℃溶液中的缓蚀率分别为91.96%和91.02%。

图2 试样在含不同量缓蚀剂的3.5% NaCl中的极化曲线Fig. 2 Polarization curves of samples in 3.5% NaCl solutions containing different concentrations of inhibitor

表3 在不同温度的试验溶液中缓蚀剂加入量对缓蚀率及试样腐蚀速率的影响Tab. 3 Effects of inhibitor concentrations on inhibition and corrosion rates of samples in test solution at different temperatures
2.4 极化曲线
由图2可见:在3.5% NaCl溶液中加入复配缓蚀剂后,碳钢的自腐蚀电位(Ecorr)明显正移,说明复配缓蚀剂对阳极反应有较大的影响,是一种阳极型缓蚀剂。随着缓蚀剂量增加腐蚀电流密度(Jcorr)降低,根据Faraday第二定律可知,腐蚀电流密度与腐蚀速率成正比,所以加入150 mg/L复配缓蚀剂可以有效抑制Q235钢的腐蚀,电极表面形成的缓蚀膜越来越致密。由表4可见:阴极塔菲尔斜率(bc)和阳极塔菲尔斜率(ba)随着缓蚀剂量的增加而不断减小,Jcorr也降低很多,说明缓蚀剂的加入不但抑制阳极过程,对阴极过程也有一定的抑制作用[18]。
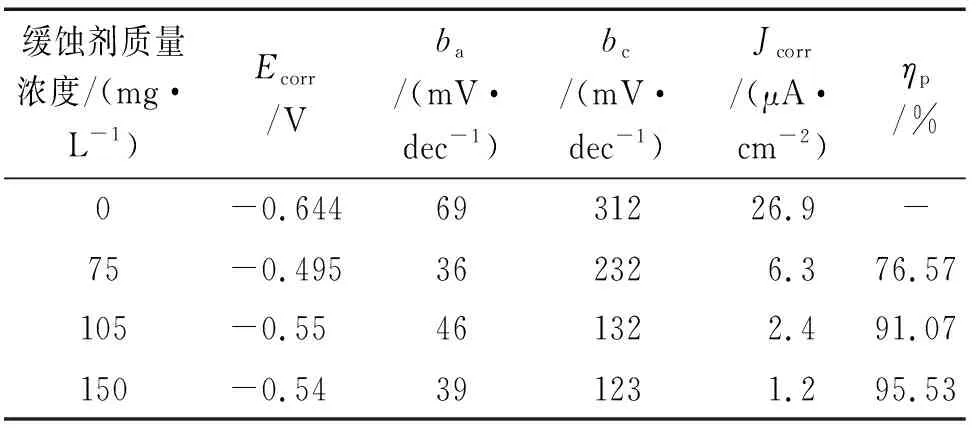
表4 极化曲线拟合参数Tab. 4 Fitting results of polarization curves
2.5 电化学阻抗
由图3的Nyquist图可知,对于浸泡于含不同量缓蚀剂试验溶液中的Q235钢,其阻抗谱均呈现出一个规则容抗弧,且随着缓蚀剂量的增加,容抗弧半径逐渐增大,表明随着缓蚀剂量的增加,腐蚀反应过程的电荷转移电阻逐渐增大,腐蚀反应更难进行[19]。这是因为随着缓蚀剂量的增加,缓蚀剂在电极表面形成的缓蚀膜越来越致密,阻止了腐蚀介质与金属基体的接触,从而抑制了金属的腐蚀[20]。由图3还可见:相位角图中存在一个明显的峰,表明反应过程存在一个时间常数;由Bode图的阻抗模值图可知,添加缓蚀剂后Q235钢的低频阻抗模值明显增大,由311 Ω·cm2增大到1 899 Ω·cm2,也证明了缓蚀剂的缓蚀效果较好。
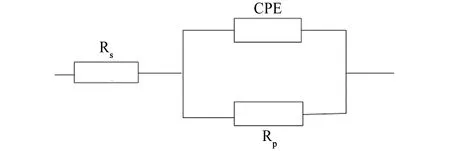
为了进一步定量研究缓蚀剂的加入量对腐蚀过程的影响,对电化学阻抗谱进行等效电路拟合分析,等效电路如图4所示,拟合结果见表5。其中RS代表溶液电阻,由于腐蚀电极的表面总存在弥散效应,双电层电容的频响特征与纯电容原件存在偏离,因此用常相位角原件Q(CPE)表示,n为弥散指数,0 表5 电化学阻抗拟合结果Tab. 5 Fitting results of EIS (a) Nyquist图 (b) Z-lgF图 (c) φ-lgF图图3 试样在含不同量缓蚀剂的3.5% NaCl溶液中的电化学阻抗谱Fig. 3 EIS of samples in 3.5% NaCl solution containing different concentrations of inhibitor 图4 等效电路图Fig. 4 Equivalent circuit for impedance analysis 对比电极在添加和未添加缓蚀剂体系中的电化学参数可知,添加缓蚀剂后腐蚀电流密度减小,极化电阻增大,与失重法测得的结果一致。表明这种阳极型缓蚀剂对Q235钢在3.5% NaCl溶液中的腐蚀具有很好的抑制作用。 由图5可见:在不含缓蚀剂的试验溶液中腐蚀后,试样表面原有打磨后的划痕已经完全被腐蚀,表面粗糙、不平整且出现深浅不一的溃疡状腐蚀坑,证明试样表面发生了严重的腐蚀;而加入缓蚀剂后,试样表面较为平整,且腐蚀迹象不明显,仍可以看到打磨后的痕迹,表明缓蚀剂的加入阻止了腐蚀介质与金属基体的接触,从而有效保护了金属。结合以上研究结果,复配缓蚀剂HZY03在3.5% NaCl溶液中对Q235钢具有良好的缓蚀作用。 由图6可见,在空白体系中浸泡6 h后,试样表面检测出Fe的特征峰,此外还有Fe3O4及FeOOH的特征峰;而加入缓蚀剂后,试样表面主要检测到Fe的特征峰,另有较弱的FeOOH特征峰,表明缓蚀剂的加入较好地阻隔了基体与腐蚀介质接触,能够很好地抑制金属的腐蚀,这与SEM观察结果一致。 (a) 未添加缓蚀剂 (b) 加入150 mg/L缓蚀剂图5 试样在不含和含复配缓蚀剂的3.5%NaCl溶液中腐蚀后的表面形貌Fig. 5 Surface SEM morphology of samples after corrosion in 3.5% NaCl solution without (a) and with 150 mg/L (b) inhibitor 图6 在不含和含150 mg/L缓蚀剂的3.5% NaCl溶液中浸泡6 h后试样表面的XRD图Fig. 6 XRD patterns of sample surface after corrosion in 3.5% NaCl solution without and with 150 mg/L inhibitor for 6 h 综合上述试验结果,在3.5% NaCl溶液中加入复配缓蚀剂HZY03,其组分间具有协同缓蚀作用,可在碳钢表面形成较为致密的缓蚀膜层,抑制腐蚀反应的阳极过程和阴极过程,达到很好抑制碳钢腐蚀的效果。FPA所含P原子作为缓蚀剂分子的活性中心,其净电荷为正值,呈缺电子状态,Fe的d轨道中已有的电子受到原子核的吸引力相对较弱,易于摆脱核吸引的电子与P原子形成d-π反馈键,自发吸附于Fe表面,随后分子之间缓慢重排直至形成稳定有序的吸附膜;并且分子中的PO(OH)2与FPC中的Zn2+形成配合物,同时Zn2+还可以与阴极反应生成的OH-形成Zn(OH)2沉淀,在金属表面形成络合物沉淀膜;缓蚀剂组分中的FPB离子在阳极区与Fe2+形成螯合物从而抑制腐蚀反应的阳极过程,而缓蚀剂中的FPD可以降低、削弱阴极反应。四种复配组分之间相互协同,形成牢固的、吸附与沉淀混合的缓蚀剂膜,从而有效抑制了Q235钢在盐水中的腐蚀。 (1) 采用动态腐蚀失重法和正交试验,得到3.5% NaCl溶液中能抑制Q235钢腐蚀的最优缓蚀剂HZY03。该复配缓蚀剂可以有效抑制较高温度下NaCl溶液对碳钢的腐蚀。在80 ℃时,150 mg/L HZY03对Q235钢的缓蚀率可达91.02%。 (2) 电化学测试表明复配缓蚀剂是一种阳极型缓蚀剂。缓蚀剂的加入能使腐蚀电流密度明显减小,极化电阻明显增大;缓蚀剂中各组分之间具有协同增效作用,有效抑制了Q235钢在3.5% NaCl溶液中的腐蚀。 (3) SEM图像和XRD谱图表明,在3.5% NaCl溶液中加入该缓蚀剂后,浸泡其中的碳钢表面没有明显全面腐蚀迹象,也没有点蚀,打磨痕迹清晰可见。HZY03缓蚀剂能够在金属基体表面形成一层致密的缓蚀膜,阻止金属与腐蚀介质接触,从而抑制腐蚀。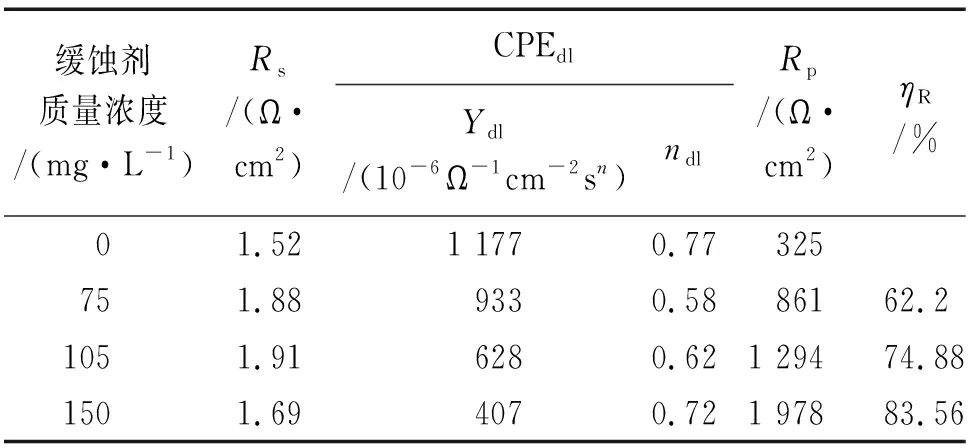

2.6 腐蚀形貌表征
2.7 腐蚀产物XRD分析结果



3 复配缓蚀剂的缓蚀作用
4 结论

