合成菌群的构建及其对发酵香肠风味的改良效果
赵拎玉 杨娟春 钟桂霞 杨鹏 刘登勇 李儒仁 荣良燕

摘 要:以自然发酵香肠为研究对象,通过分析其细菌群落优势菌属(相对丰度>1%)、共现菌属(Spearman相关性系数|ρ|>0.5,P<0.05),以及与挥发性风味物质显著相关(P<0.05)的菌属,确定出调控自然发酵香肠典型风味的核心菌群,据此构建合成菌群,与进口商业发酵剂发酵香肠进行对比,分析合成菌群对发酵香肠感官和风味的改良效果。结果表明:自然发酵香肠的核心菌属为葡萄球菌属(Staphylococcus)、乳杆菌属(Lactobacillus)、假单胞菌属(Pseudomonas)和链球菌属(Streptococcus),以上述菌属对应的代表性菌种清酒乳杆菌(Lactobacillus sakei)、嗜热链球菌(Streptococcus thermophilus)、马胃葡萄球菌(Staphylococcus equorum)和木糖葡萄球菌(Staphylococcus xylosus)构建的合成菌群制备改良发酵香肠,其感官特性及风味明显优于商业发酵剂制备发酵香肠,具体表现为:前者的清新味和甜香味较为明显,酸味、咸味和金属异味较淡,特别是具有潜在清新味和果香味的醛类和芳香烃类物质含量显著高于后者(P<0.05)。
关键词:发酵香肠;核心菌群;合成菌群;风味
Construction and Evaluation of Synthetic Microbiota as a Starter Culture for Flavor Improvement in Fermented Sausage
ZHAO Linyu, YANG Juanchun, ZHONG Guixia, YANG Peng, LIU Dengyong, LI Ruren*, RONG Liangyan*
(National and Local Joint Engineering Research Center of Storage, Processing and Safety Control Technology for Fresh Agricultural Products, College of Food Science and Technology, Bohai University, Jinzhou 121013, China)
Abstract: By analyzing the dominant bacterial genera (relative abundance > 1%), co-occurring genera (Spearman correlation coefficient |ρ| > 0.5, P < 0.05) and flavor-producing ability of genera in spontaneously fermented sausage, the core bacterial community responsible for regulating the typical flavor of fermented sausage were identified. Based on this, a synthetic microbiota was constructed and evaluated for its efficacy in improving the sensory and flavor profile of fermented sausage using imported commercial starters as the control. The results showed that the core bacterial genera of spontaneously fermented sausage were Staphylococcus, Lactobacillus, Pseudomonas and Streptococcus. The synthetic microbiota consisting of Lactobacillus sakei, Streptococcus thermophilus, Staphylococcus equorum and Staphylococcus xylosus as representative species of these genera were more effective in improving the sensory characteristics and flavor of fermented sausage than the commercial starter cultures. Specifically, the former had a clean and sweet aroma as well as light sour and salty taste and metallic odor, and contained significantly higher contents of aldehydes and aromatic hydrocarbons than the latter (P < 0.05).
Keywords: fermented sausage; core microbiota; synthetic microbiota; flavor
DOI:10.7506/rlyj1001-8123-20210408-096
中圖分类号:TS251.5 文献标志码:A 文章编号:1001-8123(2021)11-0016-08
引文格式:
赵拎玉, 杨娟春, 钟桂霞, 等. 合成菌群的构建及其对发酵香肠风味的改良效果[J]. 肉类研究, 2021, 35(11): 16-23. DOI:10.7506/rlyj1001-8123-20210408-096. http://www.rlyj.net.cn
ZHAO Linyu, YANG Juanchun, ZHONG Guixia, et al. Construction and evaluation of synthetic microbiota as a starter culture for flavor improvement in fermented sausage[J]. Meat Research, 2021, 35(11): 16-23. DOI:10.7506/rlyj1001-8123-20210408-096. http://www.rlyj.net.cn
自然发酵香肠是由多菌种发酵转化肌肉中的碳水化合物、蛋白质和脂质等形成的一类集独特风味、营养于一体的中高端发酵食品[1]。然而,受限于加工环境、气候条件、发酵周期长和质量良莠不齐,自然发酵无法满足现代化工业的需求[2]。为了量产品质稳定的发酵香肠,商业发酵剂的引进成为解决该问题的主要策略[3-4]。依据产酸、产香等功能特性组合菌种是制备现有商业发酵剂的主要思路[5-7],典型代表有:清酒乳杆菌+肉葡萄球菌[8]、
戊糖片球菌+木糖葡萄球菌[9]等。但这种菌种组合开发出的产品与自然发酵香肠存在一定差距,特别是酸味较重,清新味、果味和甜味不足[10],在一定程度上不能满足中国消费者的喜好。因此,改善接种发酵香肠的风味缺陷是尚未解决的难题。
研究表明,合成菌群在还原自然发酵产品的风味方面具有一定优势。合成菌群是指在明确定义的基质中,通过精选2 个或多个物种而人工创造的群落。例如,在中国清香型白酒[11]和豆瓣酱[12]中,通过鉴定体系的核心菌群并用菌属对应的代表性菌种构建合成菌群进行发酵,结果表明,由合成菌群产生的风味物质种类占比与自然发酵较为相似。这证明合成的核心菌群在重现自然发酵产品的风味图谱上有一定潜力。但合成菌群的构建及其在发酵香肠中的应用相关报道还很少。创建合成菌群首先要明确核心菌群,在发酵食品核心菌群的确定中,多考虑菌种的稳定性、优势性[13]、功能性[14]和菌种之间的相互作用[11]。例如,白酒中的5 个菌属在考虑了优势性、风味生产力和菌种共现性的基础上被确定为核心菌群[11]。然而,尽管自然发酵香肠的菌群结构已有诸多报道,许多优势菌属[15]和产香核心菌属[16]被逐一揭示,但目前发酵香肠中能够同时满足菌种优势性、风味生产力和菌种共现性的核心菌群还有待确定,且已确定的核心菌群应用效果尚未验证。
本研究以前期工作中筛选的市售销量较高且满足中国消费者喜好的自然发酵香肠为研究对象[17],选择3 个批次的自然发酵香肠,通过解析该产品的优势菌属及其共现关系,并将挥发性风味物质与优势菌属进行相关性分析,确定出自然发酵香肠的核心菌群,最后以核心菌群为参考依据建立合成菌群,制作发酵香肠,分析其对进口商业发酵剂接种发酵香肠的风味改良效果,这对于开发新型国产发酵剂具有指导意义。
1 材料与方法
1.1 材料与试剂
自然发酵香肠样品产自西班牙巴塞罗那,主要配料为猪肉、食用盐、乳糖、香料、硝酸钾和亚硝酸钠。3 批样品分别以CG1(生产日期:2020年5月7日)、CG2(生产日期:2019年8月6日)和CG3(生产日期:2019年5月26日)表示,每批3 根香肠,质量90 g。样品分批购买,取样后于-80 ℃冻藏备用,3 批样品同时采集并检测。
清酒乳杆菌(Lactobacillus sakei CICC 21858) 中国工业微生物菌种保藏管理中心;嗜热链球菌(Streptococcus thermophilus SM-17)、马胃葡萄球菌(Staphylococcus equorum S.NS)由本实验室自行分离并保藏;木糖葡萄球菌(Staphylococcus xylosus SXH-01)、商业发酵剂THM-17(戊糖片球菌+木糖葡萄球菌)、
商业发酵剂PRO-MIX5(清酒乳杆菌+类植物乳杆菌+木糖葡萄球菌) 上海萨科化学有限公司;2-丁醇 上海阿拉丁生化科技股份有限公司。
1.2 仪器与设备
SW-CJ-2FD超净工作台 苏净集团苏州安泰空气技术有限公司;L5S紫外-可见分光光度计 上海仪电分析仪器有限公司;恒温恒湿培养箱 德国Binder公司;
THZ-100B恒温培养摇床、LRH150智能生化培养箱
上海一恒科学仪器有限公司;Allegra 64R高速冷冻离
心机 美国Beckman Coulter公司;7890B-5977B氣相色谱-质谱联用仪 美国安捷伦科技公司。
1.3 方法
1.3.1 微生物发酵剂的制备
将单菌落接种于肉汤培养基中,恒温摇床中180 r/min、37 ℃培养24 h,以1%接种量接种于肉汤培养基中培养至对数期末。取菌液于无菌离心管中,4 ℃、6 000 r/min离心10 min,弃上清液,添加适量无菌生理盐水稀释,测定600 nm波长处光密度(OD600 nm)。将OD600 nm代入菌密度标准曲线(将离心后的菌体稀释至不同浓度,测定OD600 nm并进行平板计数,将OD600 nm与菌落数对应绘制成标准曲线)中计算活菌数[18],使用生理盐水将菌液浓度调至109~1010 CFU/mL。
1.3.2 发酵香肠的制作
工艺流程:原料预处理→绞碎→斩拌→灌肠→发酵→干燥→成品[19]
配方:猪后腿肉、猪背膘(肥瘦肉质量比1∶4)、盐2.5%、葡萄糖0.3%、D-异抗坏血酸钠0.05%、亚硝酸钠0.015%、香辛料0.3%、发酵剂(对照组不添加发酵剂;商业发酵剂组THM-17和PRO-MIX5添加量为0.02%;合成菌群组中L. sakei CICC 21858和S. thermophilus SM-17添加量均为106 CFU/g,S. equorum S.NS和S. xylosus SXH-01添加量均为107 CFU/g)。
操作要点:1)原料预处理:去除猪肉表面的筋膜、血渍,切块冷冻,猪背膘切丁备用,瘦肉用绞肉机绞碎;2)接种斩拌:将配料、发酵剂、香辛料加入肉糜中,同方向斩拌至肉馅混合均匀;3)灌肠:将搅拌好的肉馅填充到肠衣中,每隔10 cm左右打结,填充过程保持肠衣饱满紧实;4)发酵:发酵箱温度20~25 ℃,相对湿度80%~95%,72 h;5)干燥:干燥箱温度10~18 ℃,相对湿度70%~80%,15~20 d。
1.3.3 16S rDNA扩增子测序
将发酵香肠于超净台内拆封后在同一部位均匀取样,每根样品2 g,共取3 份。样品使用灭菌剪刀剪碎,装入5 mL冻藏管进行统一编号,于-80 ℃冻藏后,加干冰送至天津诺禾致源生物科技有限公司进行核酸提取和高通量测序。
1.3.4 挥发性风味物质测定
参考Corral等[20]的方法。称取2 g切碎的香肠,加入10 μL 1.62 mg/mL 2-丁醇于20 mL顶空瓶中封盖,60 ℃平衡15 min;使用50/30 μm CAR/DVB/PDMS固相微萃取头于60 ℃萃取40 min。萃取头于250 ℃进样口热解吸5 min。色谱条件:DB-WAX毛细管柱(30 m×250 μm,0.25 μm);载气为氦气,流速1.0 mL/min,不分流方式进样;进样口温度250 ℃。升温程序:初始温度40 ℃,保持4 min;以5 ℃/min升至245 ℃,保持5 min。质谱条件:离子源温度230 ℃,电离方式为EI+,电子能量-70 eV,传输线温度250 ℃;扫描范围m/z 20~500。定性和定量分析:挥发性成分经气相色谱分离后,用质谱进行分析鉴定。结果通过计算机谱库(NIST/Wiley)进行检索。以2-丁醇作为内标,进行相对定量。挥发性风味物质含量按下式计算。
式中:内标质量为16.2 μg,样品质量为2 g。
1.3.5 感官评价
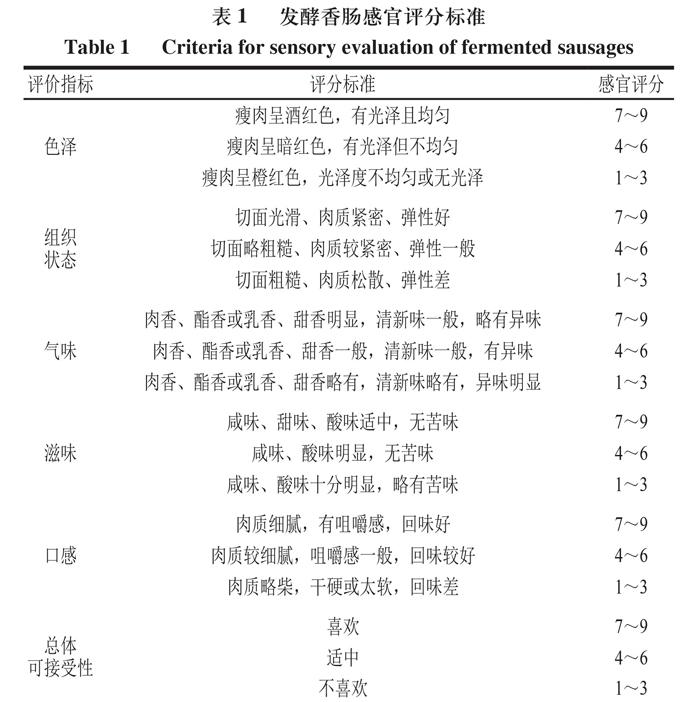
选择11 名经过系统培训的感官评价人员参与感官评价。取20 g香肠样品去除肠衣后切成3 mm厚的片状,装在不透明的白色塑料杯中,用随机3 位数编码。感官评价人员按照表1对样品进行独立打分[21-22]。
1.4 数据处理
采用IBM SPSS Statistics 19软件进行统计分析;使用Origin 2019b软件绘制感官雷达图;使用GraphPad Prism 8.0.2软件绘制稀释曲线、菌属相对丰度图;使用Heml 1.0.3.7软件绘制相关性热图;使用Gephi 0.9.2软件绘制相关性网络图,采用Fruchterman Reingold算法进行可视化。
2 结果与分析
2.1 自然发酵香肠优势菌属分析
对3 批自然发酵香肠的测序下机数据进行拼接、质控和嵌合体过滤,得到可用于后续分析的有效Tags序列,所有有效Tags序列以97%的一致性进行操作分类单元(operational taxonomic units,OTUs)聚类和物种注释,得到816 个属。
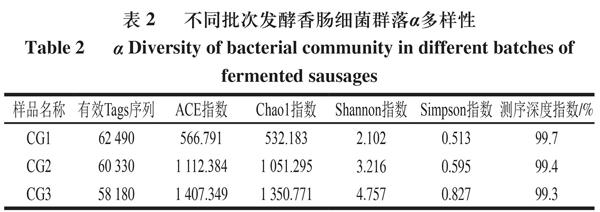
对3 批发酵香肠的微生物群落α多样性进行分析,由表2可知,样品CG3的Shannon指数和Simpson指数较高,表明其群落多样性较高且物种分布较均匀,CG3的ACE指数和Chao1指数也较高,表明其细菌丰度较高。3 个样本的测序深度指数均在99%以上,表明样本中几乎所有的细菌都能被检测到。
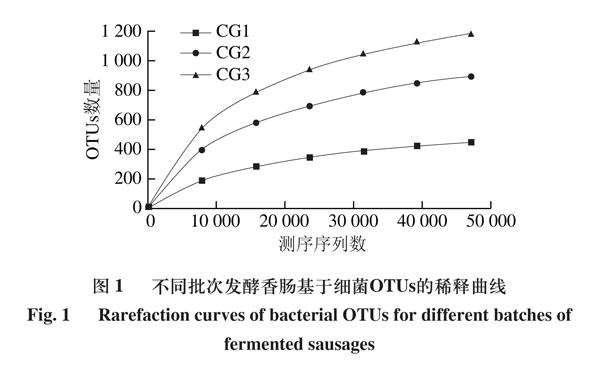
由图1可知,随着测序序列数增加,样品中OTUs数量增加,稀疏曲线逐渐趋于平坦,上升趋势变小,表明测序数据量渐趋合理,能够准确反映出不同样品中微生物的多样性[16]。
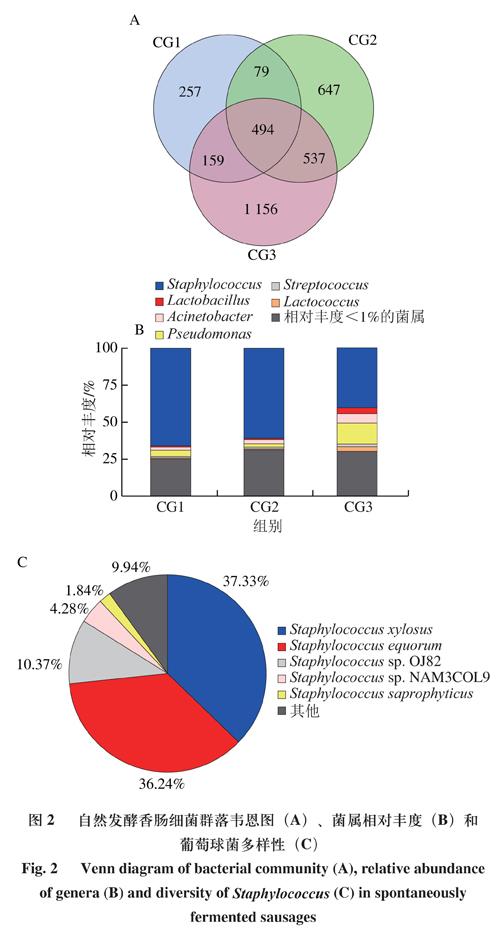
韦恩图能够展示OTUs在不同样本中的分布情况。由图2可知,所有样本中共有的OTUs有494 个,通过物种注释得到了61 个属,其中平均相对丰度>1%的优势菌属有6 个(图2B),分别为乳杆菌属(Lactobacillus)、葡萄球菌属(Staphylococcus)、不动杆菌属(Acinetobacter)、假单胞菌属(Pseudomonas)、链球菌属(Streptococcus)和乳球菌属(Lactococcus)。葡萄球菌属在所有样品中的平均相对丰度>50%且多样性丰富,其中木糖葡萄球菌(Staphylococcus xylosus)和马胃葡萄球菌(Staphylococcus equorum)占比最高,分别为37.33%和36.24%(图2C),它们是自然发酵香肠中最常见的葡萄球菌[23]。
2.2 自然发酵香肠优势菌属共现性关系
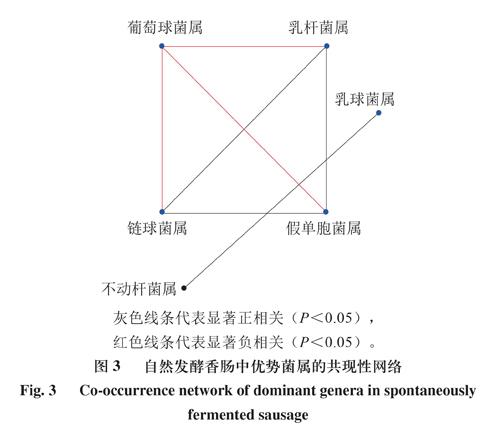
将自然发酵香腸中相对丰度>1%的优势菌属进行Spearman相关性分析[24],由于Spearman相关性系数|ρ|>0.5、P<0.05可以被认为是一个有效的共现事件[25-26],因此用以识别自然发酵香肠的共现微生物[27]。
由图3可知,通过共现性网络分析,6 个优势菌属之间总共获得了7 条边。葡萄球菌属、乳杆菌属、假单胞菌属和链球菌属高度连接,彼此之间存在显著相关性(P<0.05),平均每个节点3 条边,共现发生率均为42.86%。乳杆菌属、假单胞菌属和链球菌属之间两两显著正相关(P<0.05),葡萄球菌属与乳杆菌属、假单胞菌属、链球菌属均呈显著负相关(P<0.05)。此外,不动杆菌属和乳球菌属存在相关性,但它们与其他菌属之间没有显著相关性。
2.3 自然发酵香肠优势菌群与挥发性风味物质的相关性分析
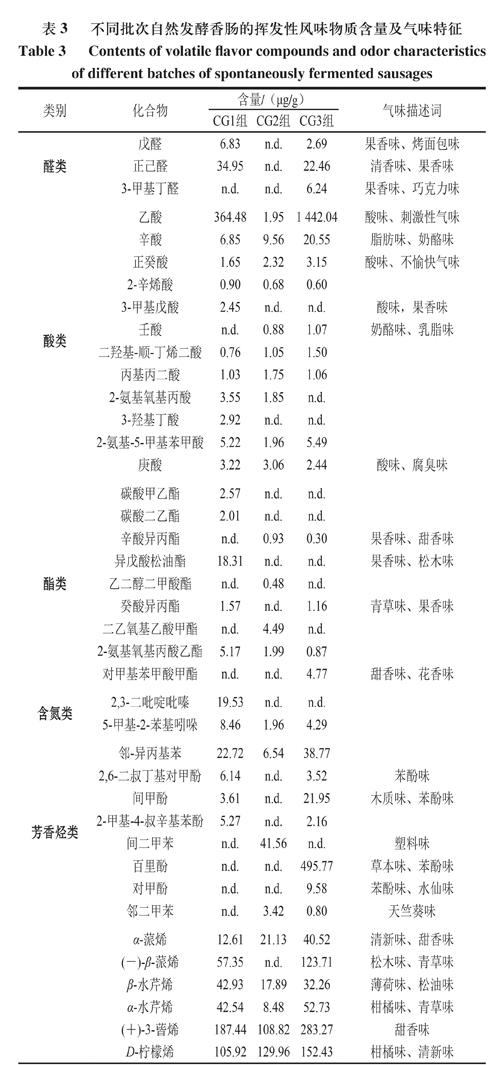
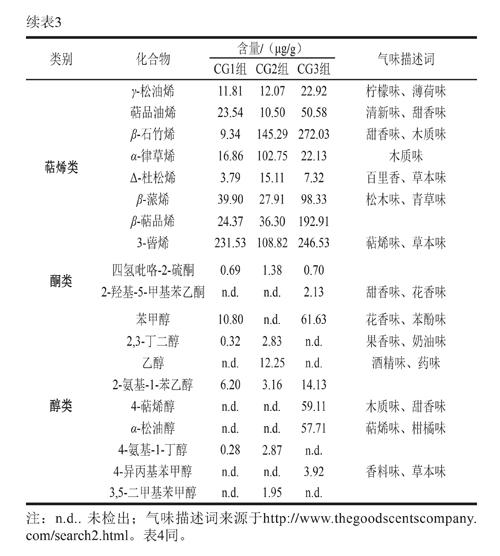
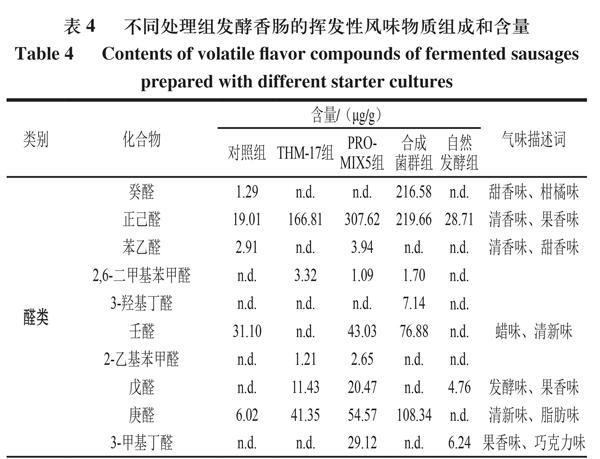
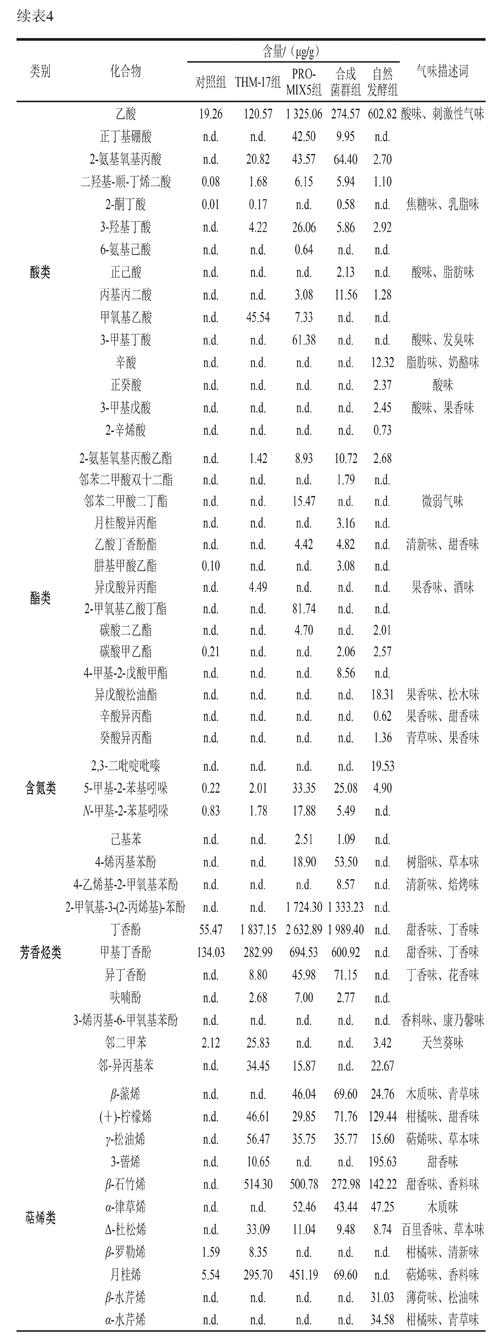
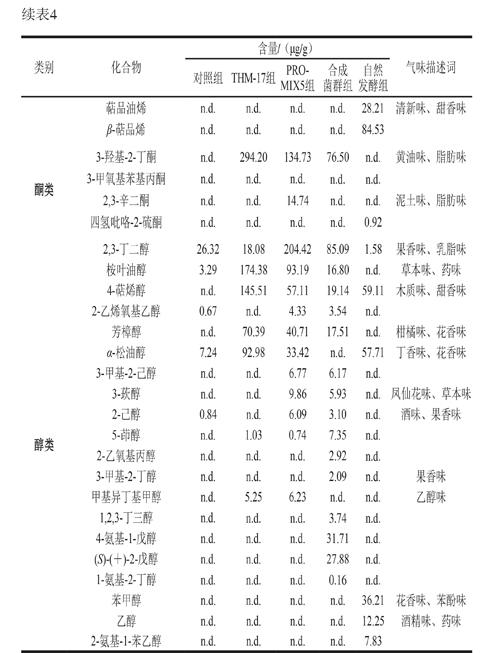
由表3可知,3 批自然发酵香肠中共鉴定出59 种挥发性风味物质。醛类物质有戊醛、正己醛和3-甲基丁醛3 種,这类物质阈值较低,具有贡献发酵香肠清新味和果香味的潜力;辛酸异丙酯、异戊酸松油酯、癸酸异丙酯和对甲基苯甲酸甲酯等酯类物质能贡献果香味和甜香味,这些酯类物质中,包含辛酸异丙酯和癸酸异丙酯在内的长链酯是赋予传统自然发酵香肠优良感官特性的典型风味物质[9];萜烯类物质主要来源于香辛料,且阈值较高[28],主要贡献出清新味、木质味和草本味等,该类物质在自然发酵香肠挥发性风味物质中的占比较大,种类也较多;此外,含氮类物质2,3-二吡啶吡嗪也被检出,这类物质也是发酵香肠中常见的低阈值物质[29-30]。
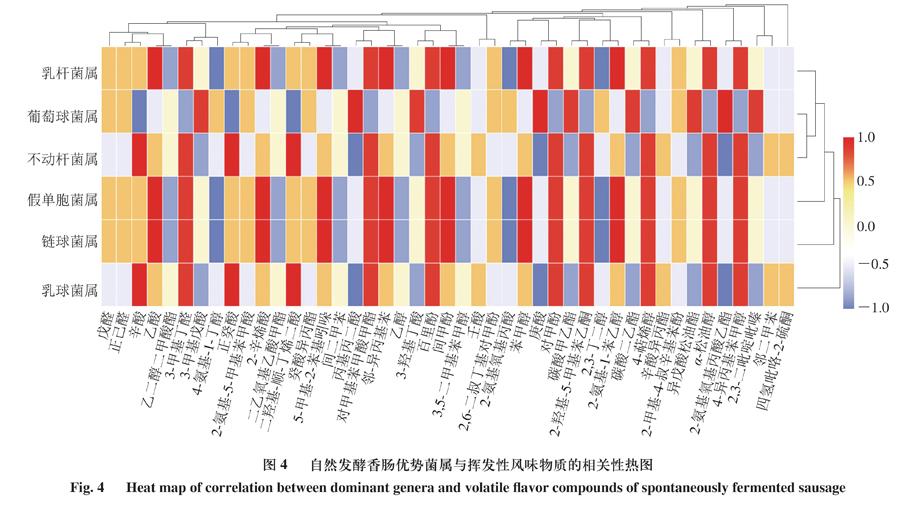
利用Spearman相关性分析建立优势菌属与挥发性风味物质(不含萜烯类物质)的相关性。由图4可知,葡萄球菌属、乳杆菌属、不动杆菌属、假单胞菌属、链球菌属和乳球菌属分别与3、7、3、7、7、3 种风味物质呈显著正相关(P<0.05),与3、3、3、3、3、3 种风味物质呈显著负相关(P<0.05)。乳杆菌属和链球菌属与酸类和醇类物质呈显著正相关(P<0.05),如乙酸、2-辛烯酸和苯甲醇,也与邻-异丙基苯和间甲酚呈显著正相关(P<0.05),葡萄球菌属与2-氨基氧基丙酸乙酯、庚酸和丙基丙二酸呈显著正相关(P<0.05),不动杆菌属和乳球菌属与辛酸、正癸酸和二羟基顺丁烯二酸呈显著正相关(P<0.05)。特别地,经Spearman相关性分析,假单胞菌属和链球菌属与该45 种挥发性风味物质的相关性一致。
2.4 合成菌群与商业发酵剂接种发酵香肠的感官和风味差异
通过对自然发酵香肠进行群落分析,确定出6 个优势菌属(相对丰度>1%)、4 个共现菌属,这些菌属都能贡献具有良好感官描述的挥发性风味物质,因而将满足高丰度、共现性和产挥发性风味物质的葡萄球菌属、乳杆菌属、假单胞菌属和链球菌属定义为自然发酵香肠的核心菌属。鉴于假单胞菌属和链球菌属与挥发性风味物质的相关性一致,且与其他菌属的共现性相同,考虑到菌属的适用性,本研究仅使用其中之一的链球菌属与葡萄球菌属、乳杆菌属建立合成菌群。由于菌属中包含多样化的菌种,因此使用单个菌种代表对应的菌属[13]。特别地,葡萄球菌的多样性显著,所以该合成菌群中纳入了2 株葡萄球菌。综上,本研究使用L. sakei CICC 21858、S. thermophilus SM-17、S. equorum S.NS和S. xylosus SXH-01构建合成菌群,并与商业发酵剂接种发酵香肠的感官和风味特征进行比较。
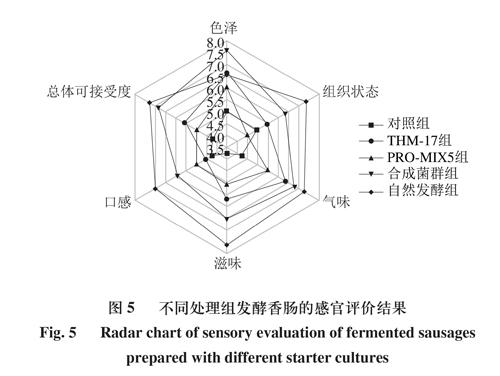
由图5可知,合成菌群组发酵香肠的总体可接受度评分为6.85,高于商业发酵剂THM-17组(5.58)和PRO-MIX5组(4.95),气味上的差异主要表现在合成菌群组的清新味和甜香味更明显,酸味和金属异味较淡。但自然发酵香肠甜香、乳香味浓郁,清新味较淡,酸味、咸味极淡,因而气味感官评分更高。
由表4可知,通过对比挥发性风味物质,合成菌群组发酵香肠潜在贡献清新味、果香味和甜香味的醛类物质含量(630.30 μg/g)高于THM-17组(224.12 μg/g)和PRO-MIX5组(462.49 μg/g),如癸醛、3-羟基丁醛、壬醛和庚醛等,这可能是合成菌群组发酵香肠清新味和甜香味较强的原因。贡献黄油味、脂肪味的酮类物质,如3-羟基-2-丁酮,在合成菌群组中的含量为76.50 μg/g,低于THM-17组(294.20 μg/g)和PRO-MIX5组(134.73 μg/g)。
酸味物质在合成菌群组中的含量为374.99 μg/g,低于PRO-MIX5组(1 515.77 μg/g),但高于THM-17组(193.00 μg/g),这可能是导致PRO-MIX5发酵香肠由于酸味最重获得较低感官评分的原因。自然发酵产品中,醛类(39.71 μg/g)和酮类(0.92 μg/g)物质含量最低,萜烯类和酯类物质的含量虽然不是最高,但其在整体风味物质中的占比高于商业发酵剂组和合成菌群组。这可能是自然发酵产品甜香味和花香味突出,但清新味不如合成菌群组的原因。
3 结 论
本研究在综合考虑菌群优势性、风味产生力和菌种共现性的基础上,确定出自然发酵香肠的核心菌群为葡萄球菌属、乳杆菌属、假单胞菌属和链球菌属,在目前为止发酵香肠中核心菌群的建立中,该方法较为完善。此外,以核心菌群为依据建立的合成菌群在接种发酵香肠的风味改善中应用效果较好,主要表现为:与商业发酵剂THM-17和PRO-MIX5接种发酵香肠相比,合成菌群接种制作的发酵香肠感官评分最高,该产品气味上清新味和甜香味更明显,酸味和金属异味较淡,感官评分较高。具体风味特征为:合成菌群发酵香肠的挥发性风味物质中醛类和芳香烃类物质含量高于商业发酵剂组,酮类物质含量较低,酸类物质含量居中。上述结果可为开发能够最大化满足国人口味且具有自主知识产权的国产化发酵剂提供一定的依据。
参考文献:
[1] COCOLIN L, DOLCI P, RANTSIOU K. Biodiversity and dynamics of meat fermentations: the contribution of molecular methods for a better comprehension of a complex ecosystem[J]. Meat Science, 2011, 89(3): 296-302. DOI:10.1016/j.meatsci.2011.04.011.
[2] FRANCIOSA I, ALESSANDRIA V, DOLCI P, et al. Sausage fermentation and starter cultures in the era of molecular biology methods[J]. International Journal of Food Microbiology, 2018, 279: 26-32. DOI:10.1542/peds.2016-0765.
[3] COCOLIN L, MANZANO M, CANTONI C, et al. Denaturing gradient gel electrophoresis analysis of the 16S rRNA gene V1 region to monitor[J]. Applied and Environmental Microbiology, 2001, 67(11): 5113-5121. DOI:10.1128/AEM.67.11.5113-5121.2001.
[4] MAGISTÀ D, SUSCA A, FERRARA M, et al. Penicillium species: crossroad between quality and safety of cured meat production[J]. Current Opinion in Food Science, 2017, 17: 36-40. DOI:10.1016/j.cofs.2017.09.007.
[5] FRÉDÉRIC L, VUYST L D. Lactic acid bacteria as functional starter cultures for the food fermentation industry[J]. Trends in Food Science and Technology, 2004, 15: 67-78. DOI:10.1016/j.tifs.2003.09.004.
[6] FRÉDÉRIC R, VUYST L D, FRÉDÉRIC L. Bacterial diversity and functionalities in food fermentations[J]. Engineering in Life Sciences, 2012, 12(4): 356-367. DOI:10.1002/elsc.201100119.
[7] 黃俊逸, 王凤娜, 吴香, 等. 复合发酵剂的筛选及其对发酵香肠加工过程中品质的影响[J]. 食品科学, 2020, 41(24): 95-101. DOI:10.7506/spkx1002-6630-20191023-241.
[8] MEJRI L, ZIADI A, EL ADAB S, et al. Effect of commercial starter cultures on physicochemical, microbiological and textural characteristics of a traditional dry fermented sausage reformulated with camel meat and hump fat[J]. Journal of Food Measurement and Characterization, 2017, 11: 758-767. DOI:10.1007/s11694-016-9445-6.
[9] DOMÍNGUEZ R, MUNEKATA P E, AGREGÁN R, et al. Effect of commercial starter cultures on free amino acid, biogenic amine and free fatty acid contents in dry-cured foal sausage[J]. LWT-Food Science and Technology, 2016, 71: 47-53. DOI:10.1016/j.lwt.2016.03.016.
[10] FERROCINO I, BELLIO A, GIORDANO M, et al. Shotgun metagenomics and volatilome profile of the microbiota of fermented sausages[J]. Applied and Environmental Microbiology, 2018, 84(3): e02120-17. DOI:10.1128/AEM.02120-17.
[11] WANG Shilei, WU Qun, NIE Yao, et al. Construction of synthetic microbiota for reproducible flavor metabolism in Chinese light aroma type liquor produced by solid-state fermentation[J]. Applied and Environmental Microbiology, 2019, 85(10): e03090-18. DOI:10.1128/AEM.03090-18.
[12] JIA Yun, NIU Chengtuo, LU Zhenming, et al. A bottom-up approach to develop simplified microbial community model with desired functions: application for efficient fermentation of broad bean paste with low salinity[J]. Applied and Environmental Microbiology, 2020, 86(12): e00306-20. DOI:10.1128/AEM.00306-20.
[13] WOLFE B E, BUTTON J E, SANTARELLI M, et al. Cheese rind communities provide tractable systems for in situ and in vitro studies of microbial diversity[J]. Cell, 2014, 158: 422-433. DOI:10.1016/j.cell.2014.05.041.
[14] WANG Zongmin, LU Zhenming, SHI Jinsong, et al. Exploring flavour-producing core microbiota in multispecies solid-state fermentation of traditional Chinese vinegar[J]. Scientific Reports, 2016, 6: 26818. DOI:10.1038/srep26818.
[15] POLKA, J, REBECCHI A, PISACANE V, et al. Bacterial diversity in typical Italian salami at different ripening stages as revealed by high-throughput sequencing of 16S rRNA amplicons[J]. Food Microbiology, 2015, 46: 342-356. DOI:10.1016/j.fm.2014.08.023.
[16] HU Yingying, ZHANG Lang, LIU Qian, et al. The potential correlation between bacterial diversity and the characteristic volatile flavour of traditional dry sausages from Northeast China[J]. Food Microbiology, 2020, 91: 103505. DOI:10.1016/j.fm.2020.103505.
[17] 李儒仁, 鐘桂霞, 赵拎玉, 等. 市售西班牙自然发酵香肠的食用品质特征分析[J]. 肉类研究, 2020, 34(6): 64-71. DOI:10.7506/rlyj1001-8123-20200220-045.
[18] 江月, 何松贵, 周世水. 异常汉逊酵母和植物乳杆菌菌液浓度与光密度值的关系研究[J]. 安徽农业科学, 2017, 45(19): 99-100. DOI:10.13989/j.cnki.0517-6611.2017.19.033.
[19] 荣良燕, 杨娟春, 赵拎玉, 等. 发酵剂对发酵香肠食用品质的影响及其在不同直径香肠中的应用[J]. 肉类研究, 2020, 34(10): 33-39. DOI:10.7506/rlyj1001-8123-20200810-192.
[20] CORRAL S, SALVADOR A, FLORES M. Salt reduction in slow fermented sausages affects the generation of aroma active compounds[J]. Meat Science, 2013, 93(3): 776-785. DOI:10.1016/j.meatsci.2012.11.040.
[21] NILSEN A, RØDBOTTEN M, PRUSA K, et al. Sensory analyses general considerations[M]. 2nd ed. Oxford: Wiley Blackwell, 2014: 189-194. DOI:10.1002/9781118522653.ch22.
[22] GREPPI A, FERROCINO I, STORIA A L, et al. Monitoring of the microbiota of fermented sausages by culture independent rRNA-based approaches[J]. International Journal of Food Microbiology, 2015, 212: 67-75. DOI:10.1016/j.ijfoodmicro.2015.01.016.
[23] RECKEM E V, GEERAERTS W, CHARMPI C, et al. Exploring the link between the geographical origin of European fermented foods and the diversity of their bacterial communities: the case of fermented meats[J]. Frontiers in Microbiology, 2019, 10: 2302. DOI:10.3389/fmicb.2019.02302.
[24] CARDINALE M, GRUBE M, ERLACHER A, et al. Bacterial networks and co-occurrence relationships in the lettuce root microbiota[J]. Environmental Microbiology, 2015, 17: 239-252. DOI:10.1111/1462-2920.12686.
[25] PARENTE E, COCOLIN L, DE FILIPPIS F, et al. Food microbionet: a database for the visualization and exploration of food bacterial communities based on network analysis[J]. International Journal of Food Microbiology, 2016, 219: 28-37. DOI:10.1016/j.ijfoodmicro.2015.12.001.
[26] YANG J, LESKOVEC J. Overlapping communities explain core-periphery organization of networks[J]. Proceedings of the IEEE, 2014, 102(12): 1892-1902. DOI:10.1109/jproc.2014.2364018.
[27] BARBERAN A, BATES S T, CASAMAYOR E O, et al. Using network analysis to explore co-occurrence patterns in soil microbial communities[J]. The ISME Journal, 2012, 6: 343-351. DOI:10.1038/ismej.2011.119.
[28] DRUMM T D, SPANIER A M. Changes in the content of lipid autoxidation and sulfur-containing compounds in cooked beef during storage[J]. Journal of Agricultural and Food Chemistry, 1991, 39(2): 336-343. DOI:10.1021/JF00002A023.
[29] STAHNKE L H. Dried sausages fermented with Staphylococcus xylosus at different temperatures and with different ingredient levels: Part II. Volatile components[J]. Meat Science, 1995, 41(2): 193-209. DOI:10.1016/0309-1740(94)00069-J.
[30] FLORES M, OLIVARES A. Flavor[M]//TOLDRÁ F. Handbook of fermented meat and poultry. Oxford: Blackwell, 2014: 217-226. DOI:10.1002/9780470376430.

