铵态氮素促进甘薯块根形成的解剖特征及其IbEXP1基因的表达
王翠娟 柴沙沙 史春余 朱 红 谭中鹏 季 杰 任国博
1 山东省烟台市农业科学研究院, 山东烟台 265500; 2 湖北省农业科学院粮食作物研究所 / 湖北省甘薯工程技术研究中心 / 粮食作物种质创新与遗传改良湖北省重点实验室, 湖北武汉 430064; 3 山东农业大学农学院 / 作物生物学国家重点实验室, 山东泰安271018; 4 山东农业大学植物保护学院, 山东泰安 271018; 5 鲁西化工有限公司, 山东聊城 252000
适宜块根库器官的建成对于最终甘薯块根的高产优质具有重要的意义[1]。已有研究表明, 甘薯生长前期是块根分化建成的关键时期, 其茎叶封垄时形成的单株薯块数目性状的表现与最终块根产量的形成密切相关[2-4], 而块根的分化建成因品种特性、栽培环境的不同, 单株有效薯块数目会有显著的差异。在甘薯生长前期, 根系统的构建和组成中不定根向块根的变态分化, 是一系列基因分子表达和生理生化代谢协同作用的结果[2]。因此, 探索甘薯块根形成的调控措施, 研究块根分化建成解剖特征、分子或生理生化差异机制, 对甘薯高产优质具有重要的实践价值和理论意义。
现有研究表明, 氮素作为甘薯前期生长的主要营养因素, 对块根的形成具有重要的调控作用[5-7]。氮素亏缺甘薯根系细而少[8], 氮素过量会抑制不定根形成层活动, 使中柱细胞过度木质化[9-11], 均不利于甘薯块根的形成[12-13]。在甘薯对不同形态氮素吸收与利用的研究中发现, 铵态氮素的施用利于甘薯生长前期根系的生长, 促进单株有效薯块数目和最终块根产量的形成[14]。同时, 其他作物的研究表明, 铵态氮素会改变根系解剖结构发育[15], 促进根系侧根分枝的形成[16], 加快根生长发育进程[17]。而目前关于铵态氮素对甘薯块根形成的影响尚缺乏系统全面的研究。基于以上认识, 本研究利用单株结薯数差异显著的 2个甘薯品种商薯19和济徐23为材料, 设置60 kg hm–2低氮和180 kg hm–2高氮2个氮素水平, 酰胺态和铵态2种氮素形态, 进行甘薯封垄期、收获期块根产量及产量构成因素的调查验证, 采用盆栽试验辅助了解其块根分化建成在显微细胞水平的发生过程, 并对影响甘薯块根分化发育的IbEXP1基因在关键发育时期的表达进行分析, 从解剖和分子水平深入认识铵态氮素处理促甘薯块根形成的机制, 旨在为大田生产中通过适量铵态氮肥促块根形成提供理论依据。
1 材料与方法
1.1 试验材料与设计
试验于2014—2015年在山东农业大学农学实验站(山东泰安)进行。供试品种为单株结薯数差异显著的淀粉型甘薯品种商薯19 (S19)和济徐23 (J23), 其中, 商薯19薯块多而匀, 结薯数一般是5~6个, 而济徐 23大中薯率较高, 结薯数一般是3~4个。供试土壤质地为沙壤土。2014年0~20 cm土层土壤含有机质 1.44%、碱解氮 67.65 mg kg–1、速效磷 16.00 mg kg–1和速效钾77.80 mg kg–1; 2015年0~20 cm土层土壤有机质含量为1.69%、碱解氮含量为73.67 mg kg–1、速效磷含量为18.83 mg kg–1、速效钾含量为76.56 mg kg–1。
本试验包括大田试验和盆栽辅助试验两部分。大田试验采用三因素裂区设计, 品种为主区, 以甘薯品种 S19和 J23为供试材料; 氮素水平为裂区,设纯氮 60 kg hm–2低氮(LN60)和 180 kg hm–2高氮(HN180) 2个水平; 氮素形态为裂裂区, 设铵态氮素硫酸铵(AN)和酰胺态氮素尿素(XN) 2个水平,以不施氮(N0)为对照。共 10个处理, 基施且均配以24 g m-2的钾肥(K2O), 其中所有酰胺态氮素处理基施以相同氮素水平下铵态氮素处理同等水平的纯硫(升华硫), 进行土壤施用硫素的平衡。
其中, 大田试验分别于2014年5月15日栽植、10月22日收获和2015年5月12日栽植、10月24日收获。小区面积16 m2, 行距0.8 m, 株距0.25 m,栽植密度为5株 m–2, 基施钾肥(K2O) 24 g m–2, 以甘薯品种作为处理水平, 4次重复, 随机排列; 盆栽试验于 2015年进行, 栽植时间与 2015年大田试验一致, 选用高 0.25 m, 上下内径分别是 0.23 m 和0.20 m的硬塑料盆, 取大田耕层土壤, 每盆装土10 kg,栽植秧苗1株, 每个处理各栽20盆, 其余处理与大田试验一致。
1.2 取样方法
大田试验中设置专门取样区, 分别于茎叶封垄期(大约秧苗栽后45 d)和收获期(大约秧苗栽后165 d)取样。其中, 茎叶封垄期从每个处理选择长势一致的代表性植株5株, 将所有根径≥0.5 cm的根系挖出, 计算单株形成的薯块数和平均单薯鲜重, 并参照Tanaka等[18]和Noh等[19]的标准, 按照根径范围进行形成薯块组成的分类, 其中介于 0.5~1.0 cm的幼根列为幼龄薯块(young storage root, YSR), 根径介于1.0~5.0 cm并形成局部膨大的块根列为发育薯块(developping storage root, DSR), 根径大于5.0 cm的块根列为成熟薯块(mature storage root, MSR); 而收获期将每个试验小区根径大于1 cm并形成局部膨大的薯块纳入计数和称取鲜重的范围, 调查小区的株数、有效薯块数目和薯块鲜重产量, 并计算单株有效薯块数和平均单薯鲜重。
2015年盆栽试验为研究甘薯块根分化建成的辅助试验。以甘薯块根形成过程中内部形成层的活动为依据, 在幼根向块根分化前的前形成层期、分化的初生形成层活动时期和建成的次生形成层活动时期这 3个主要变化的关键节点取样, 大约为秧苗栽后7、14和21 d, 进行块根分化过程的解剖学观察;同时对块根分化关键时间点(初生形成层活动期)和建成关键时间点(次生形成层活动初期)的取样发育根进行IbEXP1基因表达的检测试验。其中, 在根系解剖学观察试验的根系取样中, 须将整株根系挖出、冲根, 每株选取着生的最粗不定根3条(最具分化潜力的不定根), 距其着生端5~10 cm处截取最粗部位1 cm左右长度, 先于FAA固定液(其中的酒精浓度为50%)中进行杀死固定, 固定6~8 h之后, 60%乙醇过渡0.5 h, 最后浸泡于70%酒精, 4℃冰箱保存;而基因表达试验的根取样, 将最粗 3条不定根膨大部位及其以上部切段(切段长度≈1 cm), 然后切片并各自混匀, 液氮速冻, -80℃保存。
1.3 测定项目与方法
1.3.1 根系解剖学观察 采用石蜡切片法, 参照叶宝兴等[20]方法, 并分别利用番红-固绿、间苯三酚和高碘酸席夫试剂染色。番红-固绿染色切片用以观察初生形成层的发育和薄壁组织细胞的活动; 根据间苯三酚切片颜色反应的深浅, 观察幼根内中柱细胞和导管的木质化程度; 高碘酸希夫染色切片, 观察淀粉粒分布。用 OLYMPUS BX51型光学显微镜观察根系结构并拍照, 采用IMAGE-Pro PLUS v 6.0图片处理软件和人工计数测量量化指标。
1.3.2 实时荧光定量(Real-time quantitative PCR)基因检测 参照刘德高[21]方法, 采用异硫氰酸胍提取液结合10% (w/v) KOAc和1% (w/v) CTAB沉淀多糖的方法提取甘薯根组织总RNA[22], 用First Strand cDNA Synthesis Kit (Thermo Scientific, Germany)合成cDNA第1链。通过NCBI网(http://www.ncbi.nlm.nih.gov/pubmed)得到IbEXP1基因序列, 利用Primer Premier 5设计基因 3'和 5'端特异性引物(IbEXP1-F:5′-CGGAATTCATCAAACACCI-3′和IbEXP1-R:5′-TGTCTCCACACTCAGC-3′), 引物和相关基因的实时荧光定量检测委托华大基因公司完成。
实时荧光定量 PCR检测的荧光染料为 SYBR Green (厦门致善生物科技有限公司), PCR热循环仪是Bio-Rad CFX 384, 所用操作软件为Bio-Rad CFX Manager, 使用两步法进行 PCR扩增, 程序设置为95℃ 10 min; 95℃ 15 s, 60℃ 1 min, 35~40 个循环。使用融解曲线分析检测扩增产物的特异性, 反应程序为 95℃ 15 s, 60℃ 1 min, 95℃ 15 s, 60℃ 15 s。以甘薯肌动蛋白基因β-Actin作为内参基因(GenBank登录号为AY905538), 对不同样品的基因表达量进行均一化评估叶[22]。每个反应设3次重复,采用2−ΔΔCt分析法测定基因的相对表达水平。
1.4 数据分析
采用Microsoft Excel 2013软件计算数据, SigmaPlot 10.0软件制图, SAS 9.2软件分析数据, 三因素随机区组法分析收获期块根产量的方差、三因素完全随机法分析其他项目方差, 利用 Duncan’s新复极差法检验进行处理间的差异显著性分析。
2 结果与分析
2.1 收获期块根产量及产量性状
2014年和 2015年大田收获的块根产量及产量性状具有相似的处理效应, 因此将 2年的数据平均进行结果分析。由表 1可以看出, 在相同的处理条件下, 甘薯品种商薯 19 (S19)的单株有效薯块数目和块根产量均高于甘薯品种济徐23 (J23), 其中对照处理(N0)条件下的增幅分别为62.83%和12.54%。同时, 2个甘薯品种均表现为低水平铵态氮素处理(AN60)的单株有效薯块数目和块根产量最高, 且差异显著。高水平铵态氮素处理和酰胺态氮素处理不利于 2个甘薯品种单株有效薯块数目的形成, 降低收获期块根产量。
由表2可以看出, 高低2个氮素水平和2种氮素形态对最终收获的块根产量和单株有效薯块数目均有显著影响, 且氮素水平和氮素形态 2种处理间的交互效应显著。
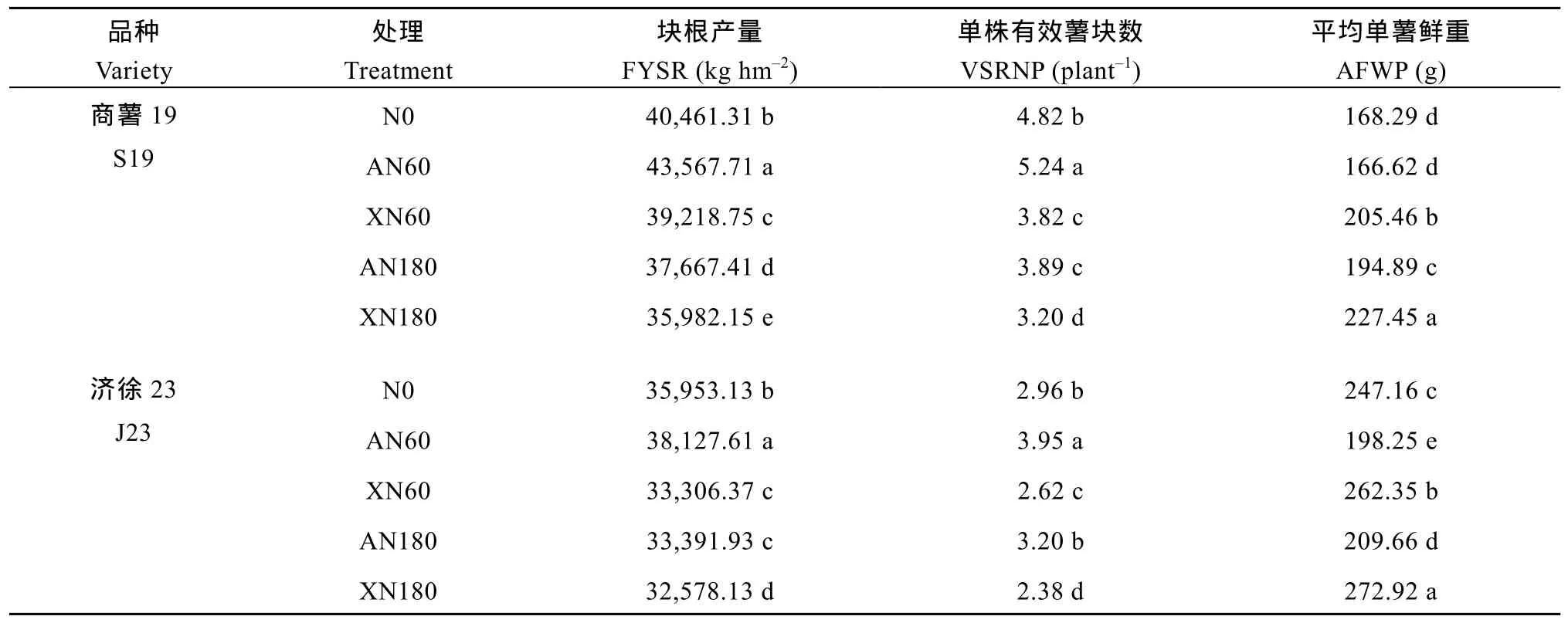
表1 块根产量及产量性状(大田, 2014–2015)Table 1 Fresh yield of storage root and yield traits in field trials at harvest time (in the field, from 2014 to 2015)
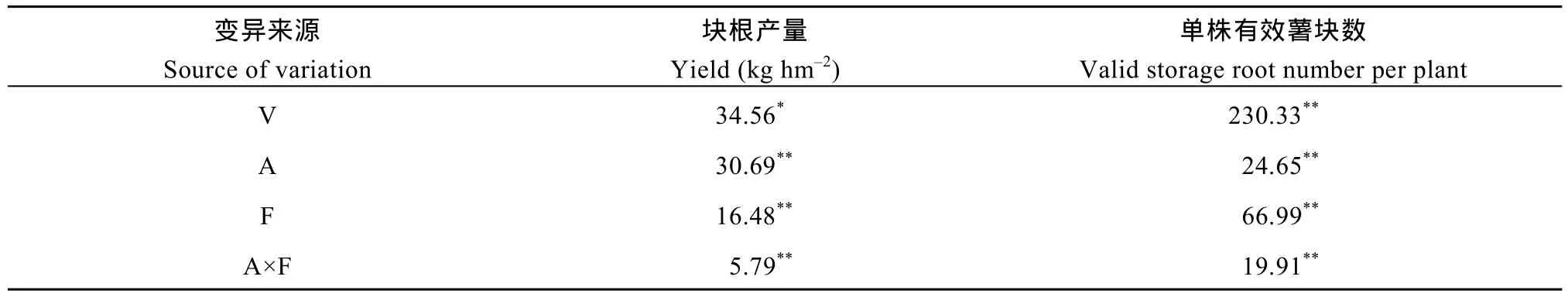
表2 氮素形态和氮素用量对收获期块根产量与单株有效薯块数目性状影响的方差分析(F值, 2014–2015)Table 2 Partial correlated coefficients among yield traits in field trials at harvest time (F-value, 2014–2015)
2.2 茎叶封垄期的结薯特性
将2014年和2015年封垄期调查数据平均化进行结果分析发现, 氮素水平和氮素形态对 2个甘薯品种封垄期形成的薯块数目均有显著影响(表3)。在相同的处理条件下, 商薯19形成的单株薯块数目高于济徐23, 而其单株薯块鲜重要低于济徐23。其中对照(N0)处理条件下的结薯数较高的商薯19形成的单株薯块数目显著高于甘薯品种 J23, 其根径介于0.5~1.0 cm的幼龄薯块(YSR)和1.0~5.0 cm的发育薯块(DSR)均高于甘薯品种J23, 而济徐23形成了更多根径大于5 cm的成熟薯块(MSR)。同时, 相较于不施氮对照, 低水平铵态氮素处理(AN60)形成的薯块数目最高, 其余氮素处理显著降低或相似。其中商薯19氮素形态效应更加显著, 铵态氮素处理形成的单株薯块数目均高于酰胺态氮素, 2个甘薯品种的低水平氮素处理的单株薯块数目均高于高水平氮素处理。其中, 在低水平铵态氮素处理(AN60)的单株薯块组成中, 根径介于0.5~1.0 cm和1.0~5.0 cm的薯块数目均最高, 且差异显著。说明该处理单株薯块数目的优势是因为其提高了根径介于0.5~5.0 cm薯块的形成。

表3 封垄期单株薯块鲜重、单株薯块数目及其组成(2014–2015)Table 3 Valid storage roots number, valid storage root fresh weight per plant and its compositional features during the canopy closure period in pot trials from 2014 to 2015
2.3 块根形成过程幼根的解剖学观察
2.3.1 前形成层期(秧苗栽后7 d)幼根内部结构
图1和图2为前形成层期2个甘薯品种各处理最粗3条幼根相同切片的番红-固绿、间苯三酚和高碘酸席夫染色横截面, 分别用以观察初生形成层的发育和薄壁组织细胞的活动, 中柱细胞、导管的木质化程度, 淀粉粒分布等。此时期各处理幼根解剖结构与一般双子叶植物幼根相似, 结合其部分量化指标(表4)可以看出, 低水平氮素处理不同程度的提高了2个甘薯品种幼根直径、中柱直径和中柱占根横截面比例。其中, 低水平铵态氮素处理(AN60)幼根原生木质部束的导管数目及中柱薄壁组织木质化薄壁细胞数目显著高于不施氮对照(N0)和其余氮素处理。
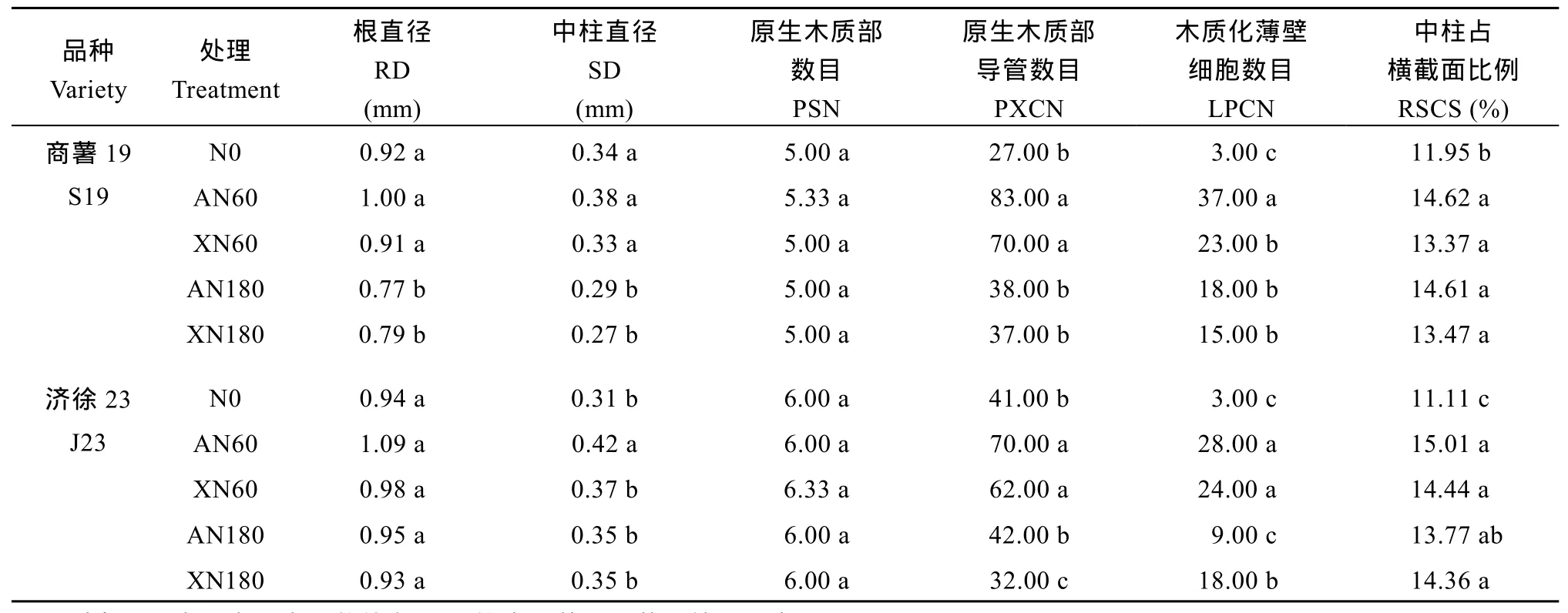
表4 秧苗栽后7 d幼根根内部结构部分量化指标(2015)Table 4 Quantitative indices of young root internal structure in different treatments on the seventh day after planting in 2015
2.3.2 初生形成层活动期(秧苗栽后 14 d)幼根内部结构 与前形成层期相比, 图3和图4中各处理幼根的初生形成层开始向外扩展, 原生木质部导管因形成层薄壁组织的活动开始分离, 与形成层分裂分化的薄壁细胞构成次生木质部。结合其内部初生结构的部分量化指标(表 5)发现, 低水平铵态氮素处理(AN60) 2个甘薯品种的幼根直径、中柱直径和中柱占根横截面比例不同程度的高于不施氮对照(N0)和其余氮素处理。通过间苯三酚和番红固绿2种不同染色切片对比观察, 与不施氮对照(N0)相比较, 氮素处理不同程度的提高了 2个甘薯品种的次生木质部束数目和薄壁组织木质化的薄壁细胞数目, 且木质化薄壁细胞数目的氮素水平效应显著, 高水平氮素处理显著的高于低水平氮素处理。其中, 低水平铵态氮素处理(AN60)的次生木质部束最多, 而木质部间薄壁组织的木质化薄壁细胞数目介于不施氮对照(N0)和其余氮素处理间。说明该处理幼根的初生形成层活动力强,中柱薄壁细胞木质化适度。此外, 高碘酸希夫染色切片图中该时期各处理均开始有少量淀粉粒产生于初生形成层外侧的薄壁细胞中, 但未见处理间差异。
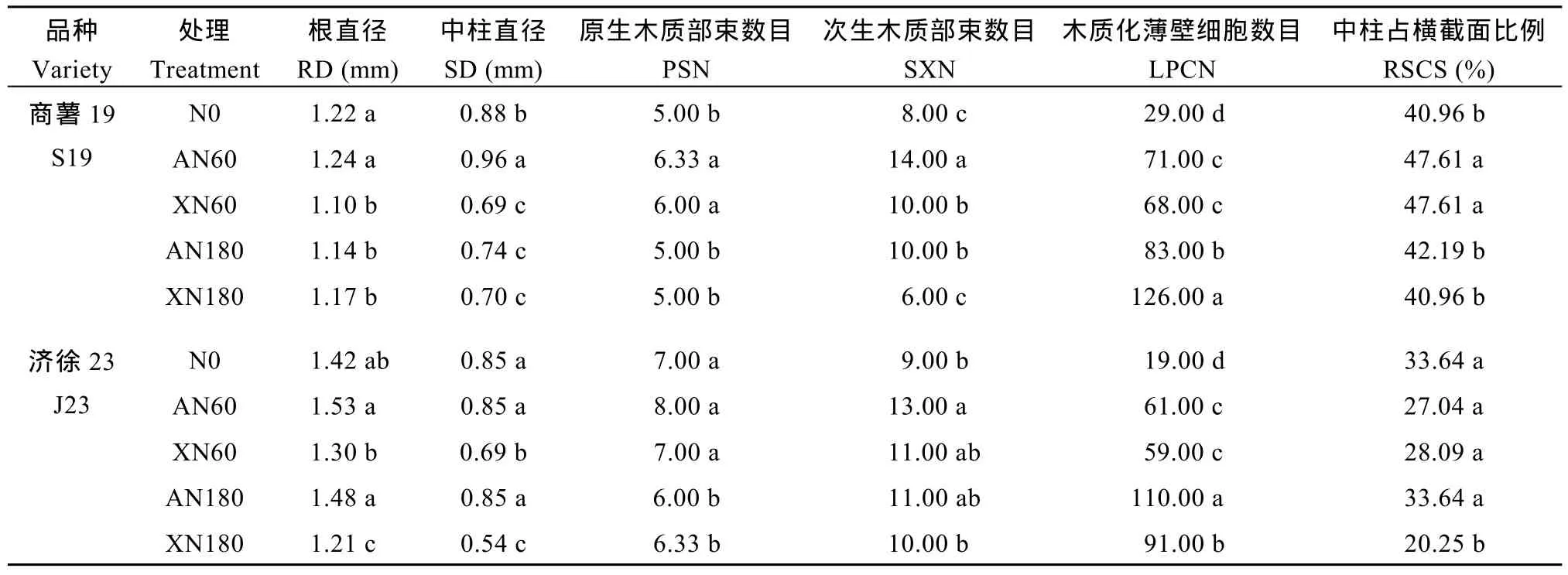
表5 秧苗栽植后14 d幼根根内部结构部分量化指标Table 5 Quantitative indices of young root internal structure in different treatments on the 14th day after planting
2.3.3 次生形成层活动初期(秧苗栽后 21 d)分化根的内部结构 图5和图6为秧苗栽后21 d时2个甘薯品种各处理最粗根膨大部位的 3种染色切片的横截面图, 相较于初生形成层活动时期, 各处理幼根进一步发育, 初生形成层分裂的薄壁细胞数目越来越多, 中柱扩大。同时, 其中的原生木质部、后生木质部和次生木质部, 因薄壁组织细胞的活动而星散在中柱的薄壁组织间, 与以木质部的导管群或单个导管为中心的周围薄壁组织形成次生维管束, 开始次生形成层的活动。结合表 6发现, 在次生形成层活动初期(秧苗栽后 21 d), 低水平铵态氮素处理(AN60) 2个甘薯品种的幼根直径、中柱直径和中柱占根横截面比例均高于其余处理, 差异显著。在番红固绿和间苯三酚2种染色切面结构的比较中发现, 与初生形成层活动时期的表现规律相似: 与不施氮对照处理(N0)相比较, 各氮素处理不同程度的提高了2个甘薯品种的次生维管束数目和木质化薄壁细胞数目, 其中低水平铵态氮素处理(AN60)的次生维管束数目显著高于其余处理, 且在中柱的分布也更为分散。说明该处理在初生形成层活动期形成较多的次生木质部及其周围的薄壁组织, 利于此时期次生形成层维管束的形成和次生形成层的发生活动, 促进块根建成。此外, 淀粉粒在初生形成层外侧的皮层薄壁细胞中大量积累贮藏, 但高碘酸希夫染色切片图未见各处理间差异。
2.4 块根分化建成中IbEXP1基因的表达分析
由图7可知, 2个甘薯品种IbEXP1基因在块根形成过程的表达具有较为相似的变化规律。在初生形成层活动期(秧苗栽后14 d), 商薯19各氮素处理相对于不施氮对照(N0)根系IbEXP1基因的表达上调, 其中低水平铵态氮素处理(AN60)的IbEXP1基因上调表达幅度最高, 高达75; 而济徐23低水平铵态氮素处理(AN60)的IbEXP1基因显著上调。次生形成层活动初期(秧苗栽后 21 d), 相较于不施氮对照, 氮素处理不同程度的提高了 2个品种甘薯幼根中IbEXP1基因的表达, 氮素水平处理效应显著, 高水平氮素处理IbEXP1基因的表达要高于低水平氮素处理; 同时不同形态氮素处理间也有差异, 酰胺态氮素处理IbEXP1基因的表达要高于铵态氮素处理。其中, 低水平铵态氮素处理(AN60)IbEXP1基因的表达高于不施氮对照处理(N0), 但低于其余氮素处理。
3 讨论
3.1 封垄期结薯特性及收获期块根产量
一般在甘薯茎叶封垄期, 单株有效薯块数就基本稳定[11,23], 且此时单株有效薯块数目性状的表现对于最终块根产量的形成具有重要意义[2-4,24]。本研究试验2014年和2015年茎叶封垄期对照(N0)处理条件下, 2个甘薯品种结薯特性单株有效薯块的组成中, 商薯 19侧重于有效块根的分化(形成更多根径介于0.5~1.0 cm和 1.0~5.0 cm的薯块), 而济徐23侧重于块根的膨大发育(形成了更多根径大于 5 cm的薯块), 且收获期单株有效结薯数较高的商薯 19的块根产量显著的高于济徐 23, 说明在生长前期甘薯块根的分化建成相对于块根的膨大生长对最终块根产量的形成具有更为重要的意义。同时, 在 2014年和 2015年茎叶封垄期不同氮素处理结薯特性的比较中发现, 与其余处理相比较, 60 kg hm–2铵态氮素处理2个品种甘薯植株均提高根径介于0.5~1.0 cm和1.0~5.0 cm的薯块数目, 因此显著地提高其单株有效薯块数目, 并最终实现了 2年收获期显著最高的块根产量。说明60 kg hm–2铵态氮素处理通过促进生长前期单株有效薯块的分化建成, 实现了最终块根产量的提高。
3.2 铵态氮素促进甘薯块根形成的解剖特征及与IbEXP1基因表达的关系
甘薯块根的分化建成主要由不定根初生形成层和次生形成层的活动共同决定着: 不定根初生形成层活动能力强、中柱薄壁细胞木质化程度低, 利于不定根幼根向块根的分化发育[8,11]; 次生形成层活动能力强, 活动范围广, 促进块根形态的建成[9-10,23-25]。近些年研究发现, 对植物细胞生长分化有显著调控作用的扩展蛋白基因IbEXP1, 可以作用于甘薯幼根形成层细胞的分裂活动和中柱组织细胞的木质化以调控甘薯块根的分化建成[26-29], 与块根形成密切相关。本试验对幼根向块根分化建成的 3个主要变化的关键时间节点进行取样, 观察不同处理幼根在显微细胞水平的生长发育特点。在本研究试验对照(N0)处理条件下, 2个结薯特性不同甘薯品种的幼根在向块根分化建成中, 单株有效结薯数较高的商薯19的优势根(取样时期最粗壮的幼根)发育根径和中柱直径均小于济徐 23根径, 其中商薯 19各取样时间点根显微结构中的原生木质部数目、原生木质部导管数目、次生木质部束数目和次生维管束数目均不同程度的少于济徐 23。说明同发育时期济徐 23比商薯19更加的侧重于幼根的膨大生长。同时在不同氮素处理的比较中, 60 kg hm–2铵态氮素处理2个品种甘薯的幼根在向块根分化建成中的幼根直径、中柱直径和维管组织结构(原生木质部束导管、次生木质部束和次生维管束)均具有显著的发育优势。说明该处理幼根的初生生长和早期次生生长活动能力强,分裂分化了更多的薄壁细胞和维管组织, 既扩大了根径, 同时为幼根后续生长发育提供营养贮藏的空间和更多水养吸收、输送的可能性, 促进块根形成。

表6 秧苗栽植后21 d分化根根内部结构部分量化指标(2015)Table 6 Quantitative indices of young root internal structure in different treatments on the 21th day after planting in 2015
同时, 我们发现在块根分化和建成这 2个关键时间节点IbEXP1基因的表达分析中, 各处理幼根IbEXP1基因的表达与幼根薄壁组织细胞的木质化程度、木质部导管数目具有相同的变化规律。与不施氮处理相比较, 氮素处理可以提高甘薯幼根IbEXP1基因的表达, 并显著提高甘薯幼根薄壁组织细胞的木质化程度和木质部导管数目。其中, 60 kg hm–2铵态氮素处理 2个品种甘薯幼根在块根分化的初生形成层活动时期(秧苗栽后14 d)IbEXP1基因高水平表达, 其次生木质部束最多; 而在块根建成的次生形成层活动初期(秧苗栽后 21 d), 与其余氮素处理相比较,IbEXP1基因的表达相对下调, 其IbEXP1基因的相对表达量和中柱木质化薄壁细胞数目均介于不施氮对照(N0)和其余氮素处理之间。结合前人在实验室离体培养IbEXP1基因反义植株幼根的中央木质部木质化程度低[30-32]的研究结果,我们推测认为, 本研究块根分化建成中, 氮素处理促进幼根IbEXP1基因的相对表达, 不仅提高中柱组织细胞的木质化程度, 也作用于中柱维管组织的木质部导管的形成。但本试验条件下幼根IbEXP1基因表达和形成层细胞活动规律, 与 Noh等[30-31]的研究结果不尽相同, 分析考虑归因于本试验大田开放环境和前人实验室离体培养2种不同培养条件下幼根生长发育进程的差异性。其中, 前人测定IbEXP1基因表达, 取样于实验室离体培养10 d和21 d时的反义植株幼根, 根径均小于 10 mm, 且未发生局部膨大变化[31], 而本试验大田盆栽秧苗栽后14 d和21 d的取样幼根开始加粗,IbEXP1基因表达的测定取样于幼根的局部膨大部位(根径大于10 mm)。我们认为本试验条件下对幼根IbEXP1基因表达与块根分化建成关系的讨论具有更好的参考性。
4 结论
在本试验条件下, 单株有效结薯数较高的商薯19的块根产量显著的高于济徐23, 在生长前期甘薯块根的分化建成相较于块根的膨大生长更利于最终块根产量的形成。其中, 60 kg hm–2铵态氮素处理2个品种甘薯幼根建立了更利于不定根幼根向块根形成的根组织结构分化发育基础。前形成层时期原生木质部束的导管数目及中柱薄壁组织木质化薄壁细胞数目最多; 初生形成层发育时期IbEXP1基因高水平表达, 幼根直径、中柱直径大, 原生、次生木质部束数目多; 次生形成层活动初期IbEXP1基因的相对表达和中柱薄壁细胞的木质化程度介于不施氮和高氮素处理之间, 但幼根直径、中柱直径和中柱占横截面比均显著最高, 在块根分化建成中建立了薄壁组织细胞木质化活动和分裂活动的平衡。该处理在茎叶封垄期形成更多根径介于0.5~5.0 cm的低龄薯块, 以此显著提高单株有效薯块数目, 且2014—2015年收获期块根产量最高。

