木犀草素调控Nrf2/HO-1通路保护视网膜色素上皮细胞氧化损伤
洪 萌,洪道先,石荣先,魏 聪,赵晓丽,李权达
•KEYWORDS: luteolin; retinal pigment epithelium; oxidative damage; nuclear factor erythroid 2-related factor 2; heme oxygenase-1
0引言
年龄相关性黄斑变性(age-related macular degeneration,ARMD)是一种累及黄斑部的不可逆退行性病变,是老年人视力损伤的主要病因之一[1]。随着我国人口老龄化的进展,ARMD的发病人群逐年增多[2]。ARMD的具体病因及发病机制尚不明确,但越来越多的研究表明视网膜色素上皮(retinal pigment epithelium,RPE)细胞的氧化应激损伤与ARMD的发生、发展密切相关[3-4]。因此,保护RPE细胞免受氧化应激损伤是防治ARMD的重要途径。已知E2相关因子2(nuclear factor erythroid 2-related factor 2,Nrf2)/血红素加氧酶-1(heme oxygenase-1,HO-1)是机体内源性抗过氧化物的重要蛋白,被激活后可抑制过氧化物诱导细胞损伤[5]。因此调控Nrf2通路对于ARMD的防治具有潜在价值。木犀草素是一种天然的黄酮类化合物,广泛存在于金银花等多种药用植物中,具有抗炎、抗氧化及抗病毒等多种药理学作用[6]。目前研究表明木犀草素对RPE细胞及视网膜损伤具有保护作用[7-8],但其是否能够增强RPE细胞的抗氧化活性及其抗氧化机制尚不清楚。因此,本研究采用H2O2损伤RPE细胞建立体外氧化应激损伤模型,观察木犀草素对RPE细胞氧化损伤的保护作用,并探讨其作用机制。
1材料和方法
1.1材料人RPE细胞株ARPE-19(美国ATCC公司);木犀草素(南京景竹生物科技有限公司);DMEM/F12培养液、胎牛血清、胰蛋白酶(美国Gibco公司);Nrf2抑制剂全反式维甲酸、四甲基偶氮唑盐(methyl thiazolyl tetrazolium,MTT)和H2O2等(美国Sigma公司);丙二醛(malondialdehyde,MDA)、超氧化物歧化酶(superoxide dismutase,SOD)试剂盒及酶联免疫吸附测定(enzyme linked immunosorbent assay,ELISA)试剂盒等(北京索莱宝科技有限公司),Caspase-3单克隆抗体、多聚腺苷酸二磷酸核糖聚合酶(poly adeno-sine diphosphate ribose polymerase,PARP)单克隆抗体、B细胞淋巴瘤-2(B cell lymphoma-2,Bcl-2)单克隆抗体、Nrf2单克隆抗体、HO-1单克隆抗体及辣根过氧化物酶标记的IgG二抗(英国,Abcam)。主要仪器设备:台式离心机(Thermo Fisher Micro21R,美国),流式细胞仪(BD FACSCalibur,美国BD),酶标仪(HBS-1096C,南京德铁实验设备有限公司)。
1.2方法
1.2.1细胞培养ARPE-19细胞复苏后接种于DMEM/F12培养基(含10%胎牛血清、100U/mL青霉素和100mg/mL链霉素)中,于37℃,5% CO2的培养箱中培养,待细胞生长融合至80%时,用0.25%胰蛋白酶进行消化并传代,选取对数生长期的细胞进行后续实验。
1.2.2分组及给药将ARPE-19细胞分为对照组、H2O2组、不同剂量木犀草素组和Nrf2抑制剂组。对照组:不做任何处理;H2O2组:培养基中加入100μmol/L H2O2培养24h;不同剂量木犀草素组:培养基中分别加入25、50μmol/L木犀草素预处理2h后加入100μmol/L H2O2培养24h;Nrf2抑制剂组:培养基中加入木犀草素50μmol/L+10μg/mL全反式维甲酸预处理2h,然后加入100μmol/L H2O2培养24h。显微镜下观察各组细胞形态变化。
1.2.3 MTT法检测细胞活力取对数期生长的ARPE-19细胞,以1×105个/毫升接种于96孔板中,细胞贴壁后用不同浓度(0、25、50、100μmol/L)的木犀草素培养基培养或按照1.2.2的分组及给药方式培养24h后,更换培养基,每孔加入20μL MTT(5mg/mL),培养4h后弃培养基,每孔加入200μL二甲基亚砜(DMSO)溶液,震荡10min后,采用酶标仪测定波长490nm处的光密度(A)值。细胞活力(%)=实验组A值/对照组A值×100%。
1.2.4细胞凋亡的检测取对数期生长的ARPE-19细胞,以1×106个/毫升接种于96孔板中,按照1.2.2的分组及给药方式培养后,离心收集细胞。加入195μL结合液重悬细胞,然后加入5μL Annexin V-FITC混匀,室温避光孵育10min;离心弃上清,加入190μL结合液重悬细胞,然后加入10μL PI染液混匀,4℃避光孵育10min。流式细胞仪检测细胞凋亡情况。
1.2.5细胞内氧化应激水平的测定
1.2.5.1细胞内ROS水平测定取对数期生长的ARPE-19细胞,以1×106个/毫升接种于96孔板中,按照1.2.2的分组及给药方式培养后,胰蛋白酶消化,PBS洗涤后加入荧光探针DCFH-DA,37℃避光孵育30min,使探针与细胞充分接触,消化后离心收集细胞,用流式细胞仪(激发波长488nm,发射波长525nm)检测细胞内的平均荧光强度,即ROS水平。
1.2.5.2细胞内MDA和SOD含量的测定收集各组细胞,超声波破碎,离心取上清。采用硫代巴比妥酸比色法测定MDA含量,黄嘌呤氧化酶法测定SOD活性,实验步骤严格按照试剂盒说明方法进行。
1.2.6 Western blot检测蛋白表达收集各组细胞,分别加入适量的蛋白裂解液(含PMSF),冰上裂解30min,4℃离心15min,提取细胞总蛋白,并采用BCA法测定蛋白浓度。取40μg蛋白样品进行SDS-PAGE电泳,将蛋白转移至PVDF膜上,5%脱脂奶粉封闭过夜,分别加入Caspase-3、PARP、Bcl-2、Nrf2、HO-1、β-actin一抗(稀释比例均为1∶1000),4℃孵育过夜。加二抗(稀释比例为1∶2000),室温孵育1h。电化学发光显影后,采用Image J凝胶图像分析系统计算目的条带与内参条带灰度值的比值,即目的蛋白的相对表达量。

表1 各组细胞ROS、MDA及SOD水平比较

2结果
2.1木犀草素对ARPE-19细胞活力的影响采用MTT法检测木犀草素对ARPE-19细胞活力的影响,结果显示,各组细胞活力差异有统计学意义(F=4.351,P=0.008),见图1。组间两两比较发现,100μmol/L木犀草素组细胞活力明显低于对照组(P<0.05),其余各组间差异无统计学意义(P>0.05),说明100μmol/L木犀草素能抑制ARPE-19细胞活性。因此选择25、50μmol/L木犀草素进行后续研究。
2.2木犀草素对H2O2诱导的ARPE-19细胞活力的影响各组细胞增殖活力比较差异有统计学意义(F=217.539,P<0.01),见图2。组间两两比较发现,H2O2组细胞活力明显低于对照组(P<0.05);25μmol/L和50μmol/L木犀草素组细胞活力明显高于H2O2组(P<0.05),且50μmol/L木犀草素组变化更明显(P<0.05);而Nrf2抑制剂组细胞活力明显低于50μmol/L木犀草素组(P<0.05)。
2.3木犀草素对H2O2诱导的ARPE-19细胞形态学的影响对照组ARPE-19细胞呈梭形贴壁生长,细胞轮廓清晰;H2O2组细胞皱缩、变小、变圆,失去正常形态,部分细胞不能贴壁生长;25μmol/L和50μmol/L木犀草素组细胞形态得到改善,50μmol/L木犀草素组较25μmol/L组更为明显。Nrf2抑制剂组部分细胞形态异常,与25μmol/L木犀草素组细胞类似(图3)。
2.4木犀草素对H2O2诱导的ARPE-19细胞凋亡的影响流式细胞仪检测结果见图4A,各组细胞调亡率比较,差异有统计学意义(F=139.473,P<0.01)。组间两两比较发现,H2O2组细胞凋亡率明显高于对照组(P<0.05);25μmol/L和50μmol/L木犀草素组细胞凋亡率明显低于H2O2组(P<0.05),且50μmol/L木犀草素组变化更明显(P<0.05);而Nrf2抑制剂组细胞凋亡率明显高于50μmol/L木犀草素组(P<0.05)。
Western blot分析结果见图4B,各组细胞Caspase-3、PARP及Bcl-2蛋白表达水平比较,差异均有统计学意义(F=217.776、172.167、190.00,均P<0.01)。组间两两比较发现,H2O2组细胞Caspase-3和PARP的蛋白表达水平明显高于对照组(P<0.05),Bcl-2水平明显低于对照组(P<0.05);25μmol/L和50μmol/L木犀草素组细胞Caspase-3和PARP的蛋白表达水平明显低于H2O2组(P<0.05),Bcl-2水平明显高于H2O2组(P<0.05),且50μmol/L木犀草素组变化更明显(P<0.05);Nrf2抑制剂组细胞Caspase-3和PARP的蛋白表达水平明显高于50μmol/L木犀草素组(P<0.05),Bcl-2水平明显低于50μmol/L木犀草素组(P<0.05)。

图1 木犀草素对ARPE-19细胞活力的影响 aP<0.05 vs 对照组。

图2 木犀草素对H2O2诱导的ARPE-19细胞活力的影响
2.5木犀草素对H2O2诱导的ARPE-19细胞氧化应激水平的影响各组细胞ROS、MDA和SOD水平比较,差异均有统计学意义(F=150.065、192.916、98.318,均P<0.01),见表1。组间两两比较发现,H2O2组细胞ROS和MDA含量明显高于对照组,SOD活性明显低于对照组(P<0.05);25μmol/L和50μmol/L木犀草素组细胞ROS和MDA含量明显低于H2O2组,SOD活性明显高于H2O2组,且50μmol/L木犀草素组变化更明显(P<0.05);Nrf2抑制剂组细胞ROS和MDA含量明显高于50μmol/L木犀草素组(P<0.05),SOD活性明显低于50μmol/L木犀草素组(P<0.05)。

图3 木犀草素对H2O2诱导的ARPE-19细胞形态学的影响(×100) A:对照组;B:H2O2组;C:25μmol/L木犀草素组;D:50μmol/L木犀草素组;E:Nrf2抑制剂组。
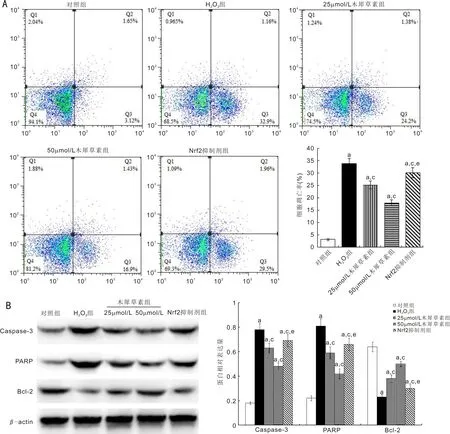
图4 木犀草素对H2O2诱导的ARPE-19细胞凋亡的影响 A:流式细胞仪检测各组细胞凋亡情况;B:各组细胞Caspase-3、PARP及Bcl-2蛋白水平比较。aP<0.05 vs对照组;cP<0.05 vs H2O2组;eP<0.05 vs 50μmol/L木犀草素组。

图5 各组细胞Nrf2和HO-1蛋白表达水平比较 aP<0.05 vs对照组;cP<0.05 vs H2O2组;eP<0.05 vs 50μmol/L木犀草素组。
2.6木犀草素对H2O2诱导的ARPE-19细胞Nrf2和HO-1蛋白表达的影响Western blot分析显示,各组细胞Nrf2和HO-1蛋白表达水平比较,差异有统计学意义(F=121.475、117.352,均P<0.01),见图5。组间两两比较发现,H2O2组细胞Nrf2和HO-1蛋白表达水平明显低于对照组(P<0.05);25μmol/L和50μmol/L木犀草素组细胞Nrf2和HO-1蛋白表达水平明显高于H2O2组(P<0.05),且50μmol/L木犀草素组变化更明显(P<0.05);Nrf2抑制剂组细胞Nrf2和HO-1蛋白表达水平明显低于50μmol/L木犀草素组(P<0.05)。
3讨论
ARMD是盲的主要原因,随着人类寿命的延长,其发病率逐年提高。当前研究发现长期氧化应激导致的RPE细胞结构与功能异常是引发ARMD的重要原因之一[9-10]。目前,通过抗氧化剂治疗ARMD已成为研究热点。木犀草素是一种天然黄酮类化合物,具有抗氧化、清除氧自由基等生物学活性[11-12]。本研究利用100μmol/L H2O2建立RPE细胞氧化损伤模型,观察木犀草素对ARPE-19细胞的保护作用及其可能的机制。本研究使用MTT法检测ARPE-19细胞活性,结果发现给予H2O2处理时细胞活力显著下降;而给予不同剂量木犀草素预处理后给予H2O2诱导,细胞活力明显升高,其中50μmol/L木犀草素预处理的细胞活性最高,表明木犀草素对H2O2诱导的ARPE-19细胞损伤具有保护作用。同时Hytti等[7]研究发现木犀草素对氧化应激损伤后的RPE细胞具有保护和修复作用;魏达亨等[8]研究发现木犀草素通过降低HMGB1表达减轻NF-κB介导的炎症,抑制碘酸钠诱导的RPE细胞凋亡,保护视网膜免受损伤。说明木犀草素对多种因素引起的视网膜损伤均具有一定的保护作用。此外,本研究还发现各剂量木犀草素能降低ROS和MDA含量,增强SOD活性,表明木犀草素可以清除H2O2诱导生成的ROS,促进RPE细胞内抗氧化物质含量增加,提高RPE细胞抗氧化应激能力,在一定程度上逆转H2O2引起的细胞氧化应激损伤,进一步说明木犀草素对视网膜氧化损伤具有保护作用。同时肖童等[13]研究发现木犀草素预处理对H2O2诱导的大鼠心肌H9C2细胞氧化应激损伤具有保护作用。提示木犀草素对H2O2诱导的细胞损伤具有一定的保护作用。
研究显示RPE细胞功能受损时可以引起细胞凋亡,而木犀草素具有显著的抗凋亡特性[14-15]。我们使用流式细胞术检测发现,H2O2处理后ARPE-19细胞凋亡率明显升高,而给予木犀草素处理后细胞凋亡率明显降低,且Caspase-3和PARP蛋白表达水平明显降低,Bcl-2水平明显升高,提示木犀草素能够抑制H2O2诱导的细胞凋亡。同时魏达亨等[8]研究发现,木犀草素可以抑制碘酸钠诱导的ARPE-19细胞凋亡。提示木犀草素能对RPE细胞功能受损引起的细胞凋亡具有一定抑制作用。
Nrf2通路作为重要的内源性抗氧化应激通路,在氧化应激反应应答中起关键作用[16]。Nrf2是调节氧化还原平衡的关键转录因子[17]。静息状态下,Nrf2在细胞浆中与Keap1结合,经泛素化-蛋白酶体降解[18]。氧化应激状态下,氧化还原平衡被打破,Nrf2被活化,从Keap1中释放并转移至细胞核,与核内的抗氧化反应元件(ARE)结合,上调下游Ⅱ相解毒酶和抗氧化基因的表达,提高抗氧化酶GSH-Px和SOD的活性,从而实现抗氧化应激作用[19-20]。HO-1作为Nrf2调控的下游蛋白,可以催化血红素降解生成胆绿素、一氧化碳和游离铁,四者共同形成细胞抗氧化应激损伤的内源性保护系统,减弱氧化应激及炎性反应,同时抑制促凋亡蛋白的表达,抑制细胞凋亡[21-22]。本研究结果发现,木犀草素能上调H2O2诱导的ARPE-19细胞中Nrf2及HO-1蛋白的表达,而加入Nrf2抑制剂后,Nrf2和HO-1蛋白表达明显降低,说明木犀草素能够通过某种方式激活Nrf2,从而上调下游抗氧化基因HO-1蛋白的表达,增强细胞清除ROS的能力,维持细胞内氧化还原状态的平衡,抑制氧化应激反应,保护细胞免受氧化应激损伤,而Nrf2抑制剂能逆转木犀草素对H2O2诱导的细胞氧化应激损伤保护作用,进一步说明了木犀草素可通过激活Nrf2来抑制H2O2诱导的氧化应激损伤。已有研究发现木犀草素可以激活人脐静脉内皮EA.hy926细胞Nrf2信号通路,抑制H2O2诱导的细胞毒性,对细胞具有氧化损伤保护作用[23]。提示木犀草素可通过Nrf2来发挥抗氧化作用。
综上所述,木犀草素对H2O2诱导的ARPE-19细胞氧化应激损伤具有保护作用,其机制可能与激活Nrf2/HO-1信号通路,抑制氧化应激反应有关,为临床治疗ARMD提供了新策略。

