体外自动除颤器阻抗补偿技术综述
祁琦,葛剑徽,余明,张广,陈锋
1.中国人民解放军军事科学院 系统工程研究院 卫勤保障技术研究所,天津 300000;2.中国人民解放军联勤保障部队 无锡联勤保障中心 药品仪器监督检验站,江苏 南京 210000
引言
体外自动除颤器(Automated External Defibrillator,AED)是自20世纪80年代末开始提供给院前发病现场电除颤的急救设备[1],电除颤成功的目的是输送足够的电流以停止纤维性颤动,恢复心脏的自发循环[2](Return of Spontaneous Circulation,ROSC)。经胸阻抗(Transthoracic Impedance,TTI)是影响除颤的关键因素之一,一般在20~200 Ω,除颤能量需要经过TTI的衰减后才能到达心脏[3-5]。除颤器在向患者施加除颤能量时需要排除TTI不同造成的负面影响。阻抗补偿技术是指除颤仪根据患者的测量阻抗实时调整输出波形的幅度、形状或者波形的脉冲宽度的技术,是除颤仪施加有效除颤的重要技术保证[6]。在AED阻抗补偿领域,国内外许多AED制造商都提出了独有的阻抗补偿技术,在阻抗补偿技术发展初期,大多数阻抗补偿技术都是以补偿除颤能量为目的设计的。随着对于除颤作用于人体机理的探索,随后出现了以补偿除颤电流为目的的阻抗补偿策略[7],但现有的阻抗补偿策略在补偿目标、补偿精准度等方面仍有不足。本文回顾了阻抗补偿技术的发展史并分类型介绍了主流AED的阻抗补偿策略,随后分析了现有阻抗补偿策略的不足,最后对未来阻抗补偿策略改进的方向提出了几点设想,对AED阻抗补偿技术发展研究具有一定参考意义。
1 基本介绍
1.1 AED
心脏性猝死是指急性症状出现1 h内发生以意识丧失为特征、由心脏原因导致的自然死亡,死亡的时间与形式都在意料之外[8]。85%的成人心脏性猝死是因心室颤动(Ventricular Fibrillation,VF)所致,早期电除颤被认为是救治心脏性猝死最重要的关键性治疗[9]。早期电除颤的时机是治疗VF的关键,每延迟1 min,心脏性猝死的生存率以7%~10%递减。事发后1 min内除颤生存率能达到70%,5 min的生存率只有50%,7 min的生存率仅有30%,9~11 min的生存率为10%,12 min后为2%~5%[10]。AED与传统除颤器不同之处在于,AED具有自动心律分析能力与语音提示操作功能,可以供受过训练的非专业人员使用[11]。AED可以减小从发生室颤到抢救的时间,从而大大提高患者的生存率。目前,AED包括两类除颤波形:单相波和双相波,不同的波形对能量的需求有所不同。单相波是以单方向释放电流,双相波的电流在一个特定的时限内是正向的,而在剩余的数毫秒内其电流方向改变为负向[12]。研究表明,双相波除颤较之单相波除颤更为安全有效[13]。
1.2 阻抗补偿技术
成功的除颤需要向心脏输送足够电流和持续时间的短暂电脉冲来终止心室颤动。除颤器能量选择的目的是输送足够的电流以停止纤维性颤动,恢复心脏的ROSC,同时限制电击诱发心肌损伤的风险[14-15]。除颤效果受许多因素影响,包括TTI[16-23]、波形形态、充电电压、输送的电流和能量、波形持续时间、负向与正向的比率。在这些变量中,大量研究表明,除颤的效果和电击导致的心脏损伤风险主要取决于输送的能量和电流的大小。AED的能量选择应是能够终止室颤的最低能量,能量和电流过低则无法终止心律失常,能量和电流过高则会导致心肌损害[24]。TTI是影响ROSC的关键因素,ROSC似乎依赖于大部分心肌的去极化[25],而能量必须经过TTI衰减之后才能到达电敏感心肌纤维。TTI越高,到达心脏的电流越少,虽然高幅值电流电击可确保心肌去极化,但它可能会对心脏组织造成损伤[26],所以TTI决定了除颤能量的大小及除颤波形的选择[27]。影响TTI的因素有:电极的类型和大小、电极板和皮肤间的接触状态、呼吸的时相、放电次数和时间间隔等[28-31]。1988年,Kerber等[32]对347例患者进行了室颤或房颤或室性心动过速电击治疗,结果表明加大能量可以明显提升高TTI患者的ROSC率,认为除颤器应依据患者TTI不同进行相应的能量调整[32],首次提出了阻抗补偿的概念,随后逐渐发展演化为现在的阻抗补偿技术。
2 阻抗补偿的目标
自出现阻抗补偿技术以来,各个品牌的除颤器都基于自身技术提出了不同的阻抗补偿方案,但对于阻抗补偿效果的评价方式却一直没有定论。虽然TTI是决定除颤能量的主要决定因素,但是对于除颤所需能量水平的描述应有一个理想的阈值,并且理想的除颤阈值描述参数应该保持恒定不变,不受变化的TTI所影响。所以,理想的除颤阈值描述参数是阻抗补偿的目标,探究理想的除颤阈值描述参数是比较不同阻抗补偿技术优劣、评价阻抗补偿效果好坏的基础。自除颤技术诞生以来,对理想的除颤阈值描述参数的探究从未停止。出于当时技术条件考虑,除颤器自诞生至今一直以能量作为除颤剂量的描述单位。在阻抗补偿技术出现以前,尽管患者之间的能量阈值存在显著差异(与体重无关)[33-36],但一致的建议是向所有患者提供固定的能量剂量[37]。然而,这种基于能量的除颤方法可能导致向TTI低的患者输送过大的电流,而向TTI高的患者输送过小的电流。随后研究表明,相较于除颤能量而言,除颤时体重标准化电流(1 A/kg)[38]是更好的除颤阈值描述参数[39],但此研究对临床影响很小,因为对于基于能量的除颤方法来说,1 A/kg的除颤剂量显然会导致电流剂量明显过大。
1987年,Lerman等[40]在动物实验中发现,与能量和电压作为除颤阈值描述参数相比,电流作为除颤阈值描述参数更为合适,在TTI的变化过程中,电流阈值的变化要远小于能量阈值和电压阈值的变化,提出了可以设计一种基于电流的除颤器的新思路[40]。次年他立即做了实验进行验证,他将86个室颤患者分为两组,实验组施加基于电流的除颤,第一次、第二次和第三次及以后除颤的剂量分别为25、25、40 A,对照组施加基于能量的除颤,第一次、第二次和第三次及以后除颤的剂量分别为200、200、360 J,实验得出:基于电流除颤相较于基于能量除颤而言,两者具有相当的ROSC率,但前者会向患者传输更低的峰值电流和更低的能量,结果显示了基于电流除颤器的优越性[41]。
上述结果均在单相波除颤的条件下得出,随着双相波除颤以其明显的优势逐渐取代单相波除颤后,对除颤阈值描述参数的探索仍在进行。研究表明,ROSC并不主要取决于除颤能量水平,而更多地取决于流经心脏的电流[42-45]。多项实验室研究表明,除颤电流与存活率的增加正相关,与除颤能量和除颤峰值电压相比,除颤电流有更强的除室颤后ROSC的预测能力,是更佳的除颤结果预测因子[46]。总之,相较于除颤能量,除颤电流是更为理想的除颤阈值描述参数,对ROSC也有更佳的预估能力,这表明,应鼓励开发基于电流的双相除颤器,阻抗补偿策略也应以补偿除颤电流变化为目标。
尽管基于电流的除颤理念已经被评估用于单相除颤,研究也表明剂量选择从基于能量的除颤转变为基于电流的除颤是未来的发展方向,但用基于电流的双相除颤器代替基于能量的双相除颤器将是一个非常昂贵的提议,制造商的折中解决方案可能是在新的除颤器设计中增加电流作为除颤剂量的选择功能,而能量仍然是目前临床上用于选择当前双相波除颤治疗剂量的唯一参数[16]。所以,对于仍以能量作为除颤剂量单位的双相波除颤器而言,应制定科学有效的阻抗补偿策略,该策略应基于“电流是理想的除颤阈值描述参数”这一理念进行设计,以补偿除颤电流的变化为目标,得到最优的阻抗补偿效果。相关研究表明基于除颤电流设计的阻抗补偿策略更适用于高TTI患者的除颤,能够有效提高ROSC率[7]。
3 主流AED的阻抗补偿策略
基于以上研究,各个AED制造商都设计研发了自己的阻抗补偿技术,我们选取了三家比较主流的AED制造厂商:飞利浦(Philips)、日本光电(NIHON KOHDEN)和卓尔(Zoll),下面分别具体介绍他们的阻抗补偿技术。(注:图表均来自各公司阻抗补偿技术专利)
3.1 Philips阻抗补偿技术
荷兰Philips公司在其公司生产的AED上应用其独创的阻抗补偿技术,该技术主要包含高阻抗补偿和低阻抗补偿两部分[47],该技术利用TTI变化会导致除颤能量衰减速度差异的特性,通过设置正向放电期间的阈值电压和阈值时间等参数,控制正向放电时间随着TTI的变化而调整,从而达到阻抗补偿的目的。
3.1.1 高阻抗补偿原理
在高阻抗补偿设计模块中,Philips采用预设恰当的阈值时间(tTHRESH)和阈值电压(VTHRESH)来对除颤过程的正向除颤阶段的时长进行延长,以实现面对高TTI患者时,能依据患者TTI大小适当增加除颤能量以达到有效除颤的目的。图1为高阻抗补偿逻辑框图,具体过程为:在正向电压除颤的过程中,第一轮判断衰减时间是否达到tTHRESH,若是则进行第二轮判断:判断正向电压是否小于VTHRESH,若是则在tTHRESH处立即停止正向除颤,除颤波形如图2a所示;若正向电压不小于VTHRESH,则返回第二轮判断,直至正向电压小于VTHRESH时,立即停止正向除颤,除颤波形如图2b所示。
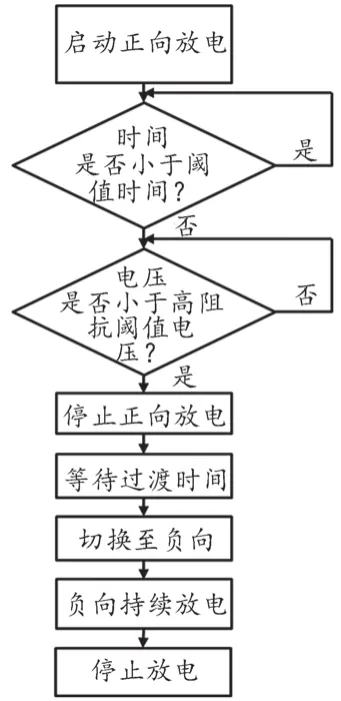
图1 高阻抗补偿逻辑框图
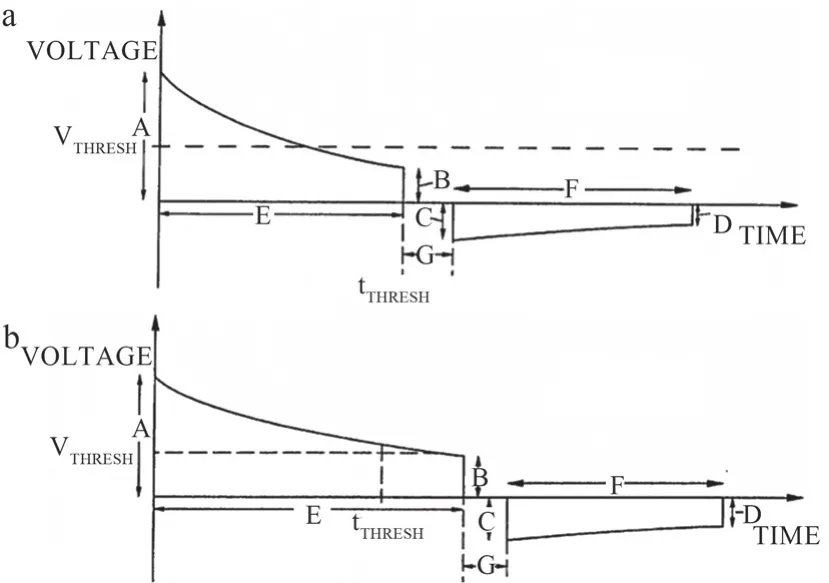
图2 高阻抗补偿波形示意图
3.1.2 低阻抗补偿原理
在低阻抗补偿设计模块中,Philips采用预设恰当的tTHRESH和VTHRESH来对除颤过程的正向除颤阶段的时长进行缩短,以实现面对低TTI患者时,能依据患者TTI大小适当减少除颤能量以达到避免损伤的目的。图3为低阻抗补偿逻辑框图,具体过程为:在正向电压除颤的过程中,第一轮判断衰减时间是否达到tTHRESH,若是则立即停止正向除颤,除颤波形如图4a所示;若未达到则进行第二轮判断,判断正向电压是否小于VTHRESH,若是则在该处立即停止正向除颤,除颤波形如图4b所示,若正向电压不小于VTHRESH,则返回第二轮判断。
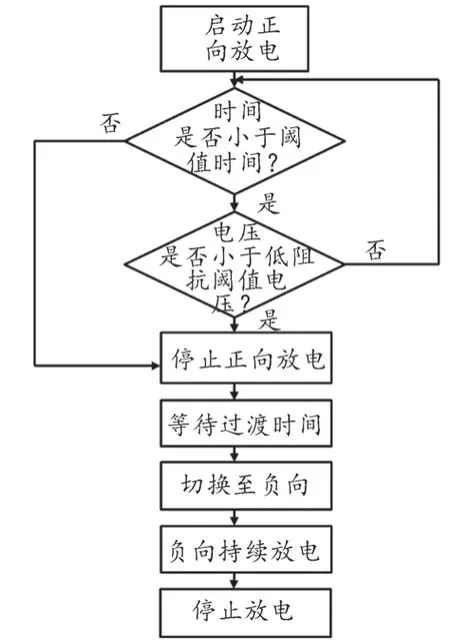
图3 低阻抗补偿逻辑框图
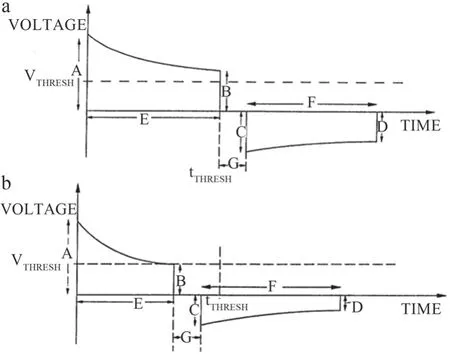
图4 低阻抗补偿波形示意图
3.1.3 阻抗补偿原理
Philips阻抗补偿原理综合了以上两部分,通过调节正向除颤时间改变除颤能量从而进行阻抗补偿,具体过程如下:高阻抗补偿技术针对高TTI患者除颤,当TTI增大时,电压衰减减缓,则高阻抗补偿技术可适当延长正向持续时间以确保有效;低阻抗补偿技术针对低TTI患者除颤,当TTI减小时,电压衰减加快,则低阻抗补偿技术可适当缩短正向持续时间以避免过强的刺激造成损伤。Philips公司的除颤产品阻抗补偿原理综合以上两种补偿思路,其逻辑框图如图5所示。
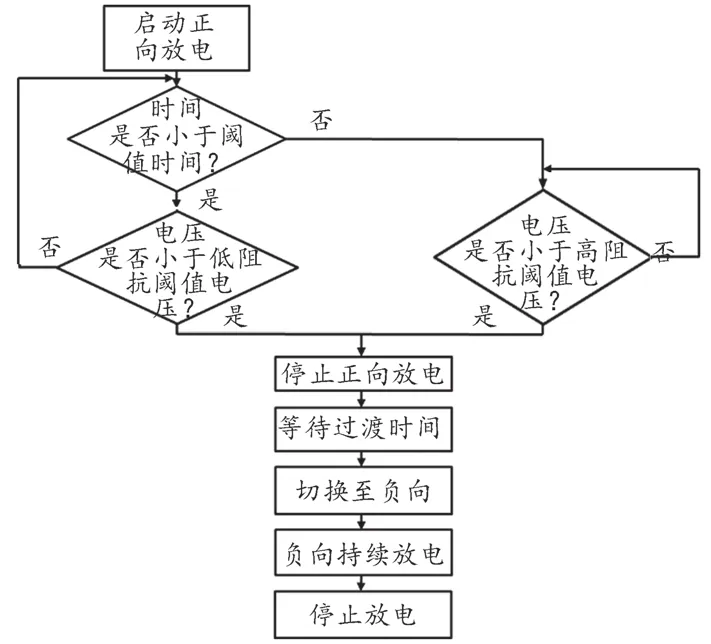
图5 Philips公司阻抗补偿策略
3.2 NIHON KOHDEN阻抗补偿技术
日本光电公司也有其独创的阻抗补偿技术[48],该技术是根据检测患者TTI的不同,调整正向除颤电压增益和负向除颤波形以达到阻抗补偿的目的。
3.2.1 除颤器充放电原理
日本光电的阻抗补偿技术基础电路如图6所示。其中,116为微处理器,115为充电电路,104为储能电容,开关驱动电路124/125/126分别控制开关101/102/103通断,二极管117/118/108/109的功能均为防止产生反向电流,111为保护电阻,113为患者,下面简要介绍该电路主要工作过程。
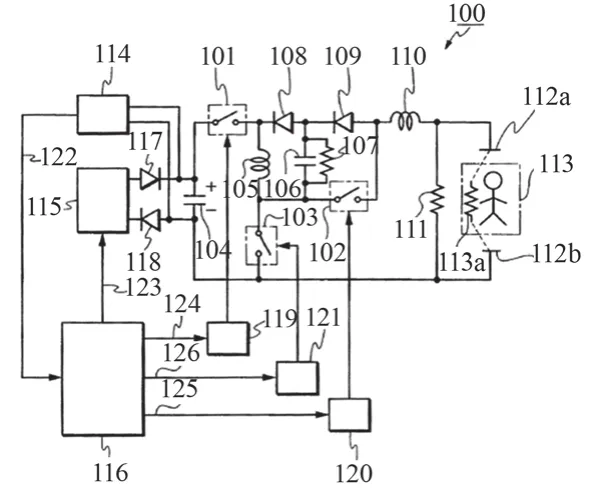
图6 日本光电双相波电路图
(1)储能电容104充电过程主要为:微处理器116收到充电指令后,116输出控制信号至开关驱动电路124/125/126,控制101/102/103保持断开状态,随后116输出控制信号123至充电电路115,115收到指令后开始向储能电容104充电。
(2)正向激励过程如图7所示,具体为:除颤器面板的除颤按钮被按下后,微处理器116接到除颤指令,116便输出控制信号至开关驱动电路124/125/126,控制101/102保持闭合、103保持断开状态,储能电容104上的电能通过图7所示回路正向传递到至患者113,开始正向激励过程,同时116通过电压检测电路114实时检测电容104的放电过程,当电容104两端电压下降至结束电压值时,116再次输出控制信号至开关驱动电路124/125/126,控制101/102保持断开、103保持闭合状态,正向激励结束。
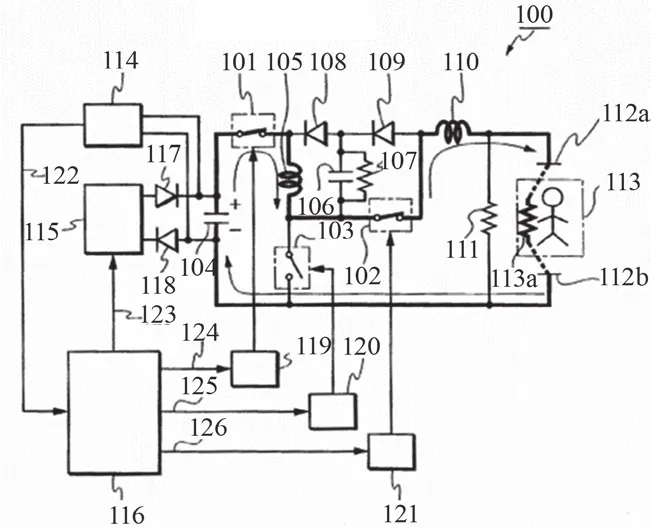
图7 正向激励示意图
(3)负向激励过程具体为:开关102始终保持断开,开关103始终保持闭合,微处理器116通过开关驱动电路119控制开关101按照一定时序通断,储能电容104中的能量通过电感105和电容106最终释放至患者,产生负向激励,微处理器通过控制开关按一定时序通断,来保证负向激励的电压曲线和电流曲线与微处理器内置参考电压曲线和参考电流曲线相一致。最后,微处理器根据预定协议终止能量释放过程,控制开关101保持断开状态,负向激励过程结束。
3.2.2 阻抗补偿原理
日本光电除颤器的阻抗补偿功能基于图8所示电路完成,相较于上文中完成充放电的基本电路增加了以下模块:133为增益开关电路,140为数模转换电路,141为内置ROM,142为误差放大器,143为脉宽调制电路。
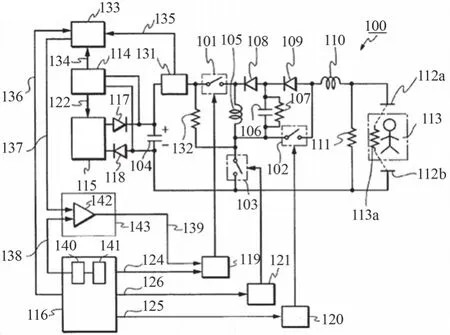
图8 阻抗补偿原理图
日本光电阻抗补偿功能主要是通过调节正向激励期间的除颤能量来实现,具体为:在除颤开始之前,微处理器116控制开关101/102/103处于断开状态,此时高频微电流电路163就通过电极112a/113a向患者发送一个高频微电流,微处理器通过检测高频微电流通过人体后产生的反馈信号175计算出患者的TTI,通过TTI的大小,微处理器又确定出一系列参数用以阻抗补偿,参数主要包括:正向激励末电压V1t,负向激励的末电压V2t和正向激励电压的增益倍数,增益倍数信号136传递至增益开关电路133,增益开关电路133按照此增益倍数控制充电电路115对储能电容104充能,充能完成后开始正向激励,电压检测电路114检测到电容104两端电压衰减至正向激励末电压V1t时停止正向激励。
负向激励具体为:电压检测电路114将检测到的104两端电压信号137传递至误差放大器142,141中存储的参考电压曲线经140数模转换为电压信号138后传递至误差放大器142,142比较信号137与信号138,控制输出脉冲信号139至119来控制开关101通断时序,来保证负向激励期间的104两端电压按照电压参考曲线进行变化,电压检测电路114检测到电容104两端电压衰减至负向激励末电压V2t时停止负向激励。
3.3 Zoll阻抗补偿技术
美国Zoll公司于1999年提出双相方波(Rectilinear Biphasic Waveform,RBW)技术[49],该技术是根据检测患者TTI的不同,为保证患者接受到相近的除颤电流水平,实时调整电路内置补偿电阻的大小以达到阻抗补偿的目的,实现除颤电流的阻抗补偿。
3.3.1 电阻补偿电路
双相方波通过图9所示电路实现:20为储能电容,22为充电电路,46为微处理器,48为“H”型电桥,50为可变电阻电路,64为感应电流测量电路。电路工作基本过程为:首先,微处理器46控制充电电路22向储能电容20充能,同时控制可变电阻电路50的总阻值置于最大,通过电桥48中的开关通断,储能电容20向人体释放一个较小的感应激励,微处理器46通过感应电流测量电路64测量感应电流大小计算人体阻抗,并根据测得的阻抗大小选择相应的阻抗补偿方案;然后,微处理器46通过控制电桥内开关30/32/34/36/38/40按时序通断以产生双相的除颤电流,在正向激励的过程中,可变电阻电路50根据预定的阻抗补偿测量实时变换补偿阻抗,实现阻抗补偿功能,其中正负向激励时长在微处理器46的控制下恒定不变。
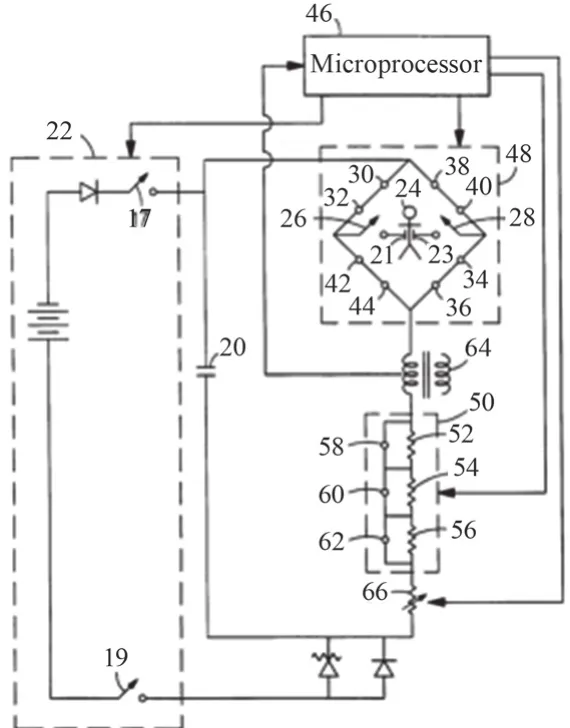
图9 Zoll双相波电路图
3.3.2 阻抗补偿原理
下面以TTI为50 Ω为例简要说明阻抗补偿原理:感应激励阶段,微处理器测得患者TTI为50 Ω后,通过查询内置阻抗补偿方案,选定40 Ω<Rpat<60 Ω时的补偿阻抗匹配策略(表1),由表可见:0.00~0.25 ms阶段为感应电流阶段,此时补偿阻抗置于最大值70 Ω;0.25~1.5 ms阶段,补偿阻抗为30 Ω;1.5~3 ms阶段,补偿阻抗调节为20 Ω;3~4.5 ms阶段,补偿阻抗调节为 10 Ω;4.5~6 ms阶段,补偿阻抗调节为0直至除颤结束。

表1 补偿阻抗匹配表(40 Ω<Rpat<60 Ω)
图10为50 Ω TTI除颤波形图,其中:正向电流时长为6 ms,负向电流时长为4 ms,正负向切换段时长为0.1 ms,以上时长恒定不变。由图可见,正向激励阶段进行了三次明显的补偿阻抗调节,分别为30 Ω至20 Ω、20 Ω至10 Ω、10 Ω至0,补偿阻抗的变化减小了正向除颤电流的衰减,针对50 Ω的较小TTI,该方法在减小除颤电流的同时保证了正向除颤电流的相对恒定不变。
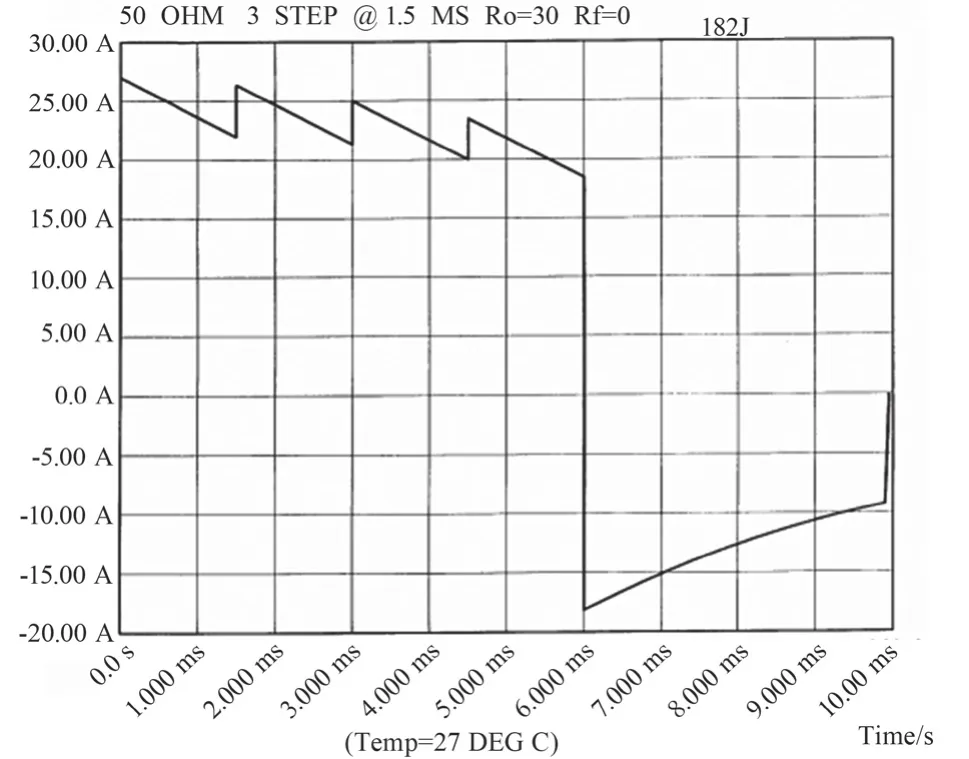
图10 50ΩTTI除颤波形图
3.4 讨论
根据以上对于三个品牌的AED阻抗补偿策略的阐述,总结分析如下:
相同点方面:三个品牌的阻抗补偿策略都是针对双相波除颤所设计,且都是基于相同的出发点,即既要保证有效除颤,又要尽量减少除颤带来的附加伤害。
不同点方面:首先体现在设计思路上,三个品牌的AED的阻抗补偿策略设计的思路有所不同:Philips和日本光电的AED属于基于除颤能量的阻抗补偿策略,Philips的AED通过延长正向波形持续时间的方法提供相对恒定的除颤能量,从而补偿TTI变化,日本光电的AED通过增加电压和延长正向波形持续时间的方法提供相对恒定的除颤能量,从而补偿TTI变化;而Zoll的AED属于基于电流的阻抗补偿策略,通过变化的补偿电阻序列和固定的除颤时长来产生相对恒定的除颤电流,从而补偿TTI变化,同时通过在正向波形期间不断切换补偿电阻使得正向除颤电流也相对保持恒定,这都是基于电流所设计的特性。
三个品牌的AED的阻抗补偿策略实现方式上也有所不同,具体表现在:① 阻抗测量方面有所不同。Zoll与日本光电的AED均在除颤之前测量了患者的TTI,用于后面的阻抗补偿,而Philips的AED并没有测量患者的TTI,而是利用除颤能量在不同阻抗值的患者体内衰减速度不同的特性进行阻抗补偿;② 阻抗补偿策略的实时特性有所不同。由于上一点的差异,导致卓尔与日本光电的AED的阻抗补偿策略基于测得的除颤前TTI大小,除颤过程中TTI大小的变化不会改变阻抗补偿策略,故不具有实时特性,而Philips的AED则是根据除颤过程中的患者TTI大小实时进行调整,具有实时特性;③ 阻抗补偿实现的方法有所不同。Philips的AED主要通过设置阈值电压与阈值时间的方式实现阻抗补偿,日本光电的AED主要通过根据阻抗值设置增益倍数的方式实现阻抗补偿,而卓尔的AED主要通过根据阻抗值设置补偿电阻的方式实现阻抗补偿;④ 阻抗补偿针对的参数也不相同。Philips的AED主要对正向波形时长进行调整,卓尔的AED主要对正向波形的幅值进行调整,而日本光电的AED对于正向波形的幅值与时长都有一定的限制。
4 不足与展望
4.1 现有阻抗补偿策略的不足
随着电流优于能量作为除颤剂量单位的理念逐步深入,基于除颤电流的阻抗补偿策略是未来阻抗补偿发展的方向,目前来讲,Zoll的阻抗补偿策略是基于除颤电流所设计的阻抗补偿策略的代表,而很多品牌仍然在沿用基于除颤能量的阻抗补偿策略。2003年的一项研究比较了使用不同电波形的六种市售除颤器,6种市售除颤器都具有阻抗补偿功能,发现虽然这些波形在低阻抗值时除颤率相当均匀,但在高阻抗值时有显著变化。该研究的结论是,尽管在双相波除颤器中有阻抗补偿方案,但阻抗对除颤疗效仍有影响[50],这表明现有阻抗补偿方案仍没有完美解决除颤中不同TTI的匹配问题,现有阻抗补偿策略的不足之处主要表现在以下几个方面:
首先,对人体来讲,除颤电流在除颤过程中的具体作用机理仍未完全知晓,对于不同阻抗水平患者的最佳除颤电流或最佳除颤电流水平仍不明确。前期对于电流是除颤关键因素的探究主要是在动物实验上进行,近年也有学者对除颤峰值电流在除颤过程中的具体作用机理以及ROSC的最佳峰值电流水平进行了研究,结果表明心室颤动患者ROSC的最佳峰值电流似乎在10~20 A的范围内,心脏骤停的时间越长则需要越大的除颤电流,为了防止在低TTI患者上产生过大的峰值电流,第一次除颤可以考虑提供相对较低的10~15 A峰值电流,如果无法ROSC,可以考虑将峰值电流提高到15~20 A[51]。但此研究仅将患者阻抗分为低中高三个组进行分析,得出的结果也较为简单,没有得到不同TTI水平下的最佳电流水平,不足以指导下一步的阻抗补偿技术发展。Zoll的除颤器阻抗补偿策略是以电流是除颤关键因素的思路进行设计,但在我们测试中发现Zoll的除颤器在不同阻抗水平下的除颤电流变化虽小于其他基于能量的阻抗补偿策略除颤器,但该电流值也并不稳定,在低TTI的条件下会产生较大的电流,需要在进一步探究适宜人体的最佳电流水平的基础上继续加以改进。
其次,电流是除颤关键因素的理念是我们设计阻抗补偿策略的基础,同时多项研究表明,对于高TTI患者,延长除颤时间和增加除颤能量能明显提高除颤成功率[32,52-54],而Zoll的阻抗补偿策略虽是基于电流设计,但通过我们对其产品进行实测发现,Zoll的阻抗补偿策略在高TTI水平时能量衰减较大,这可能是因为其正向波形持续时间和负向波形持续时间均为定值所致,这不利于对高TTI患者施加有效的除颤,可能会对高TTI患者的ROSC率造成影响。
最后,现有的阻抗补偿策略许多都是将TTI划分为若干个阶段,每个阶段设计对应的阻抗补偿方案,但这样做的问题在于每个TTI区间的范围仍比较大,高能量模式下对TTI大小的区分则更为简单,在同一区间患者的TTI相差较大,但阻抗补偿方案则完全一致,阻抗补偿的精准度较低,仍有给予患者不适宜的除颤电流和除颤能量的风险。
4.2 未来阻抗补偿策略的构想
首先,进一步探究除颤电流在除颤过程中的具体作用机理是改进阻抗补偿策略的基础,适宜人体的最佳电流水平以及最佳电流按照TTI 的分布是设计未来阻抗补偿策略的关键。基于电流的阻抗补偿策略是未来的发展方向,这需要不同TTI水平下的最佳电流水平作为理论基础,这样便可以定量地对各TTI水平下的阻抗补偿方案进行修正,有助于完善基于电流的阻抗补偿策略,也是评判阻抗补偿策略效果优劣的重要依据。
其次,在以上探究完成前,现有的基于电流的阻抗补偿策略也可以进一步完善。Zoll基于电流的阻抗补偿策略在高TTI水平时有较大的能量衰减,这不利于高TTI患者接受到有效的除颤,可以考虑在保持其现有的电流水平的基础上,在高TTI时适当延长正向激励时间和负向激励时间,以达到弥补能量衰减的目的。具体实现方法可以考虑借鉴Philips除颤器阻抗补偿策略中根据TTI不同实时调节激励时长。与此同时,TTI区间的范围也应适当缩小,精细划分TTI区间有助于避免给予患者不适宜的除颤电流和除颤能量,更进一步提高阻抗补偿精准度,提高阻抗补偿实效。
5 结语
本文首先介绍了AED及阻抗补偿技术的基本知识,对阻抗补偿的理论基础进行了简要阐述,讨论了除颤的剂量描述应是除颤电流而不是除颤能量,从而得出基于补偿除颤电流的阻抗补偿技术应是阻抗补偿技术未来发展的方向,随后分别详细介绍了三种市售主流AED的阻抗补偿技术的设计思路、电路原理、实现方式,其中Philips和日本光电两家公司的AED阻抗补偿技术是以补偿除颤能量为目的的阻抗补偿策略的代表,而以补偿除颤电流为目的的阻抗补偿策略的代表则是Zoll的阻抗补偿技术。随后,通过简要的对比分析,结合产品实测的结果可以得到,现有的基于除颤电流的阻抗补偿策略仍有许多不足,包括对高TTI患者的除颤能量衰减过大、阻抗补偿精准度不够高等问题。最后,针对现有问题,本文提出了几点建议,对未来阻抗补偿技术的发展有一定参考意义。

