抗生素联合粪菌移植构建人源化小鼠的可行性研究
徐美玲,张 瑜,桑 明,王普清
(1.湖北医药学院附属襄阳市第一人民医院,2.湖北省帕金森病临床医学研究中心,湖北襄阳 441000)
人体肠道中定植了大量细菌,其基因总数约为人体基因数的150 倍,称为人体“第二脑”。近些年,多项研究显示诸多疾病的发生可能与菌群结构紊乱有关。因此有研究人员尝试用粪菌移植的方法治疗复发性艰难梭菌感染、肥胖、代谢综合征和自闭症等疾病[1-4],且已取得一定效果。在粪菌移植研究中,小鼠是极好的模型,但因无特定病原体级(specific pathogen free,SPF)小鼠及野生型小鼠存在定植抗性,即原始的肠道菌群对外源细菌定植存在抵抗。所以无菌小鼠成为了研究者们的首要选择。但是,无菌动物存在价格昂贵、获取困难、饲养要求高的缺点及限制[5]。综上考虑,多个研究机构选择先用抗生素处理降低常规小鼠或SPF 小鼠的定植抗性,然后再进行肠道菌群移植研究[6-8]。但对于抗生素的使用方法及粪菌移植的时间尚无统一意见,且构建人源化小鼠方法的可行性,尚无系统报道。
因此,在既往研究基础上[3,8-10],本实验选择了一种目前常用且未曾被验证过的方法,通过对小鼠一般情况、肠道菌群的消耗情况以及移植粪菌定植效果3 个方面研究,对该构建人源化小鼠方法的可行性进行新验证。
1 材料与方法
1.1 材料
1.1.1 实验动物 6 周龄SPF 级雄性野生型C57BL/6 小鼠,来自中国湖南斯莱克景达实验动物有限公司。饲养于湖北医药学院附属襄阳市第一人民医院中心实验室[SYXK(鄂)2017-0093]。饲养期间各组小鼠可自由获得食物和水。饲养环境:昼夜各半循环照明,湿度控制在40%~60%,温度控制在(24.0±2.0)℃。本研究方案经湖北医药学院附属襄阳第一人民医院伦理委员会批准(2019DW0 08),并按实验动物使用的3R 原则给予人道的关怀。
1.1.2 实验试剂 氨苄青霉素(A6265,Macklin),硫酸新霉素(N6063,Macklin),甲硝唑(M813526,Macklin),万古霉素(V6062,Macklin),革兰氏染色试剂(G1060,Solarbio),QIAamp Fast DNA Stool Mini Kit(51604,Qiagen),PCR MIX(D7251,Beyotime),DNA ladder(D0107,Beyotime),普通琼脂糖凝胶DNA 回收试剂盒(DP209,TIANGEN),GoTaq Qpcr Master Mix(A60001,Promega)
1.1.3 实验仪器 生物安全柜(Hfsmfe-1500LC,上海力申科学(力康),中国),电子天平(STX1202 ZH,OHAUS,中国),麻醉机(R580,瑞沃德,中国),分光光度计,Veriti™96-Well Thermal Cycler仪,电泳仪,7500 Fast Real-Time PCR System。
1.2 方法
1.2.1 实验设计 为明确抗生素处理对肠道微生物的消耗情况及小鼠肠道的影响,小鼠被随机分为2 组,抗生素组(n=10):用氨苄青霉素1 g/L、硫酸新霉素1 g/L、甲硝唑1 g/L、万古霉素0.5 g/L 混入灭菌饮用水中连续3 周[6,11]。对照组(n=10):用灭菌饮用水喂养小鼠3 周。在实验期间每3~4 d 记录动物体重、饮用水消耗量及饲料消耗情况。
为评价抗生素处理后对后续移植粪菌定植效果的影响,小鼠被随机分为2 组:移植1 号人粪菌组(n=7):给予抗生素处理后小鼠移植1 号人的粪菌1周;移植2 号人粪菌组(n=7):给予抗生素处理后小鼠移植2 号人的粪菌1 周。
1.2.2 革兰氏染色 收集小鼠新鲜粪便于无菌EP管中,每10 mg 粪便加入无菌生理盐水100 μL,静置15 min 后匀浆直至完全溶解,1 000 r/min,4 ℃下离心5 min,收集上清液,混匀后抽取10 μL,滴于载玻片上,按革兰氏染色试剂说明书制作粪菌涂片并染色观察。
1.2.3 粪便细菌DNA 提取 按QIAamp Fast DNA Stool Mini Kit 说明书提取粪便细菌DNA。用分光光度计在260 nm 处测量DNA 浓度,并通过测量A260/A280 来评估纯度。保存于-20 ℃备用。
1.2.4 PCR 引物特异性验证 本文所用引物序列由金开瑞生物工程有限公司(武汉)商业化合成。对上述提取的粪菌DNA 行普通PCR 验证引物特异性。20 μL 反应体系包括2×master mix 12.5 μL,引物(Bacteroidetes:forward primer,5'-GGARCATGTGGTTTAATTCGATGAT-3';reverse primer,5'-AGCTGACGA-CAACCATGCAG-3';Firmicutes:forward primer,5'GGAGYATGTGGTTTAATTCGAAGC-A-3';reverse primer,5'-AGCTGACGACAACCATGCAC-3')[12,13](10 μmol/L)各1 μL,DNA 模板5 μL,无核酶水5.5 μL。采用Veriti™96-Well Thermal Cycler 仪进行扩增。反应程序为:95 ℃变性5 min 后,95 ℃30 s,60 ℃30 s,72 ℃45 s 共35 个循环,最后以72 ℃10 min 延伸后结束。用2%的琼脂糖凝胶电泳分析。
1.2.5 标准曲线的制作及RT-PCR 条件 对上述电泳后凝胶,按照普通琼脂糖凝胶DNA 回收试剂盒说明书,进行切胶,纯化回收DNA 处理。随后使用分光光度计测浓度及纯度后,保存在-20 ℃。并按公式计算细菌拷贝数:拷贝数=[6.02×1023×浓度(ng/μL)×10-9]/(DNA 长度×660)计算出每毫升PCR 所含的拷贝数,然后做10 倍系列稀释,使其形成105~1010拷贝/mL,进行荧光定量PCR。PCR条件为:20 μL 反应体系包括2×master mix 10 μL,上下游引物(10 μmol/L)各0.4 μL,DNA 模板25 ng,用无核酶水补足至20 μL。扩增程序为50 ℃循环1 次,持续2 min;95 ℃循环1 次,持续10 min;95 ℃15 s,60 ℃30 s,72 ℃30 s,循环40 次。以模板的不同l g(拷贝数)为纵坐标,以PCR 反应过程中出现荧光信号的初始循环数(CT)为横坐标绘制标准曲线。后续RT-PCR 均按上述条件执行。
1.2.6 粪菌制备及移植 移植粪菌的制备:收集新鲜粪便于无菌离心管中,用无菌PBS(5 mL/g)浸泡,4 ℃下放置约15 min 或涡旋直至混匀,以1 000 r/m 离心,4 ℃离心5 min。留取上清液。上清液与等体积的50%无菌甘油的混合至终浓度25% ,然后储存在-80 ℃直到移植。粪菌移植:每只小鼠每天灌胃200 μL 粪菌悬液,共持续7 d。
1.3 统计学处理
统计结果用均值±标准误差(Mean ±SEM)表示。所有数据用GraphPad Prism 8.0 软件处理,两组间比较采用独立样本t检验。以P<0.05 为差异具有统计学意义。
2 结果
2.1 抗生素混合处理对小鼠一般情况的影响
根据既往研究文献[14],在小鼠饮用水中添加氨苄青霉素、万古霉素、新霉素和甲硝唑4 种抗生素来消耗其原本的肠道微生物群。然后对抗生素处理期间小鼠体重变化及食水的消耗量进行记录并分析。结果显示:相比于正常对照组,抗生素处理组小鼠饮用水消耗明显减少(P=0.000 3,t=4.232,F=1.940,图1A);饲料消耗也减少(P=0.001 2,t=3.716,F=1.759,图1B)。体重变化方面,正常饮用水组与抗生素处理组小鼠体重在实验开始前没有统计学差异(P=0.217 8,t=1.277,F=3.019,图1C),而在给予小鼠广谱抗生素处理第1 周,小鼠体重下降明显,尤其是前3 天(P<0.000 1,t=5.869,F=6.943,图1E),随后两组小鼠体重均呈增加趋势,最后在抗生素处理3 周结束时,两组小鼠体重差异无统计学意义(P=0.747 6,t=0.326 8,F=7.959,图1D)。对于小鼠粪便性质观察,在整个抗生素处理过程中,部分小鼠体重出现稀便、大便不成型症状,但期间无便血,未予以处理,观察1 d 后可自行缓解。且整个抗生素处理阶段,两组小鼠均无死亡现象。

图1 抗生素组与对照组饮水量消耗(A)、饲料消耗(B)及体重变化情况(C-E)Fig 1 Water intake,food intake and weight changes of the mice in the antibiotic and control groups
2.2 抗生素处理消耗原有肠道微生物,降低定植抗性
在抗生素处理3 周后分别对两组小鼠的新鲜粪便行粪便涂片及革兰氏染色。结果显示,抗生素处理后小鼠粪便微生物数量明显下降,但抗生素处理不能完全清除肠道微生物(图2A、2B)。抗生素处理结束后,解剖小鼠发现小鼠肠道存在盲肠扩张(图2C、2D),符合无菌小鼠相关表现[14-16]。
同时,对小鼠肠道长度进行测量分析,结果显示抗生素处理后小鼠肠道长度未有明显异常(P=0.823 1,t=0.238 7,F=1.590,图2D、2E)。
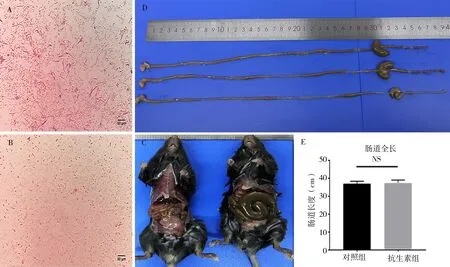
图2 抗生素干预后小鼠粪便革兰氏染色(A、B)、肠道外观(C、D)及肠道长度情况(D、E)Fig 2 Gram staining of mice feces、intestinal appearance and the gut length of mice after antibiotic intervention
2.3 粪菌移植后小鼠肠道菌群的定植情况
首先,普通PCR 显示拟杆菌及厚壁菌的引物特异性良好(图3A)。随后标准曲线制作,得到厚壁菌的标准曲线(图3B)为:Y=-0.292 3×X+13.05(R2=0.980 4);拟杆菌的标准曲线(图3C)为Y=-0.275 8×X+10.63(R2=0.999 7)。最后通过RTPCR 分别对粪菌移植的供体及受体粪便微生物进行检测(图3D~F),结果显示,1 号人粪菌比2 号人粪便中的拟杆菌高(P=0.001 0,t=5.930,F=13.63)、厚壁菌低(P=0.001 5,t=5.545,F=1.522)及厚壁菌/拟杆菌浓度低(P=0.001 2,t=5.726,F=1.578),比例分别为104.0%、33.7% 和32.0%。在粪菌移植后7 d,1 号小鼠比2 号小鼠拟杆菌浓度高(P=0.014 5,t=3.402,F=1.683),厚壁菌浓度低(P=0.000 1,t=8.809,F=6.992),厚壁菌/拟杆菌浓度低(P=0.000 2,t=8.031,F=8.430),比例分别为112.0%、15.4%和13.7%。
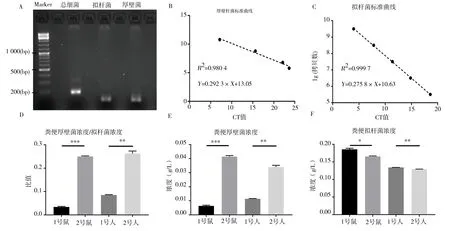
图3 粪菌移植后供体人粪菌与受体小鼠粪菌比较Fig 3 Comparison of donor human feces and recipient mouse feces after transplantation
3 讨论
本研究对一种比较常用的使SPF 小鼠人源化方法的可行性进行新验证。其中不同于Schuijt 等[6]仅对抗生素处理后小鼠肠道进行评价及Le Roy等[17]和Emal 等[18]仅侧重于粪菌移植后粪菌的定植效果,本研究选择通过对抗生素处理后小鼠一般情况、抗生素处理后粪便微生物消耗情况、粪菌移植的定植效果3 个方面的联合研究验证。
其中,为明确多种抗生素联合处理的安全性,首先评估了抗生素处理对小鼠一般情况的影响。发现抗生素处理减少小鼠饮用水消耗,结果同之前研究存在一致性[14],考虑原因可能为饮用水含有较苦的甲硝唑所致。有部分研究为改善抗生素饮用水味道,给予饮用水中添加甜味剂[11]或葡萄糖[18],但是本实验为防止以上物质影响小鼠代谢,继而使实验结果产生偏差,所以未添加。而小鼠饲料消耗降低,考虑原因为广谱抗生素致肠道菌群消耗,从而进一步影响消化功能及食欲。体重方面,正常组体重呈稳步上升的趋势,而抗生素组体重趋势为先下降,在1 周左右达到最低,而后上升,最后与正常组持平。与Reikvam 等[14]的报道一致,在引入抗生素治疗后第4~5 天,小鼠经历了短暂的体重减轻,但在1 周内,接受抗生素治疗的小鼠与未治疗的小鼠相比恢复了体重,并且看起来很健康。其中Reikvam 等[14]认为是氨苄青霉素的原因,而本研究经观察后认为抗生素组前期体重降低原因为小鼠饮用水及饲料摄入少所致,随后体重增加,考虑抗生素处理后小鼠盲肠扩张,肠内容物多而导致小鼠体重增加的假象。总体上而言,抗生素处理期间,未出现死亡等严重不良事件,表明抗生素处理小鼠肠菌是安全可行的。
鉴于抗生素组饮用水消耗明显减少,小鼠摄入抗生素剂量是否可以达到消耗原有肠道微生物降低定植抗性的目的,用革兰氏染色对抗生素处理后小鼠肠道微生物做了定性检测,提示抗生素处理后小鼠肠道微生物消耗明显,而且盲肠扩张情况符合无菌小鼠表现。本研究虽然缺少抗生素处理前后粪便微生物的绝对定量分析,但定性结果同其他既往实验结果一致[8,9]。众所周知,长期抗生素处理可能导致抗生素相关性肠炎[19],而小鼠肠炎多数表现为肠道长度异常。本研究显示抗生素处理后小鼠肠道长度无明显异常。提示抗生素处理可消耗肠道微生物构建相对无菌动物。
如前所述,粪菌移植是将供体粪便微生物移植到受体胃肠道内,重建新的肠道菌群,实现肠道及肠道外疾病的治疗。为了建立人源化动物模型,且明确该方法是否使人源肠道微生物定植于小鼠肠道内。课题组给予肠道微生物消耗小鼠连续1 周移植人冷冻粪便微生物悬液,随后分别对粪菌移植供体及受体的粪便微生物进行RT-PCR 定量。结果显示,抗生素处理后再给予粪菌移植不仅可以使微生物定植于消化道,而且接受1 号人与2 号人粪菌的小鼠之间肠道菌群的差异和1 号人与2 号人原本粪便微生物的差异趋势存在一致性。该结果同Hintze 等[8]推荐使用抗生素联合粪菌移植处理建立人源化动物模型存在一致性,但是二者选择抗生素种类不同,灌胃周期也不同。而且两种方法均存在的弊端是不会导致供体粪便微生物与受体粪便微生物的完全一致性。对于本研究而言,1 号人粪菌与1 号小鼠二者厚壁菌浓度、拟杆菌浓度及厚壁菌与拟杆菌浓度比例均存在差异;2 号人粪菌与2 号小鼠在厚壁菌浓度及拟杆菌浓度存在差异,而厚壁菌与拟杆菌浓度比例没有统计学差异。分析其原因可能为人与小鼠种属及饮食结构不同,肠道微生物存在差异性;或者是粪菌移植本身只能定植一部分的肠道微生物[3,20]。
在本研究中,课题组通过对抗生素处理后一般情况、抗生素处理后粪便微生物消耗情况、抗生素处理后粪菌移植的定植效果3 个方面的研究结果表明,通过抗生素处理及粪菌移植可以使SPF 级小鼠人源化,而且是安全可行的。但是粪菌移植仍有个体化差异存在,应该在设计未来的粪菌移植实验方案时需考虑进去。
作者贡献度说明
徐美玲:实验操作、数据分析、文章撰写。张瑜:文章修改。桑明:实验设计、数据分析。王普清:实验设计、文章修改。

