ω-3多不饱和脂肪酸对慢性移植物抗宿主病狼疮小鼠的免疫调控作用
曾靖雯,刘傲璐,王 帅,邢朝凤,张宗猛,唐敏怡,彭月荣,毕欣耘,李芳红,赵子建
(广东工业大学生物医药学院,广东 广州 510006)
系统性红斑狼疮(systemic lupus erythematosus, SLE)是一种多发于青年女性的累及多脏器的自身免疫性结缔组织病,具有广泛的临床表现。有研究表明其免疫病理反应主要表现为细胞因子、B细胞免疫和T细胞信号转导的异常[1]。传统的SLE治疗以非特异性的激素和免疫抑制剂为主,长期使用可引起严重的副作用和不良反应。因此需要寻找到一种安全可靠的有效治疗,替代或减少激素和免疫抑制剂的使用是SLE长期治疗的一个重要方向。慢性移植抗宿主病模型(chronic graft versus host disease, cGVH)是通过骨髓移植诱导小鼠的狼疮特征[2]。我们通过将BM12小鼠淋巴细胞腹腔注射到C57BL/6J(B6)小鼠体内,建立cGVH小鼠模型,该模型受体的抗原提呈细胞(antigen presenting cells,APCs)对供体CD4+T细胞的异源激活导致cGVH,其症状与SLE相似[2]。
人类和动物研究表明,ω-3多不饱和脂肪酸(ω-3 polyunsaturated fatty acids,ω-3 PUFAs)可以抑制炎症。ω-3 PUFAs主要包括3种,分别为α-亚麻酸(alpha-linolenic acid,α-LA),其学名为顺式十八碳三烯-9,12,15-酸,速记法名称为18:3 ω-3,是一种含有3个双键的ω-3不饱和脂肪酸;二十碳五烯酸(eicosapentaenoic acid,EPA),其学名为顺式二十碳五烯-5,8,11,14,17-酸,速记法名称为20:5 ω-3,是一种含有5个双键的ω-3不饱和脂肪酸;二十二碳六烯酸(docosahexaenoic acid,DHA)其学名为顺式二十二碳六烯-4,7,10,13,16,19-酸,速记法名称为22:6 ω-3,是一种含有6个双键的ω-3不饱和脂肪酸。它们是必需脂肪酸,人体不能自主合成,需从外界摄入。ω-6 PUFAs主要包括亚油酸(linoleic acid,LA)和花生四烯酸(arachidonic,AA)等,ω-6 PUFAs及其代谢产物具有促炎症作用。在日常生活饮食中,ω-6/ω-3 PUFAs二者比率已经接近20 ∶1。而大量食物含有ω-6 PUFAs,只有少部分食物含有ω-3 PUFAs,从而使得ω-6 PUFAs摄入过多,然而ω-6 PUFAs中的花生四烯酸AA会进一步代谢为前列腺素E2、白三烯 B4 等促炎症因子,从而引起一些慢性疾病的发生[3]。ω-3 PUFAs及其代谢产物具有抑制炎症的作用,与ω-6 PUFAs之间是相互拮抗的关系[3]。因此在食物中有效提高ω-3 PUFAs,同时降低ω-6 PUFAs的含量,平衡二者比例对于相关代谢慢性疾病具有重要意义。研究表明[4-6],低比例的ω-6/ω-3 PUFAs(接近1 ∶1)可以降低许多慢性疾病的风险,如类风湿性关节炎、系统性红斑狼疮、多发性硬化症和Ⅰ型糖尿病。
在系统性红斑狼疮中,T细胞参与了自身免疫的启动和持续,B细胞可通过抗体依赖性或非依赖性促进或抑制自身免疫。Pestka等[7]的一项独立研究发现富含ω-3 PUFAs的饮食可延缓狼疮小鼠的发作并显著减轻自身免疫性肾小球肾炎,血浆自身抗体和蛋白尿的严重程度。重要的是,这种自身免疫的抑制被发现与SLE小鼠肾脏或脾脏中CD4+T细胞特异性基因表达的普遍降低有关。有一项关于ω-3 PUFAs靶向B细胞影响同源T细胞活化的研究,健康C57BL/6J小鼠服用鱼油可抑制B220+B细胞刺激Th1细胞因子分泌的能力[8]。
前期有研究证明ω-3 PUFAs能够延缓并减轻MRL/lpr和B/W F1等狼疮小鼠疾病,但研究主要使用的是富含ω-3 PUFAs的饲料,且没有对DHA和EPA进行区分讨论[7, 9]。除此之外,在过去探讨ω-3 PUFAs对狼疮小鼠影响的研究中,从未使用过BM12小鼠淋巴细胞诱导的cGVH狼疮小鼠模型。因此,本课题首次使用了含量高达90%的混合型ω-3 PUFAs和含量高达97%的纯化型EPA,探讨其对BM12小鼠淋巴细胞诱导的cGVH狼疮小鼠脾脏淋巴细胞亚群的调节作用,为进一步探索ω-3 PUFAs应用于系统性红斑狼疮的临床治疗提供可行性分析和前期数据,为将来利用ω-3 PUFAs作为免疫调节药物,辅助或减少副作用明显的激素类药物和免疫抑制药物提供研究依据。
1 材料与方法
1.1 材料
1.1.1实验动物 受体鼠为SPF级雌性C57BL/6 J小鼠(7周龄),购自江苏集萃药康生物科技有限公司,供鼠为7~8周龄雌性BM12(I-Abm12B6(C)-H2-Ab1bm12/KhEgJ)小鼠,购自美国Jackson实验室。小鼠均饲养于华南理工大学大学城校区SPF级实验动物中心,动物中心使用许可证号:SYXK(粤)2017-0178。本实验所用动物均符合广东省人民医院动物伦理审查标准。
1.1.2主要试剂 90% ω-3 PUFAs乙酯(其中EPA乙酯46.56%,DHA乙酯41.6%,总ω-3 PUFAs乙酯含量为90%,批号:G20140848)和97% EPA乙酯(批号:02200201)购自成都国为生物医药有限公司;单克隆流式抗体CD25 APC(557192)、PD-1 APC(562671)、CXCR5 PE(561988)、CD138 BB700(742124)、B220 PE-Cy7(552772)、CD95 FITC(554257)、GL-7 PE(561530)、染料Fixable Viability Stain780(565388)、刺激阻断剂(550583)购自美国BD公司;IgG检测试剂盒mouse IgG Elisa kit(6320)购自美国ADI公司。
1.1.3仪器 Cytation5多功能微孔检测分析系统(美国Biotek);低温离心机(美国Thermo);-80 ℃冰箱(中国美菱);6色流式细胞仪(美国Cytek);C6 plus流式细胞仪(美国BD);GC气相色谱仪(美国Agilent)。
1.2 方法
1.2.1无菌脾脏单个细胞悬液 脱颈椎处死小鼠,75%酒精放置10 min,在超净工作台内取小鼠脾脏,放入无菌PBS中,用镊子拉碎,70目筛网过滤除去组织和团块,4 ℃、300 g离心 10 min,加入预冷的红细胞裂解液,充分混匀振荡,4 ℃静置5 min,4 ℃、300 g离心 10 min,去上清,适量无菌PBS重悬,获得无菌脾脏单个细胞悬液。

Fig 1 Time distribution of modeling and administration in cGVH mice
1.2.2动物分组及cGVH模型小鼠的建立 40只C57BL/6J小鼠被随机分为正常对照组,模型对照组,90% ω-3 PUFAs组,97% EPA组,每组10只。模型组、90% ω-3组以及97% EPA组小鼠均接受腹腔注射1×108个供体BM12小鼠脾脏悬液细胞,建立cGVH模型小鼠,正常对照组腹腔注射等体积PBS。从造模当天开始,90% ω-3 PUFAs组灌胃含90% ω-3多不饱和脂肪酸的乙酯型鱼油(4 g·kg-1·d-1),97% EPA组灌胃含97% EPA的乙酯型鱼油(4 g·kg-1·d-1),正常和模型对照组灌胃生理盐水,连续2周。于末次给药后d 2,所有小鼠均处死,进行免疫指标检测,并取实验小鼠的血样。小鼠模型建立和给药时间分布如Fig 1所示。
1.2.3流式细胞术分析 调整小鼠脾脏淋巴细胞数量为1×109个·L-1,先进行细胞表面染色,破膜后进行核内染色,洗涤后重悬细胞,上流式细胞仪检测。对于细胞内因子染色,各组细胞在培养的最后5 h内加入刺激阻断剂(2 mL·L-1),破膜后进行胞内染色,洗涤后重悬细胞,上流式细胞仪检测。
1.2.4ELISA检测 小鼠眼球取血,分离血清,采用ELISA法检测小鼠血清中总IgG水平。
敦礼睁开眼,仍然靠着靠背,先把右脚从被子里挪出来垂到床边,然后坐直身子,右手撑着床,左手把被角掀开,挪动了一下屁股,坐到床沿上,将双脚伸进床边摆放的一双灰色有暗花的棉拖鞋里。虽然一切动作都是极缓慢的,敦礼却感到力气被抽空了一样,他不得不停了一下,好使自己缓过劲儿来,然后,站在地上。敦礼觉得从头到脚都轻飘飘的,像一片纸,甚至是一缕风,举手投足完全没有一丝质感。脑子里的空洞又出现了。敦礼这次听到的不是草籽花的低吟浅唱,而是一首钢琴曲,感觉非常熟悉,一时却怎么也想不起来到底是什么曲子。
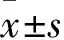
2 结果
2.1 ω-3 PUFAs对小鼠外周血中多不饱和脂肪酸含量和比例的影响气相色谱检测各组小鼠外周血中ω-3 PUFAs含量,结果如Tab 1所示。与PBS组相比,90% ω-3组和97% EPA组小鼠外周血中EPA含量明显高于PBS组(P<0.01),90% ω-3组和97% EPA组小鼠外周血中AA含量明显低于PBS组(P<0.01);90% ω-3组小鼠外周血中DHA含量明显高于PBS组中DHA的含量(P<0.01);而与PBS组相比,cGVH组小鼠外周血中ω-3 PUFAs含量差异没有统计学意义。此外,ω-6/ω-3 PUFAs的比例也发生了明显变化,PBS组、cGVH组、90% ω-3组和97% EPA组中二者比例分别为6.20、5.74、1.66和1.55。说明鱼油干预能够有效改变小鼠外周血中ω-6/ω-3 PUFAs的含量和比例,为进一步分析ω-6/ω-3 PUFAs对cGVH小鼠的影响奠定了基础。
2.2 ω-3 PUFAs对小鼠体重的影响cGVH小鼠造模后,会出现腹水现象,从而导致小鼠体质量增加。为了探讨补充ω-3 PUFAs对小鼠腹水的影响,小鼠造模后,ω-3 PUFAs连续灌胃2周,每2 d监测小鼠体质量变化。由Tab 2可以看出,与PBS组相比,cGVH组在造模后d 10、12、14,小鼠体质量明显高于PBS组(P<0.05);90% ω-3组在造模后d 12、14,小鼠体质量明显高于PBS组(P<0.05);97% EPA组在造模后d 12,小鼠体质量明显高于PBS组(P<0.05)。但与cGVH组相比,90% ω-3和97% EPA组小鼠体质量差异没有统计学意义。结果表明,小鼠造模后d 10开始出现腹水累积症状,而补充ω-3 PUFAs后,小鼠腹水产生被延后,但跟cGVH小鼠相比,发现ω-3 PUFAs并不能阻止cGVH小鼠腹水的形成。

Tab 1 Analysis of ω-3 PUFAs and ω-6 PUFA compositions and ratios in blood samples of mice n=10)

Tab 2 Effect of ω-3 PUFAs treatment on body weight change of mice n=10)

Fig 2 Effects of n-3 PUFAs on subsets of spleen T lymphocytes in mice
2.3 ω-3 PUFAs对小鼠脾脏T淋巴细胞亚群的影响
2.3.1对Treg细胞亚群影响 Treg具有抑制免疫应答、拮抗炎症因子作用。为了探讨补充ω-3 PUFAs对小鼠脾脏T淋巴细胞亚群的影响,脾细胞移植2周后,提取各组小鼠脾脏淋巴细胞,流式检测T细胞亚群百分比,结果显示:与PBS组相比,cGVH组明显下调Treg亚群比例(P<0.01),而97% EPA组明显上调Treg亚群比例(P<0.01)。而与cGVH组相比,90% ω-3和97% EPA组明显上调Treg亚群比例(P<0.01)(Fig 2A)。结果表明ω-3 PUFAs能够明显上调cGVH狼疮小鼠脾脏淋巴细胞Treg亚群比例。
2.3.2对TFH细胞亚群的影响 滤泡B辅助T细胞(TFH)细胞的主要功能是增加高亲和力B细胞和长寿浆细胞的形成,并帮助他们转移到发生中心(germinal center,GC)。为了探讨补充ω-3 PUFAs对小鼠脾脏淋巴细胞TFH亚群的影响,流式检测各组小鼠脾脏淋巴细胞TFH亚群百分比,结果显示:与cGVH组相比,90% ω-3组明显下调TFH亚群比例(P<0.01),但与97% EPA组的差异无统计学意义(Fig 2B)。结果表明ω-3 PUFAs能够明显下调cGVH狼疮小鼠脾脏淋巴细胞TFH亚群比例。

Fig 3 Effects of n-3 PUFAs on subsets of spleen B lymphocytes in mice
2.4 ω-3 PUFAs对小鼠脾脏B淋巴细胞亚群的影响
2.4.1对GC B细胞亚群影响 GC是在自身免疫疾病中产生自身抗体的主要致病区域。为了探讨补充ω-3 PUFAs对小鼠脾脏B淋巴细胞GC B亚群的影响,流式检测各组小鼠脾脏淋巴细胞GC B亚群百分比,结果显示:与PBS组相比,cGVH组GC B亚群显著上调,但与cGVH组相比,90% ω-3和97% EPA组明显下调GC B亚群比例(P<0.01)(Fig 3A)。结果表明ω-3 PUFAs能够明显下调cGVH狼疮小鼠脾脏淋巴细胞GC B亚群比例。
2.4.2对浆细胞亚群影响 浆细胞是免疫系统中释放大量抗体的一种B细胞。我们分析了ω-3 PUFAs干预的cGVH小鼠脾脏中浆细胞亚群的变化。结果显示,与cGVH组相比,90% ω-3和97% EPA组明显下调浆细胞亚群比例(P<0.01),且97% EPA组浆细胞亚群比例与PBS组持平(Fig 3B)。结果表明ω-3 PUFAs能够明显下调cGVH狼疮小鼠脾脏淋巴细胞浆细胞亚群比例。
2.5 ω-3 PUFAs对小鼠血清中总IgG含量影响ELISA检测cGVH小鼠血清中总IgG结果表明:与PBS组相比,造模组小鼠血清中总IgG含量均明显增加,但与cGVH组相比,97% EPA组小鼠血清中总IgG含量明显减少(P<0.05),与90% ω-3组的差异无统计学意义(Fig 4)。结果表明高含量EPA能够减少cGVH狼疮小鼠血清中总IgG含量,缓解cGVH狼疮小鼠病症。

Fig 4 Levels of serum IgG in cGVH mice (n=8) ##P<0.01 vs PBS; *P<0.05 vs cGVH.
3 讨论
研究显示,我国SLE的患病率估计为50~100/10万人,远高于欧洲和北美国家的 10~35/10万人[10]。SLE可能与人群的遗传、地理环境和激素刺激等多种因素有关,但参与SLE确切的细胞和分子机制仍然知之甚少。现在,对遗传易感性的最新研究表明,环境触发因素通常是通过与疾病相关多态性的细胞途径起作用的。目前,有关SLE的免疫系统激活的特征是B细胞和T细胞过度增殖,以及对自身抗原的免疫耐受性丧失[11]。
因此,抑制T、B细胞增殖,进而减少自身抗体产生成为SLE治疗的重要方向。目前,T、B细胞相关抑制剂用于治疗SLE的药物主要有Cyclophosphamide、Cyclosporine、Mycophenolate mofetil等。近年来,更是出现一些生物制剂,如Belimumab、Rituximab等单抗,能够靶向B淋巴细胞刺激因子,抑制B淋巴细胞增殖和活化[11]。但传统治疗药物伴随着严重的副作用,而生物制剂物价格昂贵,且越来越多的研究发现生物制剂的局限性,不同的细胞因子和细胞可能在不同的阶段、不同的临床表现中发挥不同的作用[11]。
有研究表明,补充高剂量ω-3 PUFAs可以抑制自发性系统性红斑狼疮MRL/lpr小鼠淋巴细胞增殖且延后肾脏疾病的发生,并从而延长其生存期[9]。Das等[12]研究报道口服补充EPA和DHA可延长SLE的缓解期,且无任何副作用。
在大多数鱼油研究中,主要使用了ω-3 PUFAs混合形式进行研究,而对EPA和DHA的作用尚未进行区分,尽管鱼油中含有大量的DHA,但鱼油的有利作用主要归因于EPA。而近年来越来越多的研究聚焦于ω-3 PUFAs中关键成分EPA对各种疾病的影响。有研究已证明纯化的EPA(而非DHA)具有潜在的抗动脉粥样硬化性抗氧化剂和膜稳定作用[13]。为了探讨ω-3 PUFAs混合形式和纯化EPA在狼疮小鼠模型中是否发挥不同的免疫调节作用,本研究首次利用高含量ω-3 PUFAs和EPA对BM12小鼠脾脏淋巴细胞诱导的cGVH狼疮小鼠模型进行干预,探讨了ω-3 PUFAs混合形式和纯化EPA对cGVH狼疮小鼠T、B淋巴细胞亚群分化的影响。
在自身免疫疾病中,T、B免疫细胞参与SLE的发病。Treg细胞能够抑制自身免疫,保护组织免受损伤[14]。有研究报道,SLE患者Treg水平降低,与SLE疾病活动指数有关[15]。而Carlsson等[16]发现ω-3 PUFAs能够上调Treg水平。本课题组在Ⅰ型糖尿病模型中的前期结果也证实了ω-3 PUFAs对Treg的上调作用[5]。本研究结果提示,ω-3 PUFAs在cGVH狼疮小鼠体内能够通过明显上调Treg亚群来纠正SLE免疫细胞和因子之间的平衡关系。
TFH细胞对生发中心的形成具有重要作用,一旦生发中心形成,就需要TFH细胞维持生发中心,并调节生发中心B细胞向浆细胞和记忆B细胞的分化。在狼疮小鼠中,疾病发展伴随着TFH细胞数量增加[15]。本研究发现ω-3 PUFAs在cGVH狼疮小鼠体内能够显著下调TFH亚群,干预B细胞向浆细胞的分化的进程,从而延缓SLE的进展。
本研究结果显示,ω-3 PUFAs改变cGVH狼疮小鼠体内B淋巴细胞亚群分化百分比,它可以显著下调GC B和浆细胞亚群。B细胞亚群的比例与自身抗体的产生有一定的相关性,在SLE患者中,B细胞发育阶段以及浆母细胞/浆细胞在免疫调节中发挥重要的作用。有研究表明,给C57BL/6J小鼠喂食3周高剂量的ω-3 PUFAs,B细胞脂筏聚集减少[17]。有研究发现SLE患者血清IgG水平升高,并与疾病严重程度相关[18]。而本研究结果证实,97% EPA组cGVH狼疮小鼠血清中总IgG水平显著降低,说明高含量EPA可以降低狼疮小鼠血清IgG水平,缓解狼疮小鼠的临床表现。
以上研究结果提示,T、B淋巴细胞亚群在SLE发生、发展中发挥着重要作用,高含量ω-3 PUFAs通过调节T、B淋巴细胞亚群减轻cGVH狼疮小鼠的免疫失衡,具有突出的免疫调节作用,这对于高含量ω-3 PUFAs用于SLE治疗或辅助治疗具有指导意义,但ω-3 PUFAs能否通过调节免疫平衡而影响SLE终末期器官损伤,还有待进一步的研究。

