微生物甲壳素酶的研究进展及应用现状
包雍宏,吴 琛,王秀文,时文悦,宋元达
(山东理工大学,山东淄博 255000)
甲壳素由N-乙酰氨基葡萄糖残基经过β-1,4 糖苷键聚合而成的线性多糖[1]。全球每年产生甲壳素约1 000亿t,产量仅次于纤维素,是自然界中含量第二丰富的天然多糖,被现代科学誉为“第六生命要素”[2]。甲壳素主要存在于各种无脊椎动物的细胞外基质中,包括海绵、软体动物、线虫、节肢动物和真菌等[3],它是保护和支持细胞外基质的重要组成部分,包裹覆盖整个组织或生物体。甲壳素发现较早,可追溯到200 年前。法国学者Braconot[4]在1811 年从Agaricusvolvaceus、Hydnumrepandum等真菌中发现了同时含有氮和乙酰基的物质。Odier 在1823 年从甲壳类动物的外壳中分离出具有相似性质的物质,将其命名为“甲壳素”。甲壳素为白色或淡黄色片状固体,其分子间的氢键作用很强,具有很好的化学稳定性。甲壳素难溶于普通试剂,这严重限制了甲壳素的应用,目前发现的较好的甲壳素溶剂有浓硫酸、浓盐酸、浓磷酸、氢氟酸、浓NaOH、KOH 溶液和一些特殊的溶剂(如氯化锂/N,N-二甲基乙酰胺、六氟异丙醇/六氟丙醇、三氟醋酸等)。
自然界中的甲壳素可被微生物降解成多糖,被其他生物利用,维持生态系统的碳氮循环。因此,甲壳素的降解代谢对全球的碳和氮循环具有重要意义,而维持这种循环离不开甲壳素降解菌和甲壳素酶。甲壳素酶(chitinase,EC 3.2.1.14)是一种可以专一性水解甲壳素为低分子糖的酶,主要作用于甲壳素中的β-1,4 糖苷键。1905 年,BENECKE 等[5]研究芽孢扦菌(Bacilluschitinovrous)分解甲壳素酶的过程中,首次发现并分离出一类糖苷水解酶,可催化水解甲壳素为N-乙酰氨基葡萄糖聚体或单体。随着研究的深入,人们逐渐发现甲壳素酶广泛分布于自然界中的真菌、细菌以及放线菌中,同时在昆虫、甲壳类动物、高等植物甚至病毒中都有发现。本文介绍了微生物甲壳素酶的分类和分布情况,总结了近年来微生物甲壳素酶的相关研究及其在不同行业的应用前景。
1 甲壳素的降解系统
1.1 自然界中甲壳素生物降解的作用
甲壳素的生物降解系统与许多生物的生长和生存相关。对于不含甲壳素的细菌,甲壳素的生物降解系统可以为其提供碳源和氮源[6];对于以甲壳素为结构支架的生物,甲壳素降解系统能够降解甲壳素为其结构组分的代谢提供原材料;对于一些含甲壳素的生物体,该系统还能够帮助其抵抗很多病虫的侵害[7]。
1.2 细菌降解甲壳素的主要步骤
自然界中的甲壳素主要是由细菌降解的。细菌降解甲壳素主要包括三个步骤:分解结晶的甲壳素,将甲壳素链水解成二聚体,最后将二聚体水解成单体[8]。在细胞外环境中,前两个步骤通常由裂解性多糖单氧酶(LPMO)、内作用非加工性甲壳素酶和加工性甲壳素酶三种类型的酶催化。LPMO 在CAZy(碳水化合物活性酶)数据库中被归类为辅助活性(AA)10 和11 家族,可以通过氧化反应切割结晶甲壳素表面的糖苷键,并引入氧化末端来促进其他分泌性甲壳素酶进一步降解甲壳素[9]。甲壳素酶通常会受到N-乙酰氨基葡萄糖胺(GlcNAc)的诱导和调节,这是甲壳素的水解产物,或甲壳素低聚物(GlcNAc)n,其中n=2~6。Miyashita 等[10]在研究中发现,GlcNAc 可以作为链霉菌(Streptomyces)和拟杆菌(Paenibacillus)甲壳素酶表达的抑制物。图1 显示了甲壳素降解为低聚糖、壳聚糖和N-乙酰葡萄糖胺;而甲壳素多糖在细胞外被水解成单体或低聚合物后,产物会通过有效的摄取途径进入细菌的周质或细胞质中,其中甲壳素低聚物会被β-N-乙酰己糖胺酶继续水解为GlcNAc。同时在一些菌株中,磷酸烯醇式丙酮酸依赖的磷酸转移酶系统(PTS)和ATP 结合盒(ABC)转运体分别负责GlcNAc 单体和寡聚物的摄取[11-12]。
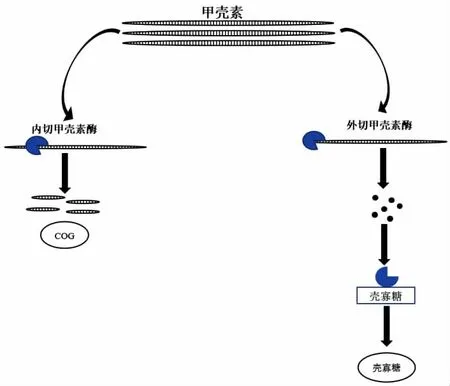
图1 甲壳素降解为低聚糖(COG)、壳聚糖和N-乙酰葡萄糖胺(GlcNAc)Fig.1 Degradation of chitin to COG,chitosan and GlcNAc
研究发现,不同甲壳素降解菌所产生的甲壳素酶的核苷酸序列具有高度保守性,例如粘质沙雷氏菌、芽孢杆菌、霍乱弧菌等产生的甲壳素酶。这种现象被称作遗传保护,可以解释为单细胞中的多个基因在一个细胞中重复,同时,也有一些细菌产生的甲壳素酶的基因簇具有独特的氨基酸序列。
2 甲壳素酶的分类与分布
2.1 甲壳素酶的分类
甲壳素酶(chitinase,EC 3.2.1.14)是一种可以将甲壳素专一水解为低分子糖的酶(图2),主要作用于甲壳素中的β-1,4 糖苷键。在CAZy 数据库中,甲壳素酶归属于糖苷水解酶18 家族(GH18)和19 家族(GH19)以及20家族(GH20),它们在氨基酸序列、催化结构域以及蛋白质的3D 结构等方面具有较大差异。GH18 家族的甲壳素酶分布最为广泛,在病毒、细菌、植物和动物中都有发现。而GH19 家族的甲壳素酶主要存在于植物中,但在细菌、病毒、线虫中也有发现。根据序列的相似性,甲壳素酶可以被分为5 类(Ⅰ~Ⅴ)。第Ⅰ类甲壳素酶的催化结构域最为保守,在N 端有一个富含半胱氨酸的结构域。第Ⅱ类与第Ⅰ类的催化结构高度相似,但在N 端缺少一个富含半胱氨酸的结构[13]。第Ⅲ类与前两类没有任何相似之处,第Ⅳ类甲壳素酶与第Ⅰ类相似,但由于缺失了四个催化结构域,所以比第Ⅰ类要小很多。第Ⅴ类与其他任何一类甲壳素酶都没有相似性。其中Ⅲ类和Ⅴ类甲壳素酶属于GH18 家族,Ⅰ、Ⅱ和Ⅳ类属于GH19 家族。GH18 家族甲壳素酶可以将甲壳素水解成较短的(GlcNAc)2和(GlcNAc)3片段,再经由β-N-乙酰-D-己糖胺酶进一步水解成单糖(GlcNAc)。GH18 家族还可进一步分为甲壳素酶以及非酶活性的甲壳素酶样凝集素和甲壳素酶样蛋白质。
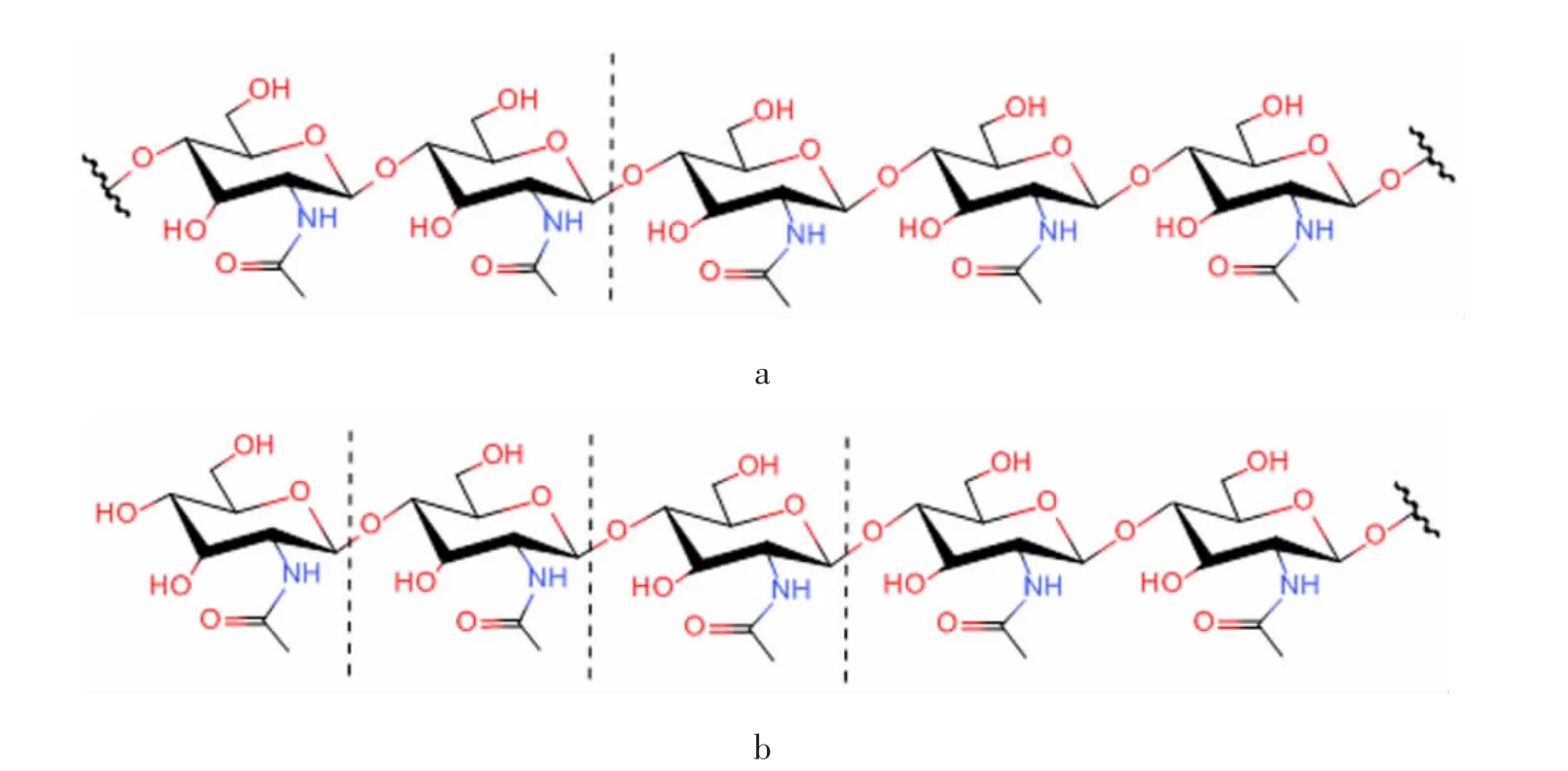
图2 甲壳素酶水解甲壳素类型Fig.2 Types of chitinase hydrolysis of chitin
按照产物和底物作用部位的不同,甲壳素酶又可被分为内切甲壳素酶和外切甲壳素酶。迄今为止,内切甲壳素酶主要来源于GH18 和GH19 两个糖苷水解酶家族,而外切甲壳素酶主要来源于GH18 和GH20[9]。内切甲壳素酶(EC 3.2.1.14)内部任意位置开始水解甲壳素链,随机生成GlcNAc 的低寡单位,如壳三糖、壳二糖和二乙酰壳二糖。外切甲壳素酶(EC 3.2.1.52)从甲壳素链的非还原端开始裂解甲壳素。外切甲壳素酶(EC 3.2.1.52)又被进一步分为两类,甲壳糖苷酶和β-N-乙酰-D-己糖胺酶。甲壳糖苷酶从甲壳素链的非还原端催化水解甲壳素并释放出二乙酰基壳二糖,β-N-乙酰-D-己糖胺酶则会将由内切甲壳素酶水解产生的低聚GlcNAc 切割成GlcNAc 单体[14]。
2.2 甲壳素酶的分布
甲壳素酶广泛存在于各种病毒、昆虫、植物和脊椎动物中,并具有各种生理功能,如形态发生、致病、寄生和防御等[15]。在昆虫和甲壳类动物中,甲壳素酶的主要作用是在发育过程中分解旧角质层以重塑外骨骼,从而保持和支撑生物的形体大小和形状。对于一些以甲壳素为营养来源(如细菌)或以含有甲壳素的物质为食物的生物(如脊椎动物),甲壳素酶的主要功能是降解甲壳素提供碳源和能量。除此之外,甲壳素酶还参与拮抗作用。对于真菌而言,甲壳素酶不仅参与提供营养,还在与真菌寄生相关的自溶和形态发生功能中起重要作用。由于甲壳素酶可以降解病原体的保护膜,所以对于植物而言,甲壳素酶可以保护其免受真菌感染以及病虫危害,增强植物的抗性[16]。
在UniProt(蛋白序列)数据库中,甲壳素酶具有3 967 个细胞生物蛋白质序列、5 个病毒来源的蛋白质序列和406 个亚基因组(https://www.uniprot.org/)。表1 对于目前已报道过的具有某些特征的微生物来源的甲壳素酶进行了总结。由表知,自然界中,细菌是甲壳素的主要降解者。大多数细菌甲壳素酶属于GH18 家族,主要来源于粘质沙雷氏菌属(Serratia marcescens)、链霉菌属(Streptomyces)、芽孢杆菌属(Bacillus)、类芽孢杆菌属(Paenibacillus)等。真菌来源的甲壳素酶同样属于GH18家族,子囊菌门的真菌是其主要来源。
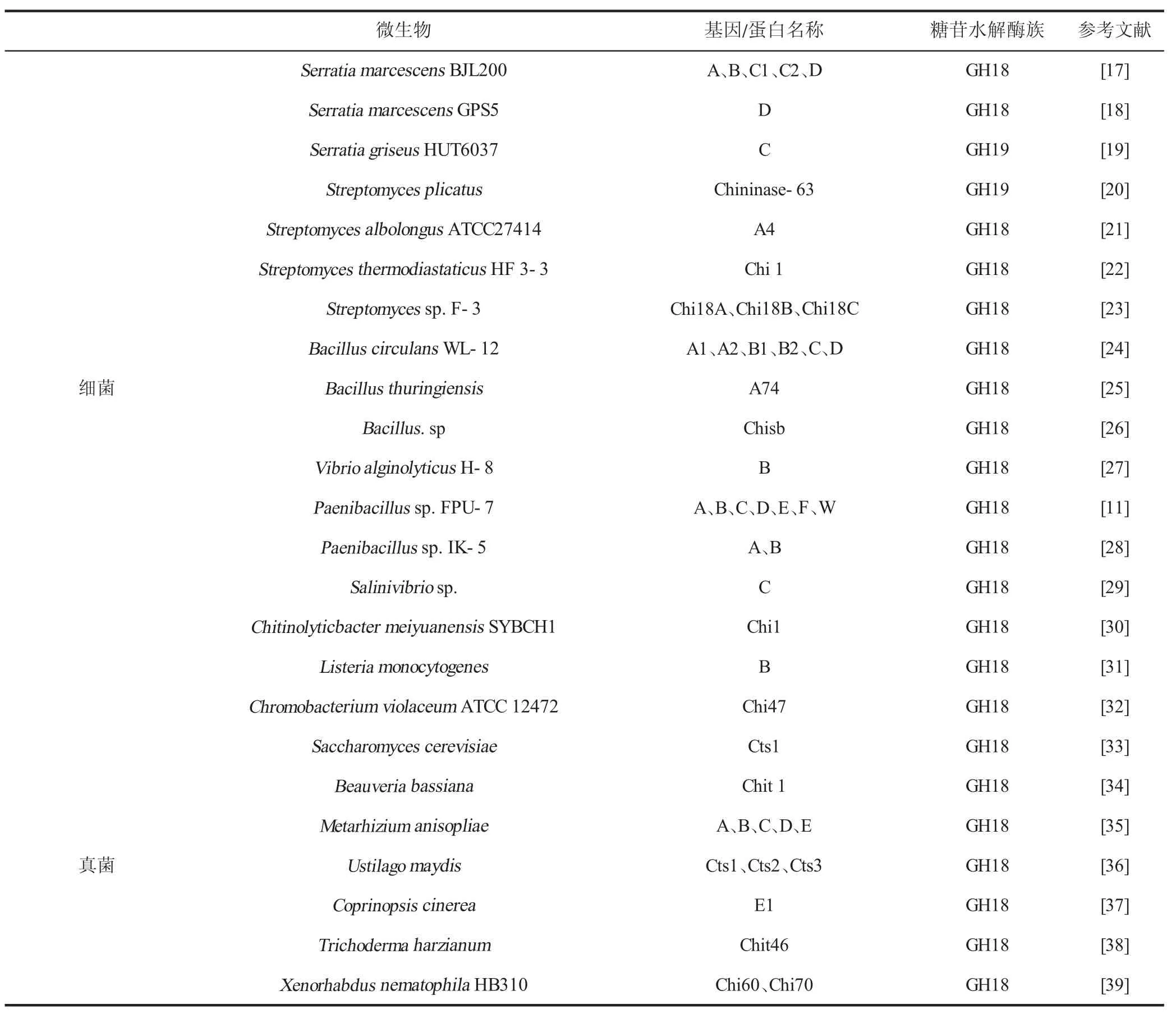
表1 不同微生物来源的甲壳素酶Table 1 Chitinase from different microbial sources
3 甲壳素酶的生产优化
3.1 优化发酵条件提高甲壳素酶产量
大多数微生物甲壳素酶是诱导酶,只在甲壳素或甲壳素衍生物等底物诱导下才能合成甲壳素酶[40]。此外,微生物甲壳素酶还受一些营养和环境因素的影响,其中营养因素包括碳、氮源以及一些有机盐和无机盐,环境因素包括温度、pH、搅拌速度和发酵时间等。研究表明,微生物法制备甲壳素酶的最适温度一般在28~30 ℃,最适初始pH 为5.0~9.0,底物浓度为1.5%~2.0%。国内外研究证实,不同菌株在发酵条件及抑制因素等方面存在较大的差异。
有研究人员使用“单因素法”对微生物培养基的成分和影响甲壳素酶生产的环境因素进行了优化,以提高其活性和分泌量。如Gomaa 等[41]在研究中使用胶体甲壳素和酪蛋白作为碳源和氮源,在30 ℃下培养了5d,使苏云金杆菌(B.thuringiensis)和地衣芽孢杆菌(B.licheniformis)的甲壳素酶产量与活性大大提高。Alhasawi等[42]在将甲壳素粉末作为补料的培养基中培养荧光假单胞菌(Pseudomonas fluorescens),其中6 d 培养时间获得的甲壳素酶产量最高。Sukalkar 等[14]通过研究发现,大孢子链霉菌M1(Streptomyces macrosporeus)生产甲壳素酶的最佳培养基组成是胶体甲壳素、KNO3、CaSO4,最佳培养条件为pH 6,40 ℃、72 h,此条件下甲壳素酶的产量与对照组相比提高了2.62 倍。
3.2 利用生物工程技术提高甲壳素酶产量
野生型菌株甲壳素酶产量低、活性不高,这极大地限制了甲壳素资源的高效利用。因此,现阶段关于甲壳素酶的研究重点在获得更高的产量以及提高其催化活性上。除了利用分离培养和环境宏基因组学方法筛选新型甲壳素酶降解菌和甲壳素酶,并对其发酵条件进行优化外,结合外源表达和蛋白质工程的实验方法也对阐明特定结构或氨基酸残基的功能、提高酶活性及产量提供了重要信息,并取得了一定进展。
3.2.1 外源表达
外源表达是提高靶蛋白产量的有效策略。其中大肠杆菌(Escherichia coli)[43]、枯草芽孢杆菌(Bacillus subtilis)[44]及毕赤酵母(Pichia pastoris)[45]是甲壳素酶应用最为广泛的表达系统,因为它们具有生长速度快、发酵周期短、易于遗传操作、重组蛋白分泌能力强等优点。Mengyan 等[46]采用一系列分子生物学方法提高了甲壳素酶在枯草芽孢杆菌DAU101 中的表达,包括加入信号肽使甲壳素酶成功分泌到细胞外,进一步优化核糖体结合位点和间隔序列,以及结合分子对接技术与定点突变技术,将甲壳素酶的表达水平和比活力分别提高至51.67、249.62 U/mg。
3.2.2 蛋白质工程
蛋白质工程主要包括定向进化、定点突变和结构域融合,是在已知甲壳素酶的基础上进行改造和优化的重要途径。其中定向进化是通过对易出错的PCR 进行随机突变,建立突变文库,进行高通量筛选,高效挑选出具有更高活性的突变体。Songsiriritthigul 等[47]利用该方法将地衣芽孢杆菌甲壳素酶的催化效率提高了2.7 倍。Kidibule等[45]通过定向进化的方法获得了甲壳素酶突变体并利用枯草芽孢杆菌作为外源表达系统,获得了高产胞外甲壳素酶工程菌株,其酶比活力最高提升了16.89 倍,达到(1 004.83±0.87)U/mg。
定点突变是一种提高甲壳素酶性状的重要手段。Ni等[48]结合同源模拟、分子对接和定点突变,构建了苏云金芽孢杆菌(Bacillus thuringiensis)甲壳素酶突变体,使突变体酶活性提高了60%以上,并表现出抗虫和抗真菌活性。Emruzi 等[49]通过G191V 定点突变显著提高了粘质沙雷氏菌B4A 甲壳素酶的稳定性,使其在50 ℃和60 ℃条件下,分别提高了约5、15 倍。
结构域融合也是一种提高甲壳素酶活性的手段。结构域融合通过增强甲壳素酶和底物的结合,从而提高其活性。Takashim 等[50]将GH18 催化域和N-末端LysM结构域进行融合,形成融合蛋白。实验结果表明,融合蛋白的甲壳素酶水解效率明显高于单催化结构蛋白。Neeraja等[51]将甲壳素酶催化域和CBM融合,提高了甲壳素酶对底物的亲和性、酶活性和构象稳定性。
4 甲壳素酶的应用
4.1 农业
在现代农业中,造成作物产量损失的重要因素之一是由细菌、真菌、昆虫引起的疾病,其中真菌是植物病变的主要原因,占作物病害的70%以上。大多数植物病原菌的细胞壁主要成分是甲壳素,甲壳素酶可以通过控制真菌的孢子萌发以及菌丝体的生长来发挥其防御作用,因此被认为是控制真菌病原菌最有效的制剂之一,被广泛用于保护农作物免受真菌感染侵害。如由苏云金芽孢杆菌(Bacillus thuringiensis)产生的甲壳素酶对引起马铃薯茎块干腐的玫瑰镰刀菌(Fusarium roseum)有明显的抑制作用[52]。El-Shora 等[53]发现枯草芽孢杆菌(Bacillussubtilis)MN548732.1 产生的甲壳素酶对尖孢镰刀菌(Fusarium oxysporum)、茄病镰刀菌(Fusarium solani)、茄丝核菌(Rhizoctonia solani)、米曲霉(Aspergillus oryzae)、米根霉(Rhizopus oryzae)和里氏木霉(Trichoderma reesei)有明显的抑制作用。
农业害虫也是造成作物损失的重要因素,目前,化学农药杀虫剂被广泛用于控制农业害虫,然而化学农药毒性大,大量使用会污染环境,损害人类和其他生物的健康。生物杀虫剂具有低毒性、生物降解性高、环境友好型等优点,其中微生物甲壳素酶是研究热点。研究表明,甲壳素酶可以水解昆虫幼虫中肠围食膜中的甲壳素成分,从而加速杀虫剂侵染中肠上皮细胞,提高幼虫的死亡率[54]。Suganthi 等[55]在其研究中发现,由荧光假单胞菌(P.fluorescens)MP-13 产生的甲壳素酶对茶蚊(TMB)的致死率高达100%。
4.2 医药
甲壳素酶可以作为制剂应用于医药学领域,其可以与某些物质或微生物整合并具有协同作用,表现出强大的抑菌效果。目前,许多眼科制剂就是由甲壳素酶与微生物抑制剂合成。Halder 等[56]在研究中指出,抗真菌物质与甲壳素酶整合可以有效治疗多种真菌感染。Allonsius等[57]通过研究发现,甲壳素酶与乳酸菌,特别是干酪乳酸菌(Lactobacillus casei)具有明显的协同作用,可以有效抑制白色念珠菌(Candida albicans)的生长。此外,甲壳素酶还具有抗癌作用。Xing 等[58]在研究中发现,来自灰链霉菌和粘质沙雷氏菌的甲壳素酶可以破坏小鼠的MCF-7 和B11-2 癌细胞。Abu-Tahon 等[59]发现,绿色木霉(Trichoderma viride)AUMC13021产生的甲壳素酶对MCF7和HCT-116 细胞具有细胞毒性,IC50值分别为20、40 μg/mL。
4.3 食品
甲壳素酶因其良好的抑制真菌作用,可以用于食品保鲜,具有可行性高、节约成本、节约时间等优点。甲壳素酶能破坏真菌细胞壁,抑制孢子萌发,从而延缓食物变质。Le 等[60]发现盐生弧菌(Salinivibriosp.)产生的甲壳素酶具有较高的抗真菌能力,且安全无害,可用于食品保鲜。Deng等[61]证实了来自哈茨木霉(Trichodermaharzianum)的甲壳素酶能够有效抑制灰曲霉(Botrytis cinerea)的生长,且对人体无害,可用于食品保鲜。从这些研究中可以得出,甲壳素酶能够作为一种有效且有前途的食品贮藏保鲜物质。
甲壳素酶和甲壳素材料还被广泛用于生产单细胞蛋白。单细胞蛋白(SCP)是一种高价值的蛋白质来源,可代替鱼肉和豆粕成为新的蛋白质来源。Tom 等[62]发现从黏质沙雷氏菌(Serratia marcescens)中分离出来的甲壳素酶可以水解甲壳素作为营养物质用于毕赤酵母(Pichia kydriavzevii)发酵产单细胞蛋白(45%蛋白质和8%~11%核酸)。Vyas 等[63]用产自疣状黏菌(Myrotheciumverrucaria)的甲壳素酶处理甲壳素,并将甲壳素水解物用作酿酒酵母(Saccharomyces cerevisiae)NCIM3052 生产单细胞蛋白(SCP)的底物。
5 总结与展望
甲壳素酶是一类应用前景广阔的生物酶,能有效用于生物防治、医药化工及食品加工等领域。现阶段,自然分离的甲壳素酶存在活性低、热稳定性差,且甲壳素酶的纯化过程繁琐、产量低,缺乏大规模工业化生产的条件。但随着在菌种选育及产酶条件优化等方面的进一步研究,同时随着热稳定微生物甲壳素酶分子结构、催化机理和其基因水平调控机理研究的进一步深入,微生物甲壳素酶终将实现标准化的大规模生产,应用领域也将进一步扩大,并具有越来越广阔的市场发展前景。

