低盐泡菜中耐酸性乳酸菌的筛选、鉴定及特性研究
孙熙浛 崔承弼, 齐仕博 齐 欣
(1. 延边大学农学院,吉林 延吉 133002;2. 延边大学药学院,吉林 延吉 133002)
泡菜又名发酵蔬菜、腌渍菜,是将新鲜蔬菜经低浓度盐水或少量盐腌渍而成,其优势益生菌群主要以乳酸菌为主[1-2]。高盐饮食是导致死亡的危险元素[3],因此,减少盐分摄入是维护身体预防慢性病的重要手段。
乳酸菌(Lactic acid bacteria,LAB)是一类能利用可发酵碳水化合物产生大量乳酸的细菌的统称[4]。泡菜发酵期间,微生物菌群不断更替,乳酸菌会伴随原辅料、盐浓度和发酵条件等因素的变化而不同。只有耐受低pH、酸性强的环境且数量多、活力强的乳酸菌才能在肠道中发挥生物功效,进而在人体内发挥益生作用[5]。赵山山等[6]从贵州遵义市自制泡菜中筛选得到11株产酸量较高、耐酸性能优良的乳酸菌,具有潜在的益生特性。冯金晓等[7]从6个泡菜样品中,筛选得到2株耐酸性较强的乳酸菌。此外,乳酸菌还能够保护肠道健康,提高绒毛密度[8]。
研究拟选取四川、河北和东北地区的低盐泡菜,筛选出耐酸性优良的菌株,进行形态学、生理生化鉴定及16S rDNA 分子种属鉴定并将其命名,测定菌株的生长曲线、耐酸产酸能力、耐受胃肠液能力、耐胆盐能力、疏水及自凝集能力,通过综合比对,筛选出具有益生特性的耐酸性乳酸菌菌株,为益生菌制剂的研发提供依据。
1 材料与方法
1.1 材料与仪器
1.1.1 材料与试剂
14份泡菜样品:分别为萝卜泡菜、洋姜泡菜、白菜泡菜、红椒泡菜、东北酸菜,来自于四川、河北和东北地区,市售;
MRS琼脂培养基、MRS肉汤培养基:青岛高科园海博生物技术有限公司;
胃蛋白酶:北京奥博星生物技术有限责任公司;
胰蛋白酶:MYM Biological Technology Company, USA;
牛胆盐:广东环凯威微生物科技有限公司;
碳酸钙、丙三醇、氯化钠:分析纯,天津科密欧化学试剂有限公司;
革兰氏试剂盒:青岛青药生物工程有限公司。
1.1.2 仪器与设备
台式离心机:TGL-16M型,湖南湘仪实验室仪器开发有限公司;
分析天平:PWC124型,上海民桥精密科学仪器有限公司;
立式压力蒸汽灭菌:BXM-30R型,重庆雅马拓科技有限公司;
雷磁pH计: PHS-25型,上海仪电科学仪器股份有限公司;
电热恒温培养箱: YM-666型,上海新苗医疗设备有限公司;
多功能荧光酶标仪:SP-Max 3500FL型,上海闪谱生物科技有限公司;
显微镜:GX53型,德国Leica公司。
1.2 方法
1.2.1 泡菜盐度及pH值的测定
(1) 盐度:参照彭易涛[9]的方法。
(2) pH值:按:GB 5009.237—2016执行。
1.2.2 菌株的分离与纯化 选取含盐量≤6%的泡菜,用生理盐水按倍比稀释法,将菌液涂布至2% CaCO3-MRS琼脂平板上,37 ℃厌氧培养48 h,根据呈现的形态特征挑选菌落,反复进行平板划线分离与纯化,直至出现纯菌落。
1.2.3 耐酸性菌株的筛选与初步鉴定 在pH 4.0的MRS液体培养基中接种2%的供试菌悬液,37 ℃恒温培养24 h,选取产生菌体沉淀生长状况良好的菌株放入pH 3.0,2.0的液体培养基中进行重复筛选。将生长较为旺盛的菌株通过梯度稀释后涂布于MRS琼脂培养基上,37 ℃恒温培养24 h,观察菌落形状、大小、颜色等特征并进行革兰氏染色和过氧化氢酶试验。
1.2.4 16S rDNA分子鉴定 将分离纯化的菌株送检至生工生物工程(上海)股份有限公司,采用Ezup柱式细菌基因组DNA抽提试剂盒提取鉴定菌株基因组DNA,得到16S rDNA基因组片段序列后,进行BLAST序列比对。将获得的基因组DNA进行核酸电泳验证,加入通用引物进行PCR扩增,正向引物为27f:5'-AGTTTGATCMTGGCTCAG-3';反向引物为1492R:5'-GGTTACCTTGTTACGACTT-3'。PCR扩增条件:94 ℃预变性4 min;94 ℃变性45 s,55 ℃退火45 s,72 ℃延伸1 min,共30个循环;72 ℃延伸10 min,4 ℃保存。将PCR扩增产物测序、双向拼接后,用BLAST模块在NCBI上对比同源性,使用Megalign程序绘制系统发育树并进行分析。
1.2.5 耐酸性菌株的生物学性质测定
(1) 生长曲线:在MRS液体培养基中按2%接种待测菌株,37 ℃静置培养,隔2 h取样,共培养24 h,用空白培养基作为对照组,测定OD600 nm值,绘制5株菌株的生长曲线。
(2) 酸耐受能力:在10 mL pH值分别为4.0,3.0,2.0的MRS肉汤培养基中,以2%接种量接入待测菌株,37 ℃ 恒温培养,测定0,24 h的OD600 nm值,用空白培养基作对照,按式(1)计算相对生长率。
(1)
式中:
R——相对生长率,%;
a——培养24 h后菌株在pH 6.3培养基中的OD600 nm值;
b——培养0 h后菌株在pH 6.3培养基中的OD600 nm值;
c——培养24 h后菌株在不同pH培养基中的OD600 nm值;
d——培养0 h后菌株在不同pH培养基中的OD600 nm值。
(3) 产酸活力:将菌株以2%的接种量接至MRS液体培养基中,37 ℃培养,向10 mL菌液中滴加酚酞指示剂,以0.1 mol/L的NaOH溶液进行滴定,直至出现微红色,静止30 s,观察有无褪色现象,记录消耗NaOH的体积[10]。产酸活力以每1×107个细胞,发酵1 mL MRS肉汤培养基得到1 μg乳酸为1个活力单位(U)。
1.2.6 耐酸性菌株的体外益生特性测定
(1) 模拟胃液耐受能力:取待测菌液,4 ℃、7 000 r/min离心8 min,用1×PBS缓冲液洗涤后悬浮菌体。取供试菌悬液各1 mL分别接种于9 mL pH值分别为4.0,3.0,2.0的人工胃液中,37 ℃恒温培养3 h,测其活菌数,按式(2) 计算存活率[11]。
(2)
式中:
S——菌株存活率,%;
N0——菌株初始的活菌数,CFU/mL;
N1——菌株处理后的活菌数,CFU/mL。
(2) 模拟肠液耐受能力:取1 mL经人工胃液消化3 h 的菌液,接种至9 mL pH值为8.0的人工模拟肠液中,恒温水浴培养8 h,测其活菌数,按式(2)计算存活率。
(3) 模拟胆盐耐受能力:取2%培养至对数生长中后期的菌液,接种至含0.3%胆盐的MRS-THIO培养基中,120 r/min、37 ℃摇床培养0,2,4,6,8 h,设置未添加胆盐的MRS-THIO培养基作为空白对照组,测定OD600 nm值,按式(3)计算菌株存活率[12]。
(3)
式中:
S——菌株存活率,%;
A0——不含胆盐培养基的OD600 nm值;
A1——含胆盐培养基的OD600 nm值。
(4) 疏水能力:取待测菌液,4 ℃、7 000 r/min离心8 min,收集菌泥,用1×PBS缓冲液洗涤,使菌体OD600 nm值为0.25±0.05,向试管中加入2 mL菌悬液、二甲苯并充分振荡,涡旋振荡2 min,于通风橱静置待其分层,分别测水相OD600 nm值,以不添加二甲苯的菌液作为空白对照组,按式(4)计算菌株的疏水率[13]。
(4)
式中:
H——疏水率,%;
A0——二甲苯混合前菌液的OD600 nm值;
A——二甲苯混合后菌液的OD600 nm值。
(5) 自凝集能力:取待测菌液,4 ℃、4 000 r/min离心8 min,收集菌泥,用1×PBS缓冲液洗涤,使其菌体OD600 nm值为0.25±0.05,37 ℃静止后吸取上清液,设置1×PBS缓冲液作为空白对照组,测定时间分别为0,2,4,6,8,12,16,24 h,测定OD600 nm值,按式(5)计算菌株的自凝集率[13]。
(5)
式中:
A——自凝集率,%;
A0——0 h的OD600 nm值;
At——t时刻的OD600 nm值。
1.2.7 数据处理 所有试验重复3次,以平均值±标准差表示,利用Origin 8.5软件作图,运用SPSS 22.0软件进行单因素方差分析,P<0.05表示有统计学意义。
2 结果与分析
2.1 理化指标检测
由表1可知,14份样品的含盐量为0.87%~9.48%,符合行业标准。陈功[14]研究表明,按盐度不同可将泡菜分为超低盐泡菜(食盐量≤3%)、低盐泡菜(食盐量≤6%)和中盐泡菜(食盐量≤10%)。因此,A、D是中盐泡菜,B是低盐泡菜,其他均为超低盐泡菜,是因为不同地区泡菜的原材料和制作方式不同。泡菜的pH值为2.80~5.31,其盐度和pH值无相关性。

表1 泡菜样品的理化指标
2.2 耐酸性菌株的筛选
由表2可知,从含盐量≤6%的12份泡菜样品中共分离得到126株产生溶钙圈的菌株,将其接种至pH 4.0的培养基中进行初次耐酸性筛选,结果见表3,共有35株菌生长,其中18株生长情况良好;将18株优良菌株于pH 3.0的培养基中进行第2次耐酸性筛选,仍有13株菌株生长性能良好;于pH 2.0的培养基中进行第3次筛选,只有5株菌株生长情况良好。因此,选择J2、N6、F8、M1、M12 5株菌株进行后续试验。

表2 样品中菌株的分离结果

表3 耐酸性菌株的筛选†
2.3 耐酸性乳酸菌的鉴定
2.3.1 形态学鉴定及生理生化鉴定 由图1可知,菌株J2为圆形的白色不透明菌落,菌落光滑湿润、边缘整齐;菌株N6为乳白色的光滑菌落,中央凸起、边缘整齐;菌株F8为圆形的乳白色菌落,表面光滑、中央凸起;菌株M1为圆形的乳白色黏稠菌落,表面湿润;菌株M12为白色不透明菌落,表面呈黏稠光滑的圆形。5株菌株的菌落形态相似,具有乳酸菌的典型特征。

图1 菌落形态对比图
由图2可知,菌株J2菌体细胞呈卵圆形或球形,成对、单个或链状排列;菌株N6菌体细胞呈杆状排列;菌株F8为短杆菌,呈单个或两个生长,无芽孢产生;菌株M1为短杆菌,短链或呈链排列;菌株M12为不规则短棒状细胞,呈短链状或成对存在。5株菌株的革兰氏染色均为蓝紫色,属于革兰氏阳性菌。经过氧化氢酶接触后,5株菌株均不产生气泡,为过氧化氢酶阴性菌。

图2 显微镜下的细胞形态对比图
2.3.2 16S rDNA序列同源性对比 由图3可知,扩增产物条带序列大小为1 483~1 507 bp,条带清晰可见且无杂带。由图4可知,菌株J2和肠膜明串珠菌(Leuconostocmesenteroides)的同源性为100%,菌株N6和副干酪乳杆菌(Lactobacillusparacasei)的同源性为100%,菌株M1、M12和食窦魏斯氏菌(Weissellacibaria)的同源性为100%,菌株F8和类植物乳杆菌(Lactobacillusparaplantarum)的同源性为100%。

图3 琼脂糖凝胶电泳检测PCR产物

图4 5株菌株的16S rDNA序列系统进化树
王璐等[15]从果蔬发酵样品中筛选出2株耐酸性乳酸菌,分别为植物乳杆菌(Lactobacillusplantarum)S3-10和干酪乳杆菌(Lactobacilluscasei)R10;李欣等[16]从黑龙江大庆地区的自然发酵酸菜中筛选出6株耐酸性乳酸菌,包括3株弯曲乳杆菌(Lactobacilluscurvatus),2株清酒乳杆菌(Lactobacillussake),1株植物乳杆菌。这与试验结果存在差异,可能由于不同地区的泡菜有不同的微生物菌群和生物学特性,泡菜的加工工艺及贮藏环境也会导致乳酸菌种类和数量不同,但试验分离出了泡菜中较为少见的W.cibaria。
2.4 耐酸性乳酸菌的生物学性质
2.4.1 生长曲线 由图5可知,L.mesenteroidesJ2、L.paracaseiN6、L.paraplantarumF8、W.cibariaM1和W.cibariaM12均在6 h后进入对数期,16 h后进入稳定期。杨英歌等[17]研究的乳酸菌4 h后进入对数期,14 h后进入稳定期,而夏勒合特·巴克尔拜等[18]研究的植物乳杆菌进入对数期和稳定期的时间分别为2,18 h。说明不同种类的乳酸菌进入对数期和稳定期的时间不同。6 h时,L.paracaseiN6的生长速度最快,OD600 nm值为0.81;16 h时,W.cibariaM12的吸光度最高为2.41;24 h时,W.cibariaM12的吸光度最高为2.42。5株菌株生长曲线排序为W.cibariaM12>W.cibariaM1>L.paracaseiN6>L.paraplantarumF8>L.mesenteroidesJ2。

图5 菌株的生长曲线
2.4.2 酸耐受能力和产酸能力 由图6可知,L.paracaseiN6在pH为4.0,3.0,2.0时的相对生长率分别为84.23%,58.95%,20.72%,均显著高于其他菌株(P<0.05),W.cibariaM1和W.cibariaM12的次之。5株菌株的相对生长率排序为L.paracaseiN6>W.cibariaM1>W.cibariaM12>L.paraplantarumF8>L.mesenteroidesJ2。菌株之间的酸耐受性差异明显,且同一菌种的不同菌株之间的酸耐受性也存在差异。
由图6可知,L.paracaseiN6的产酸活力为(5.05±0.09) U,高于其他菌株;W.cibariaM12的产酸活力为(5.03±0.01) U,显著高于W.cibariaM1、L.paraplantarumF8和L.mesenteroidesJ2的(P<0.05)。罗强等[19-20]研究表明,菌株耐酸产酸能力的相关性有待进一步研究。样品发酵过程中产酸量与乳酸菌发酵过程中产乳酸的量呈正相关,对杂菌具有较好的抑制作用。
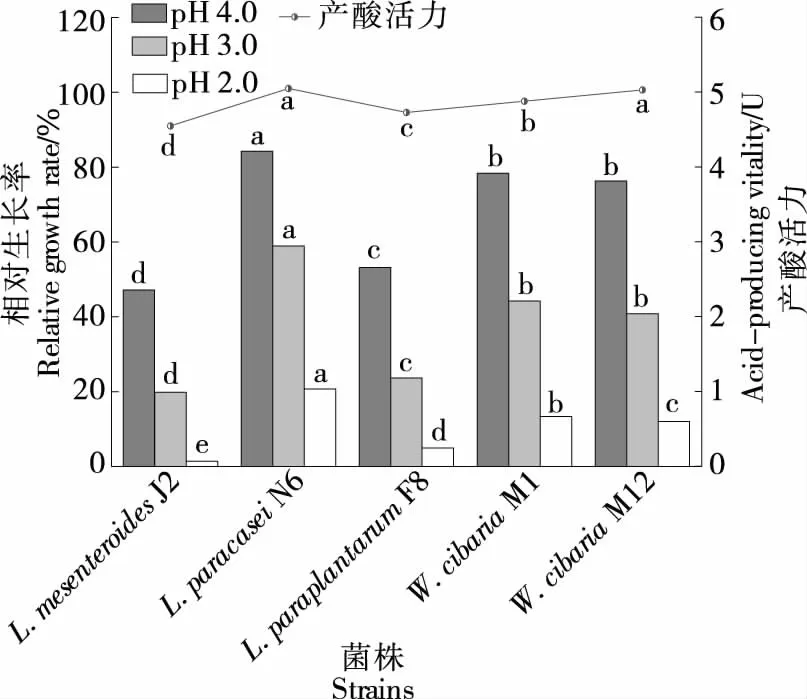
字母不同表示差异显著( P<0.05)
2.5 耐酸性乳酸菌的体外益生特性
2.5.1 体外模拟胃液、肠液耐受能力 由图7(a)可知,当pH为4.0时,5株菌存活率均在81%以上;当pH为3.0时,L.paracaseiN6的存活率为90.49%,显著高于其他菌株(P<0.05),W.cibariaM1和W.cibariaM12的存活率分别为72.80%,70.25%,均显著高于L.paraplantarumF8和L.mesenteroidesJ2(P<0.05);当pH为2.0时,L.paracaseiN6仍能达到48.65%的存活率,且存活率显著高于其他菌株(P<0.05),L.paraplantarumF8和L.mesenteroidesJ2均不耐受pH 2.0的强酸环境。熊强等[21]从自制泡菜中分离出的6株植物乳杆菌中,其中有4株在人工胃液中的存活率在80%以上。赵芳等[22]研究显示,菌株在pH 2.0的人工胃液中处理2 h后几乎都无法存活。

字母不同表示差异显著( P<0.05)
由图7(b)可知,经pH 4.0胃液和pH 8.0肠液消化后菌株的存活状况良好,存活率>62.44%;经pH 3.0胃液和pH 8.0肠液消化后,L.paracaseiN6存活率为79.26%,显著高于其他菌株(P<0.05),W.cibariaM1和W.cibariaM12的存活率分别为50.65%,53.37%,差距相对较小,说明同种乳酸菌的益生特性差异不大;经pH 2.0胃液和pH 8.0肠液消化后,L.paraplantarumF8和L.mesenteroidesJ2的存活率几乎为零。综上,L.paracaseiN6、W.cibariaM1和W.cibariaM12对人工胃液、肠液环境均具有较强的耐受性。
2.5.2 体外模拟胆盐耐受能力 由图8可知,当培养时间为2 h时,菌株存活率均在80%以上,随着培养时间的增加,菌株存活率呈下降趋势;当培养时间为4 h时,L.paracaseiN6存活率为63.64%,显著高于其他菌株(P<0.05),与李洋等[12,23]的结果一致;当培养时间为8 h时,L.paracaseiN6的存活能力最强,存活率为41.16%,显著高于其他菌株(P<0.05),W.cibariaM12和W.cibariaM1的次之。

字母不同表示差异显著(P<0.05)
2.5.3 疏水能力 由图9可知,L.paracaseiN6、W.cibariaM12、W.cibariaM1和L.paraplantarumF8均属于高度疏水菌株,疏水率均在60%以上,其中L.paracaseiN6的疏水率达78.72%,显著高于其他菌株(P<0.05);L.mesenteroidesJ2为中度疏水菌株,疏水率为42.81%。5株菌株的表面疏水能力为L.paracaseiN6>W.cibariaM12>W.cibariaM1>L.paraplantarumF8>L.mesenteroidesJ2。

字母不同差异显著( P<0.05)
2.5.4 自凝集能力 由图10可知,5株菌株的自聚集率均呈上升趋势,与Abushelaibi等[24-25]的研究结果相似。培养24 h时,L.paracaseiN6的自凝集能力最高,达76.51%,与Mih等[26]的结果一致;W.cibariaM12、W.cibariaM1、L.paraplantarumF8和L.mesenteroidesJ2的自凝集率分别为65.00%,62.54%,49.95%,36.31%。

图10 乳酸菌菌株细胞的表面自凝集率
3 结论
从14份泡菜样品中筛选出含盐量≤6%的12份样品,共分离纯化出126株产生溶钙圈的菌株,并筛选出5株耐酸性菌株,经16S rDNA分子鉴定为肠膜明串珠菌(Leuconostocmesenteroides)J2、副干酪乳杆菌(Lactobacillusparacasei)N6、类植物乳杆菌(Lactobacilluparaplantarum)F8、食窦魏斯氏菌(Weissellacibaria)M1和食窦魏斯氏菌(Weissellacibaria)M12。其中,L.paracaseiN6、W.cibariaM1和W.cibariaM12是具有益生特性的耐酸性乳酸菌菌株,可用于初步筛选,但还需进一步的稳定性试验和遗传稳定性研究,以鉴定适合人类或动物使用的潜在益生菌。

