高温高压水提取灵芝β-葡聚糖工艺优化
周岩飞 吴长辉 姚渭溪 李 晔
(福建仙芝楼生物科技有限公司/国家食用菌加工技术分中心,福建福州 350002)
灵芝Ganoderma lucidum为多孔菌科真菌赤芝的干燥子实体[1],含有多种活性成分,以灵芝多糖、灵芝三萜、灵芝甾醇和核苷类为主,具有调节免疫、抗肿瘤和保肝等活性[2]。目前已经从不同来源的灵芝中分离出200 多种灵芝多糖,它们主要是由β-(1→3)-D、β-(1→4)-D、β-(1→6)-D 等几种β-葡聚糖组成。葡聚糖是由葡萄糖单体聚合而成的一类高分子多糖,可分为α 型和β 型。常见的α-葡聚糖主要存在于淀粉、糊精和糖原,β-葡聚糖主要存在于微生物和食药用菌等真菌中。目前药理学研究表明,β-葡聚糖是高效的生物反应调节因子,是一种生物活性多糖,在调节免疫和抗肿瘤方面发挥着重要作用,具有重要开发应用前景[3]。灵芝的β-葡聚糖属于胞内多糖,存在于细胞壁或细胞间质中;而灵芝子实体的细胞壁是由纤维素、半纤维素和木质素组成的致密结构,因此不易从细胞内提取出灵芝多糖。目前提取多糖的方法主要有热水浸提法[1]、超声辅助提取法[4]、微波辅助提取法[5]、酶法辅助提取法[6]、亚临界水提取法[7]和超高压提取法[8],热水浸提法是工业生产常用的方法,但提取时间长和能耗高限制其产业化发展;超声辅助提取以超声高频振荡产生的空穴效应破坏细胞壁使多糖溶出,但中试及产业化投资成本高;微波辅助提取以微波破坏细胞壁,但对设备要求高,样品处理量小,会产生大量蒸汽,难以大规模应用;酶作用于灵芝中几丁质、纤维素等物质,使其与多糖分离,不破坏多糖结构,但酶易失活,且较难把控酶的适宜pH 及最佳温度;超微粉碎将物料粉碎成直径小于10 μm粉体,使灵芝细胞最大限度破壁,直接释放胞内有效成分,但存在毒性成分溶出风险,易吸附杂质[9]。亚临界水提取基于相同原理,但是温度和压力要求更高,高温易导致β-葡聚糖生物活性的下降[10]。高温高压水提法利用高压和高温对细胞壁的破碎作用使多糖溶出,该提取方法简单可行、适用性强,可用于工业化生产。为此,笔者进行高温高压水提取灵芝β-葡聚糖的优化工艺条件,以期为灵芝的深加工提供科学的依据。
1 材料与方法
1.1 试剂和仪器
无水葡萄糖对照品(中国食品药品检定研究院)、中温α-淀粉酶(4000 U/g,上海麦克林生化科技有限公司)、糖化酶(10000 U/g,西亚化学科技(山东)有限公司)、蒽酮(AR,上海麦克林生化科技有限公司)、硫酸(AR,西陇科学股份有限公司)、纯化水(RO,自制)、GMA-UN2 超纯水机(北京普析通用仪器有限责任公司)、UV-2450 紫外可见分光光度计(岛津制作所)、TD-5 台式离心机(上海卢湘仪离心机仪器有限公司)、HH-6 数显恒温水浴锅(常州易晨仪器制造有限公司)、WGL-125B电热鼓风干燥箱(天津市泰斯特仪器有限公司)、LDZF-75 L-1 立式高压灭菌器(上海申安医疗器械厂,温度上限为137 ℃,压力上限0.33 MPa)
1.2 材料
灵芝颗粒(批号SBB-L3C-201012)由仙芝科技(福建)股份有限公司提供,灵芝经除杂、干燥和粉碎后过筛(孔径为840~2000 μm)。
1.3 方法
称取灵芝颗粒若干份,每份20 g,加水后进行高温高压提取,提取后使用74 μm孔径滤布过滤,滤液浓缩蒸干,烘干至恒重,称重得到提取物质量并计算提取物得率;用水溶解提取物并定容,以无水葡萄糖为对照品,用酶解α-葡聚糖-蒽酮-硫酸法检测β-葡聚糖总量,计算得灵芝β-葡聚糖提取率和提取物中β-葡聚糖质量分数。

1.4 酶解α-葡聚糖-蒽酮-硫酸法
2020版中国药典一部灵芝[含量测定]多糖[1]的方法中加入酶解α-葡聚糖步骤(供试品溶液的制备方法):取烘干恒重后的提取物,加水溶解,定容至100 mL,取25 mL转移至50 mL离心管,加入30 mg中温α-淀粉酶,55 ℃酶解1 h;用滴管滴入1 滴(约0.002 mL)0.1 mol/L的盐酸溶液,使其pH为4.0~4.5,加入30 mg 糖化酶,55 ℃酶解1 h;离心取上清5 mL,边搅拌边加入乙醇75 mL,醇沉后操作同2020版中国药典。
1.5 高温高压水提取灵芝β-葡聚糖的工艺优化
1.5.1 单因素试验
1.5.1.1 提取温度对β-葡聚糖提取率和提取物中β-葡聚糖质量分数的影响
称取灵芝颗粒7 份,每份20 g,料(g)液(mL)比为1∶15,提取温度为100 ℃、105 ℃、110 ℃、115 ℃、120 ℃、125 ℃、130 ℃,提取时间为10 min,提取后操作同1.3。每组试验重复3 次,取平均值。
1.5.1.2 提取时间对β-葡聚糖提取率和提取物中β-葡聚糖质量分数的影响
称取灵芝颗粒5 份,每份20 g,料(g)液(mL)比为1∶15,提取时间为10 min、20 min、30 min、40 min、60 min,提取温度为130 ℃,提取后操作同1.3。每组试验重复3 次,取平均值。
1.5.1.3 料液比对β-葡聚糖提取率和提取物中β-葡聚糖质量分数的影响
称取灵芝颗粒5 份,料(g)液(mL)比为1∶15、1∶20、1∶25、1∶30、1∶35、1∶40,提取时间为40 min,提取温度为125 ℃,提取后操作同1.3。每组试验重复3次,取平均值。
1.5.1.4 提取次数对β-葡聚糖提取率和提取物中β-葡聚糖质量分数的影响
称取灵芝颗粒5 份,每份20 g,料(g)液(mL)比为1∶15,提取时间为40 min,提取温度为125 ℃,提取1、2、3、4、5 次,提取后操作同1.3。每组试验重复3 次,取平均值。
1.5.2 正交试验
根据单因素试验结果,用L9(34)设计正交试验,考察提取温度、时间、次数对β-葡聚糖提取率和提取物中β-葡聚糖质量分数的影响。灵芝颗粒每份20 g,每组试验重复3 次,取平均值以确定最佳工艺条件。
1.6 不同方法提取灵芝β-葡聚糖对比
分别采用热水浸提法[1]、超声辅助法[4]、微波辅助法[5]和酶法辅助法[6]提取灵芝β-葡聚糖。灵芝颗粒每份20 g,每组试验重复3 次,取平均值。
2 结果与分析
2.1 测定方法和试验参数的确定
酶解α-葡聚糖-蒽酮-硫酸法测定β-葡聚糖标准曲线见图1。
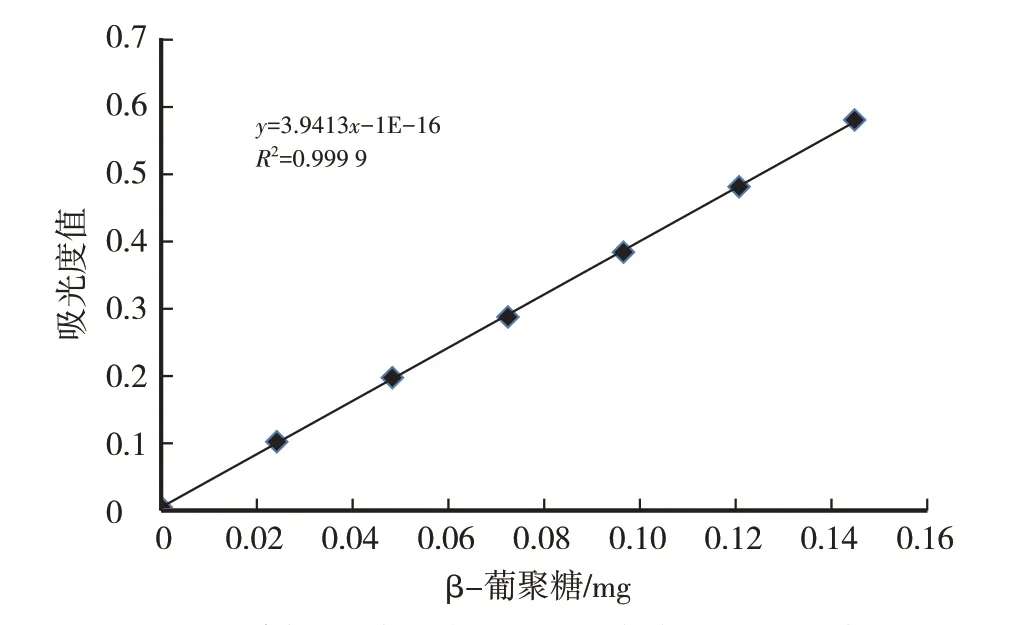
图1 酶解α-葡聚糖-蒽酮-硫酸法测定灵芝β-葡聚糖标准曲线
2.2 高温高压水提取灵芝β-葡聚糖
2.2.1 提取温度对β-葡聚糖提取率及提取物中β-葡聚糖质量分数的影响
由图2 可以看出,β-葡聚糖提取率与提取温度成正比关系,130 ℃时提取率最高;提取物中β-葡聚糖质量分数与提取温度成正比关系,说明随着温度升高,β-葡聚糖的溶出速度大于杂质的溶出速度,130 ℃时提取物中β-葡聚糖质量分数最高。综合结果选取130 ℃作为以下试验的提取温度。
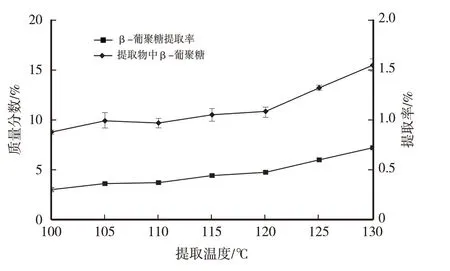
图2 提取温度对提取物中β-葡聚糖质量分数及β-葡聚糖提取率的影响
2.2.2 提取时间对β-葡聚糖提取率和提取物中β-葡聚糖质量分数的影响
由图3 可以看出,β-葡聚糖提取率与提取时间成正比关系,特别是提取30 min 以后,提取率上升加快,提取60 min 时提取率最高;提取物中β-葡聚糖质量分数与提取时间成正比关系,说明延长提取时间,特别是提取30 min 以后,β-葡聚糖的溶出速度大于杂质的溶出速度,提取60 min时提取物中β-葡聚糖质量分数最高。综合结果表明30 min 以后β-葡聚糖会加速溶出,提取60 min最佳。
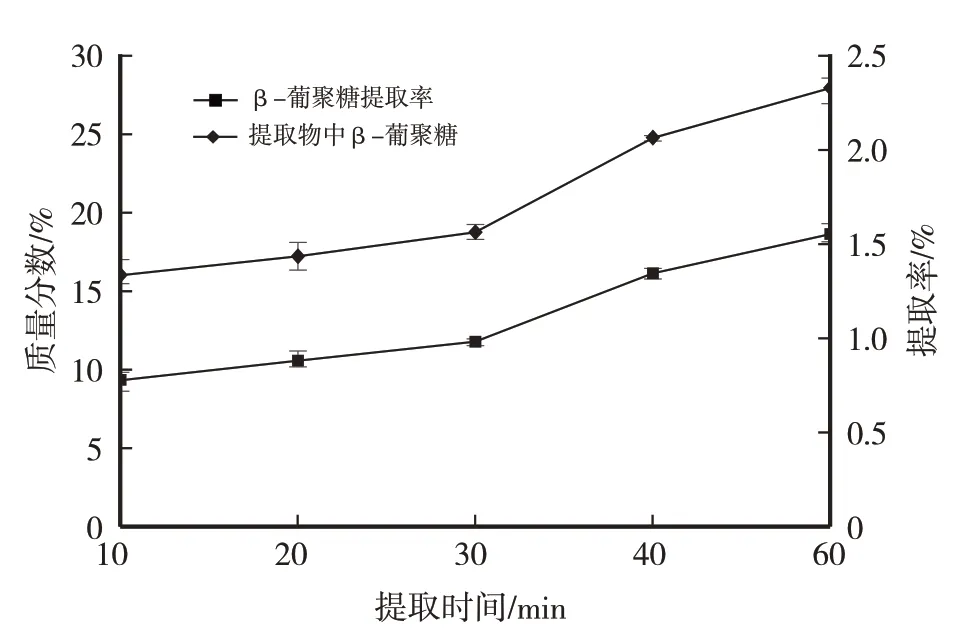
图3 提取时间对提取物中β-葡聚糖质量分数及β-葡聚糖提取率的影响
2.2.3 料液比对β-葡聚糖提取率和提取物中β-葡聚糖质量分数的影响
选取最佳提取温度和时间次优点,125 ℃,40 min,料液比设定5个梯度,提取结果见图4。

图4 料液比对提取物中β-葡聚糖质量分数及β-葡聚糖提取率的影响
由图4 可以看出随着料液比上升,β-葡聚糖提取率缓慢上升,料液比1∶35以后停滞。由此得出,液料比过高,溶出杂质越多,不仅延长浓缩时间,还会导致多糖的损失,提取物中β-葡聚糖质量分数下降[11]。综合考量,以料(g)液(mL)比1∶15为最佳。
2.2.4 提取次数对β-葡聚糖提取率和提取物中β-葡聚糖质量分数的影响
选取最佳提取温度和时间次优点,125 ℃,40 min,料液比1∶15(g/mL),提取1~5 次。 结果见图5。
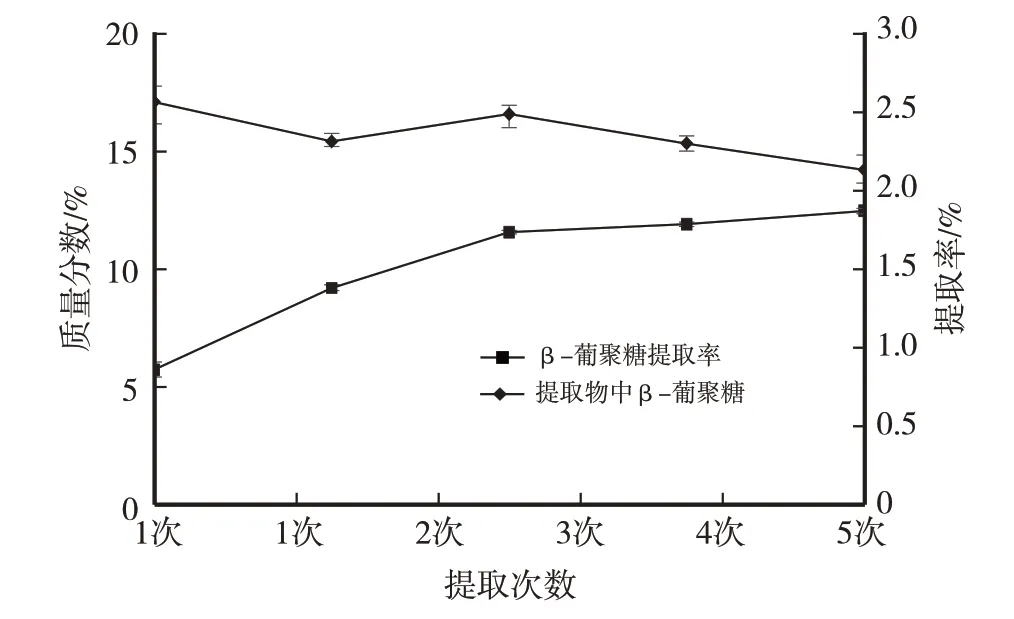
图5 提取次数对提取物中β-葡聚糖质量分数及β-葡聚糖提取率的影响
由图5 可以看出,提取3 次即可完全提取β-葡聚糖,β-葡聚糖提取率增长趋于平缓;再增加提取次数,提取物中β-葡聚糖反而降低,说明β-葡聚糖存在溶出上限,提取次数过多反而溶出更多杂质,导致提取物中β-葡聚糖下降。综合结果,以提取3次为最佳。
2.2.5 正交试验
仿真的参数带宽为800 kHz, FFT点数为4 096点,所加时延为[0 0.2 0.6 1.0 1.5 2.0],最大多普勒频移为4 Hz,莱斯因子等于5的莱斯信道。
选取提取温度、时间、次数作为高温高压水提灵芝β-葡聚糖的关键因素,料(g)液(mL)比为1∶15,由于提取温度对提取率及提取物中β-葡聚糖质量分数的影响较大;又因为立式高压灭菌器的温度上限为137 ℃,故温度因素补充135 ℃水平。
试验因素水平见表1,正交试验结果见表2,β-葡聚糖提取率极差分析见表3,β-葡聚糖提取率方差分析见表4,提取物中β-葡聚糖质量分数极差分析见表5,提取物中β-葡聚糖质量分数方差分析见表6。

表1 正交试验因素水平
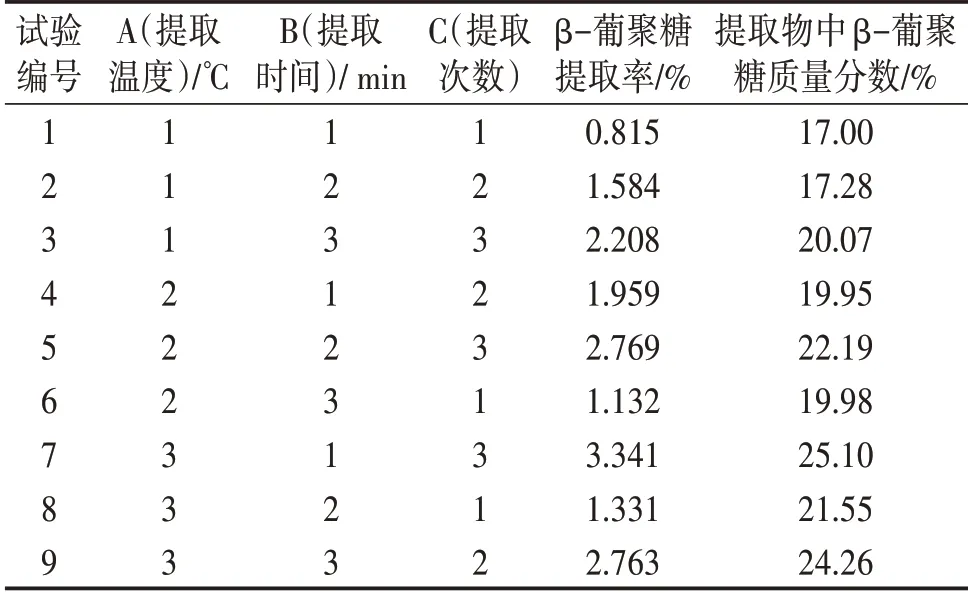
表2 正交试验
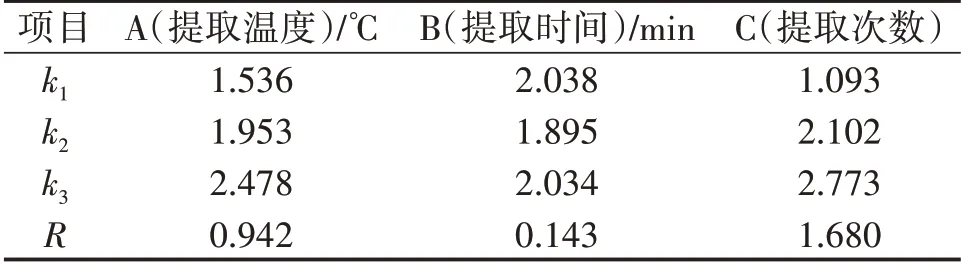
表3 β-葡聚糖提取率极差分析
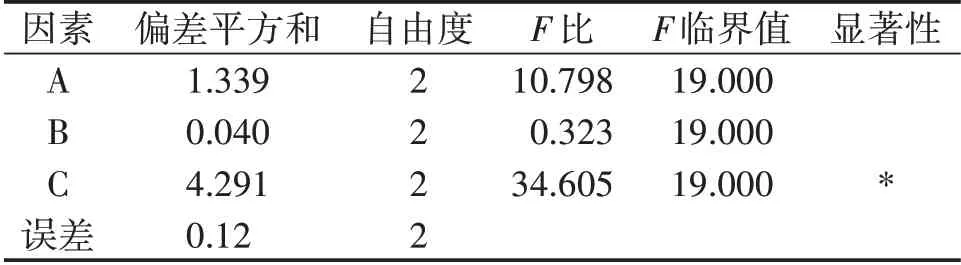
表4 β-葡聚糖提取率方差分析
最佳水平为A3B1C3,提取次数对β-葡聚糖提取率影响较大,其次为温度。
提取次数对β-葡聚糖提取率影响具有显著性影响,提取温度和提取时间对β-葡聚糖提取率没有显著性影响。
最佳水平为A3B3C3,提取温度对提取物中β-葡聚糖质量分数影响较大,其次为提取次数。
温度和次数对提取物中β-葡聚糖质量分数具有显著性影响,提取时间没有显著性影响。
以提取物中β-葡聚糖质量分数为目标,兼顾β-葡聚糖提取率,选取A3B3C3进行重复试验,结果见表7。
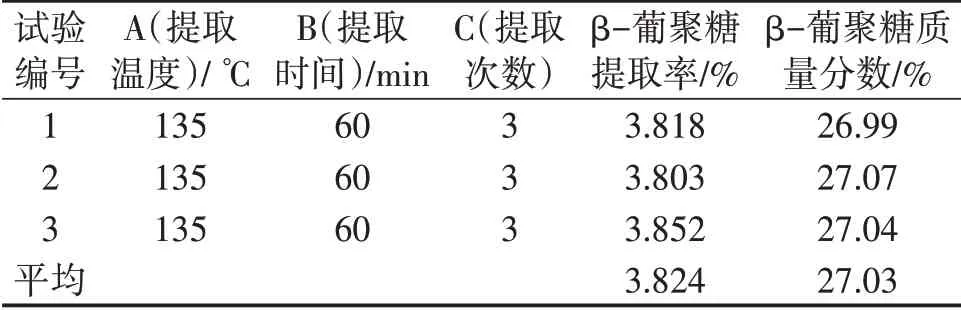
表7 重复验证试验结果
2.3 不同方法提取灵芝β-葡聚糖结果对比
由图6 可以看出,高温高压水提取的β-葡聚糖提取率和提取物中β-葡聚糖质量分数都高于热水浸提法和其他提取方法。
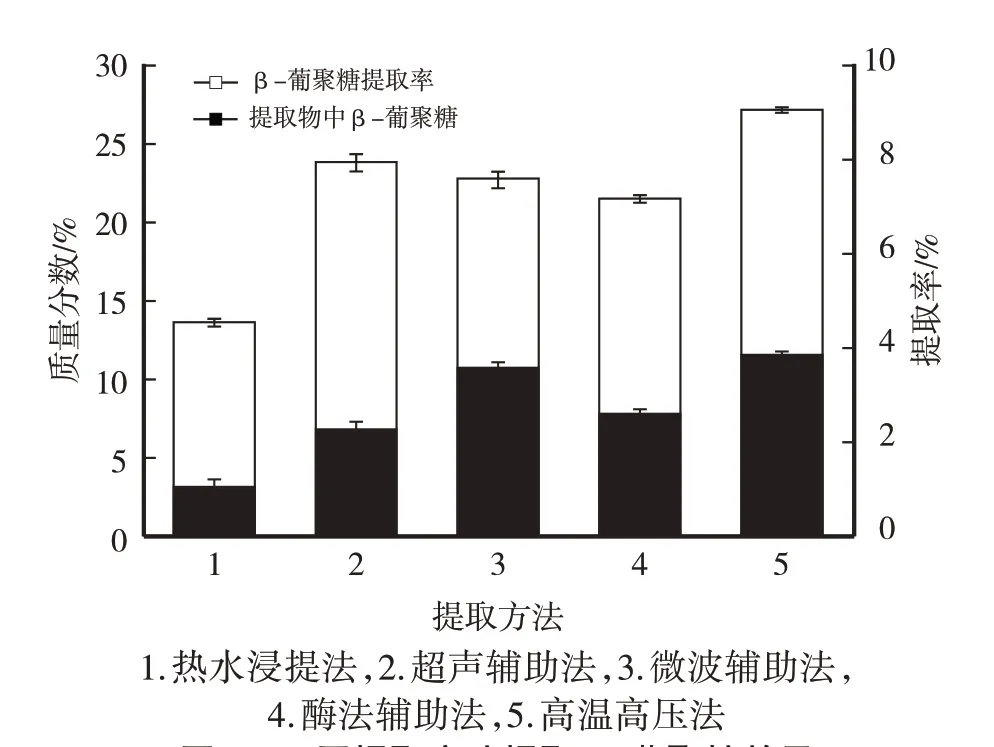
图6 不同提取方法提取β-葡聚糖效果
3 小结与讨论
采用单因素试验及正交试验优化高温高压水提取灵芝β-葡聚糖的条件,结果表明,高温高压水提取灵芝β-葡聚糖的最佳条件为料(g)液(mL)比1∶15,提取温度为135 ℃,提取时间为60 min,提取次数为3 次,在此条件下,提取物中β-葡聚糖的质量分数为27.03%,β-葡聚糖的提取率为3.824%。
以往研究中只注重灵芝多糖提取率[4-9],忽视提取物中灵芝多糖质量分数,若提取时杂质溶出过多,需要更多的纯化手段以提高成品中的灵芝多糖纯度,从而加重多糖纯化工作。笔者研究表明,与传统的提取方法和亚临界水提取法相比,高温高压水提取法明显提高了β-葡聚糖提取率及在提取物中的质量分数,同时又避免了提取杂质溶出过多或提取温度过高时大分子的β-葡聚糖发生分解,导致提取物中β-葡聚糖质量分数下降的弊端。高温高压水提取温度为135 ℃,压力约0.3 MPa时,β-葡聚糖的提取率比常压的热水提取方法提高一倍多(图6),操作简便安全,大幅度提高资源利用率,可进一步扩大进行工业化生产。
正交试验提取温度为135 ℃时,β-葡聚糖提取率最高,从图2 的β-葡聚糖提取率上升趋势可知,β-葡聚糖提取率并未在135 ℃达最高值。由于试验灭菌器的温度和压力存在上限,今后可采用其他设备进行更高提取温度试验。
——谷物β-葡聚糖的最新研究进展

