M1型巨噬细胞对小鼠膀胱癌MB49细胞活力、迁移、侵袭及凋亡的影响*
张暑军, 李青青, 乔春林, 勾 璇, 王新敏, 章 乐△
(1石河子大学医学院病理生理学教研室/新疆地方病与民族高发病教育部重点实验室,新疆 石河子 832000;2石河子大学医学院第一附属医院泌尿外科,新疆 石河子 832008)
膀胱癌是常见的恶性肿瘤,在泌尿生殖道肿瘤中膀胱癌发病率位居第一位[1]。研究表明,肿瘤微环境(tumor microenvironment,TME)与膀胱癌的发生、发展关系密切,而肿瘤相关巨噬细胞是肿瘤微环境中的主要组成部分,在膀胱癌浸润免疫细胞中的比例可高达50%[2-3]。肿瘤相关巨噬细胞活化类型分为两种表型:M1 型和M2 型[4]。M1 型巨噬细胞可被干扰素γ(interferon-γ,IFN-γ)或脂多糖(lipopolysac‑charide,LPS)激活,并分泌大量促炎细胞因子如白细胞介素6(interleukin-6,IL-6)和肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)等,表达高水平的CD86 和诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS),主要诱导Th1 型免疫应答,被称为肿瘤杀伤性巨噬细胞,一直被认为具有抑瘤效应[5-6]。但研究显示,M1 型巨噬细胞也存在促瘤作用,可参与肿瘤的恶性进展。在乳腺癌中,M1 型巨噬细胞能诱导乳腺癌细胞T47-D和MCF-7的上皮-间充质转化(epithelial-mesenchymal transition,EMT),并增强诱导细胞的迁移和侵袭能力[7];在脑胶质瘤中,M1型巨噬细胞可促进脑胶质瘤U251 细胞的侵袭[8]。目前M1 型巨噬细胞在膀胱癌发生发展中的作用仍不清楚。本项工作以小鼠膀胱癌细胞株MB49 为研究模型,并转化小鼠RAW264.7 巨噬细胞为M1 型巨噬细胞,将其与MB49细胞通过Transwell小室进行体外双层共培养,观察M1型巨噬细胞对MB49细胞活力、迁移、侵袭及凋亡的影响。
材料和方法
1 材料
小鼠RAW264.7 巨噬细胞系购自中国科学院细胞库;小鼠膀胱癌MB49细胞购自中国上海赛百慷生物有限公司。 胎牛血清购自Bioloical Industries;DMEM、青-链霉素和PBS 购自Gibco;LPS 购自Sig‑ma;CCK-8 购自日本同仁公司;抗小鼠CD86 抗体购自Invitrogen;兔抗iNOS 抗体购自Abcam;兔抗CD86抗体购自Bioss;小鼠CD86-PE 流式抗体购自Invitro‑gen;Hoechst 33258、裂解液PMSF 和RIPA、Western blot 制胶液均购自北京索莱宝科技有限公司;0.4 μm和0.8 μm的Transwell小室购自Corning。
2 方法
2.1 RAW264.7 细胞和MB49 细胞的培养配制完全培养液(含1×105U/L 青霉素、100 mg/L 链霉素和10% 胎牛血清的DMEM 高糖培养液),将细胞置于5% CO2、37 ℃恒温培养箱中。观察细胞状态并换液,当培养瓶细胞生长至80%~90% 时予以传代。传代培养3次后取对数生长期的细胞用于实验。
2.2 LPS 诱导RAW264.7 细胞向M1 型极化将处于对数生长期的RAW264.7 细胞按3×108L−1接种于6孔板中,培养液每孔2 mL,铺板后细胞培养12 h,以此时记为0 h,然后加入不同浓度的LPS刺激,分别为0、50、100 和200 μg/L 4 个组,每组3 个复孔,培养细胞24 h[9-10]。
2.3 免疫荧光细胞化学染色法检测RAW264.7 巨噬细胞iNOS 和CD86 表达情况取出LPS 刺激24 h后的细胞,4% 多聚甲醛固定细胞15 min,Triton X-100 破细胞膜3 min,加入牛血清白蛋白于37 ℃恒温封闭30 min,分别加入兔抗iNOS抗体(1∶100)和小鼠抗CD86 抗体(1∶100),置于湿盒内37 ℃恒温孵育3.5 h,在暗室中滴加FITC 标记的山羊抗兔Ⅱ抗(1∶50)和FITC 标记的山羊抗鼠Ⅱ抗(1∶50),避光,置于37 ℃环境中孵育2 h,PI(1∶1 000)染核10 min,甘油封片[9]。采集细胞图像,再进行半定量分析。
2.4 Western blot 分析RAW264.7 巨噬细胞iNOS 和CD86 蛋白表达情况取出细胞,加入配好的裂解液(PMSF∶RIPA 为1∶100),每孔100~200 μL,将6 孔板置于冰盒上裂解20~30 min。干净的细胞刮刮落贴壁细胞,将液体吸至1.5 mL 的EP 管中,提前预冷离心机至4 ℃,13 684×g离心15 min,测定蛋白浓度,配平,加入loading buffer,煮蛋白100 ℃,10 min,冷却后蛋白于−80 ℃冰箱保存。制胶(5% 浓缩胶和10% 分离胶);电泳,电压为80 V,2 h;湿转,电压为80 V,1.5 h。于摇床上室温封闭2~3 h,用含50 g/L 牛血清白蛋白的TBST 配制Ⅰ抗(兔抗鼠CD86 单克隆抗体按1∶1 000稀释,兔抗鼠iNOS单克隆抗体按1∶500稀释,鼠抗β-actin 单克隆抗体按1∶10 000 稀释);Ⅱ抗为HRP 标记的羊抗兔IgG(1∶10 000)或羊抗鼠IgG(1∶20 000);化学发光试剂盒(A 液∶B 液=1∶1)显影,并于暗室压片[11]。扫描条带灰度值。图像采集后使用ImageJ 软件进行分析,分别计算CD86 和iNOS 与β-actin的比值。
2.5 流式细胞术检测RAW264.7 巨噬细胞表面CD86 的表达情况胰酶消化收集巨噬细胞,用1×PBS 洗2 次,细胞表面CD86 的表达情况用直接免疫荧光法进行检测。每100 μL的1× PBS加入抗体(PE标记的CD86 抗体)1 μL,用配好的抗体稀释液重悬细胞,避光,置于37 ℃环境中,染色30 min。1× PBS洗2次,加入300~500 μL的1× PBS重悬细胞,上机检测[11]。实验结果为膜分子表达阳性细胞百分率。
2.6 构建巨噬细胞与膀胱癌细胞的共培养体系实验分为3 组:MB49 组、MB49 与M0 巨噬细胞共培养组(M0+MB49 组)及MB49 与M1 巨噬细胞共培养组(M1+MB49 组),于6 孔板上放置膜孔径为0.4 μm的Transwell 培养小室,将MB49 细胞和不同亚型的RAW264.7 巨噬细胞制备成均匀的细胞悬液,上层按实验分组分别加入M0 和M1 亚型巨噬细胞,下层加入膀胱癌细胞MB49,构建共培养体系,2种细胞均匀分布于各层,共培养。
2.7 CCK-8 实验检测各组MB49 细胞的活力将不同分组的MB49细胞制备成均匀的细胞悬液,每组进行细胞计数,把细胞密度调整为4×107L−1,每个试验组设3 个复孔;保证每孔细胞密度基本相同,按上述实验分组将单细胞悬液以每孔4×103接种于96孔板,在37 ℃、5% CO2细胞培养箱中继续培养;在24 h 后将96 孔板终止培养。每孔加入CCK-8 溶液10 μL,轻轻混匀,把培养板放在37 ℃、5% CO2细胞培养箱中2 h;利用酶标仪测定450 nm的吸光度(A)值;计算细胞相对活力,并行统计分析。
2.8 划痕实验检测各组MB49细胞水平方向的迁移能力待实验组中MB49 细胞长至90% 左右时,用10 μL 吸头垂直6 孔板笔直划出两条水平的划痕,弃去培养液,用PBS清洗3次,洗去划掉的细胞,然后加入无血清的DMEM 培养液,显微镜拍照,此时记为0 h,继续于培养箱培养24 h,再次于显微镜下拍照,用ImageJ软件计算各组MB49细胞迁移的面积。
2.9 Transwell实验检测各组MB49细胞的侵袭及垂直方向的迁移能力取出细胞,胰酶消化MB49收集细胞,用不含血清的培养液重悬细胞,向Transwell小室中放入无血清培养液重悬的细胞,保证各组细胞数量一致。Transwell 侵袭实验需提前在小室中铺上一层基质胶;于24孔板下室中加入500 μL含20% 血清的完全培养液,将小室放入24 孔板中,培养箱中培养24 h;取出Transwell 小室,PBS 洗两次,4% 多聚甲醛固定30 min;0.1% 结晶紫染色20 min,PBS 洗3次,棉签擦去小室里未迁移的细胞;风干小室,再于倒置荧光显微镜下拍照[12];用直接计数法或ImageJ软件计算出各组MB49细胞穿过的数量。
2.10 Hoechst 33258 染色检测各组MB49 细胞的凋亡情况取出细胞,弃上清液,PBS 洗3 次,4% 多聚甲醛固定10~15 min;PBS 洗3 次,加入稀释好的Hoechst 33258 染色液500 μL,室温避光孵育20~30 min;PBS 洗3 次,于荧光倒置显微镜下观察并拍照[13],用ImageJ软件计算出各组MB49细胞凋亡的数量。当细胞发生凋亡时,Hoechst 33258 染料穿透细胞膜与双链DNA 结合,产生比荧光染料自身更强的荧光。因此,凋亡细胞的荧光强度高于正常细胞。若镜下观察细胞核呈致密浓染,或呈碎块状致密浓染,即荧光显微镜下观察到亮蓝光,说明细胞发生凋亡。
2.11 ELISA 检测各组炎症因子IL-6 的水平收集各组共培养后的细胞培养液上清于EP管中,1 100×g离心5 min,每组取100 μL细胞培养液加入至已被抗体包被的96 孔酶标板中,按照ELISA 试剂盒说明书对IL-6的含量进行检测。
3 统计学处理
SPSS 23.0 软件对数据进行统计学分析。实验数据均为至少3 次独立重复实验结果,并以均数±标准差(mean±SD)表示。采用方差分析(或t检验)进行组间差异比较,并进一步采用LSD 进行组间两两比较。GraphPad Prism 5.0 软件作图。P<0.05 表示差异有统计学意义。
结 果
1 Western blot 检测LPS 刺激后RAW264.7 巨噬细胞中CD86和iNOS蛋白表达水平
Western blot 结果显示,0、50、100 和200 μg/L 的LPS刺激巨噬细胞24 h后,与对照组(即0 μg/L组)相比,RAW264.7巨噬细胞的CD86和iNOS蛋白表达均不同程度地升高,各组CD86蛋白的相对表达量分别为 1.00±0.00、1.11±0.10、1.31±0.16 和 1.12±0.09),各组iNOS 蛋白的相对表达量分别为1.00±0.00、3.45±1.24、5.24±0.60 和1.51±0.68;当LPS浓度为100 μg/L时,CD86及iNOS蛋白的表达水平最高,与对照组相比,差异均有统计学意义(P<0.05),见图1、2。
2 免疫荧光检测LPS 刺激后RAW264.7 巨噬细胞中iNOS和CD86蛋白表达及分布

Figure 1.The expression of CD86 protein in macrophages detected by Western blot.Mean±SD. n=3.*P<0.05 vs control group;#P<0.05 vs 50 μg/L LPS group.图1 Western blot检测巨噬细胞CD86蛋白的表达
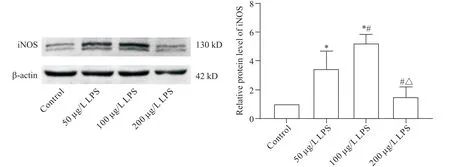
Figure 2.The expression of iNOS protein in macrophages detected by Western blot.Mean±SD. n=3.*P<0.05 vs control group;#P<0.05 vs 50 μg/L LPS group;△P<0.05 vs 100 μg/L LPS group.图2 Western blot检测巨噬细胞iNOS蛋白的表达
免疫荧光结果显示,0、50、100 和200 μg/L 的LPS刺激巨噬细胞24 h后,与对照组(即0 μg/L组)相比,巨噬细胞上的CD86 和iNOS 蛋白表达均不同程度地升高,激光共聚焦显微镜下观察到绿色荧光亮度增强,各组CD86 蛋白的相对表达量分别为0.03±0.00、0.05±0.00、0.06±0.00 和0.05±0.01,各 组iNOS 蛋白的相对表达量分别为0.05±0.01、0.06±0.00、0.08±0.00 和0.07±0.01;当LPS 浓 度 为100 μg/L 时,CD86 及iNOS 蛋白表达最高,激光共聚焦显微镜下观察到绿色荧光亮度最亮,与对照组及50 μg/L LPS 组相比,差异均具有统计学意义(P<0.05),见图3、4。
3 流式细胞术检测100 μg/L LPS 刺激RAW264.7巨噬细胞后M1型巨噬细胞所占比例
免疫荧光及Western blot 结果显示100 μg/L LPS组M1 型标志物CD86 和iNOS 蛋白表达最高,进一步通过流式细胞术检测100 μg/L LPS 组M1 型巨噬细胞所占比例,结果显示,100 μg/L LPS组CD86阳性细胞百分率为(95.60±3.21)% ,显著高于对照组[(39.17±2.62)%,P<0.01],见图5。
4 M1巨噬细胞抑制MB49细胞的活力
M0、M1 巨噬细胞与小鼠膀胱癌细胞MB49 共培养后,CCK-8 实验检测各组MB49 细胞活力。结果显示,与单独的MB49 组(1.00±0.00)相比,MB49+M0组细胞活力(0.96±0.01)显著下降(P<0.01);与MB49+M0 组相比,MB49+M1 组细胞活力(0.77±0.02)显著下降(P<0.01),见图6。
5 M1型巨噬细胞抑制MB49细胞的迁移能力
M0、M1 巨噬细胞与小鼠膀胱癌细胞MB49 共培养后,细胞划痕测各组MB49细胞迁移能力。结果显示,MB49 组细胞的迁移面积为(30.83±1.90)%,MB49+M0 组细胞的迁移面积为(21.85±0.56)%;与MB49 组及MB49+M0 组相比,MB49+M1 组MB49 细胞的迁移面积为(10.00±0.84)%,迁移能力受到显著抑制(P<0.01),见图7。

Figure 3.Immunofluorescence detection of CD86 expression on the surface of macrophages.The scale bar=50 μm.Mean±SD. n=4.*P<0.05 vs control group;#P<0.05 vs 50 μg/L LPS group;△P<0.05 vs 100 μg/L LPS group.图3 免疫荧光检测巨噬细胞表面CD86的表达
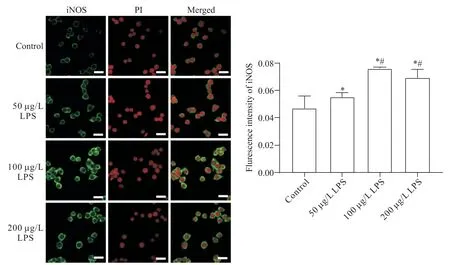
Figure 4.Immunofluorescence detection of iNOS expression on the surface of macrophages.The scale bar=50 μm.Mean±SD. n=5.*P<0.05 vs control group;#P<0.05 vs 50 μg/L LPS group;△P<0.05 vs 100 μg/L LPS group.图4 免疫荧光检测巨噬细胞表面iNOS的表达
6 M1型巨噬细胞抑制MB49细胞的迁移和侵袭能力
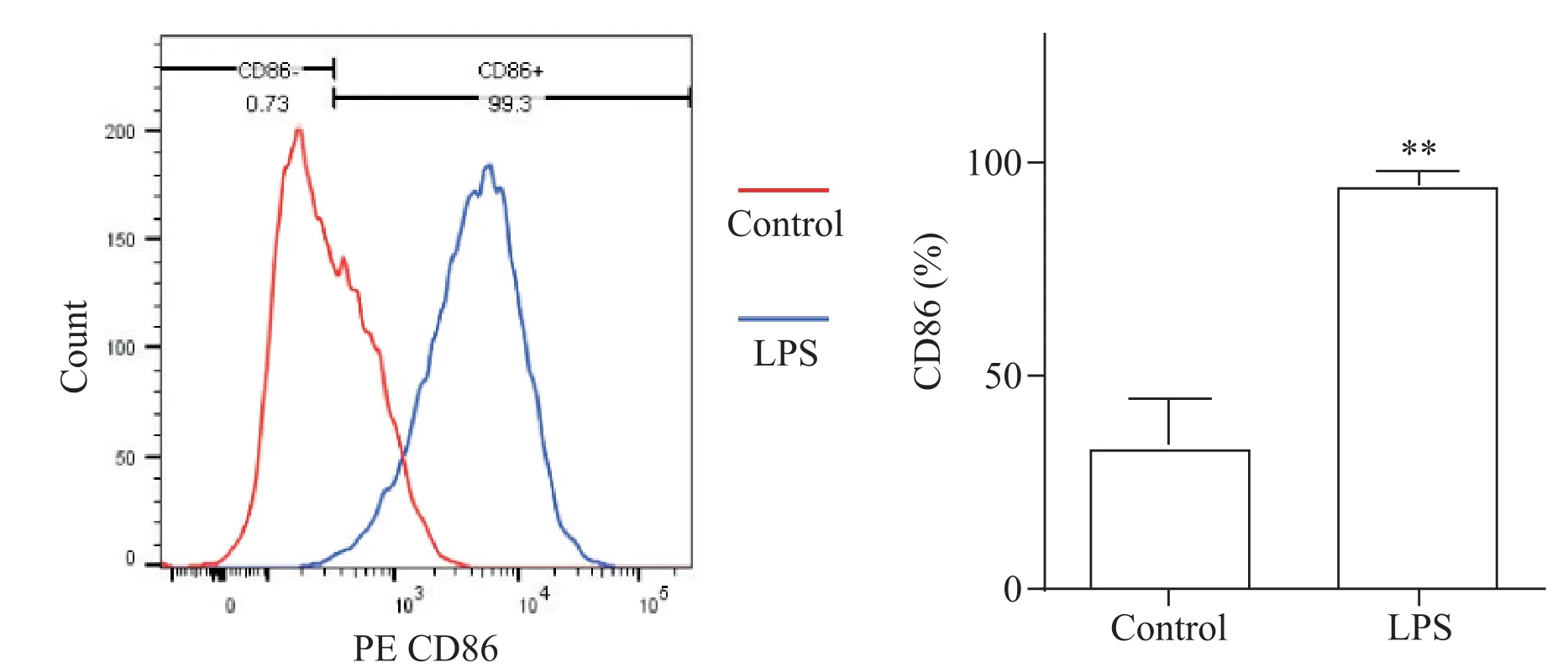
Figure 5.Flow cytometric detection of CD86 expression in macrophages.Mean±SD. n=4.**P<0.01 vs control group.图5 流式细胞术检测巨噬细胞CD86的表达
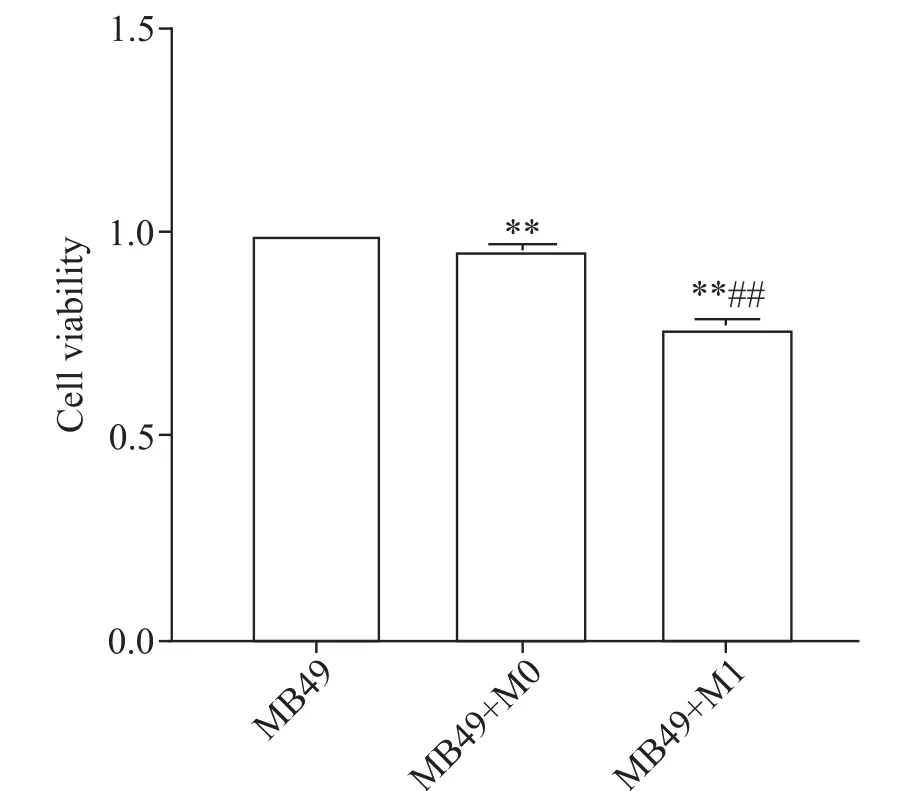
Figure 6.The viability of MB49 cells in each group detected by CCK-8 assay.Mean±SD. n=4.**P<0.01 vs MB49 group;##P<0.01 vs MB49+M0 group.图6 CCK-8检测各组MB49细胞活力
M0、M1 巨噬细胞与小鼠膀胱癌细胞MB49 共培养后,Transwell实验检测各组MB49细胞迁移和侵袭能力。(1)迁移能力:MB49+M1 组迁移至Transwell 小室滤膜下表面的细胞数为63.8±5.7,显著(P<0.01)低于MB49 组(214.0±13.7)和MB49+M0 组(167.2±13.0);(2)侵袭能力:MB49+M1 组侵袭至Transwell小室滤膜下表面的细胞数为32.0±4.6,显著(P<0.01)低 于MB49 组(160.8±9.9)和MB49+M0 组(131.2±8.0),见图8。
7 M1型巨噬细胞促进MB49细胞的凋亡
M0、M1 巨噬细胞与小鼠膀胱癌细胞MB49 共培养后,Hoechst 33258染色检测各组MB49细胞凋亡情况。结果显示,MB49 组凋亡细胞百分率为(11.80±0.84)%;与MB49 组相比,MB49+M0 组凋亡细胞百分率为(16.04±1.97)%,细胞凋亡数量显著增多(P<0.01);与MB49 组及MB49+M0 组相比,MB49+M1 组凋亡细胞百分率为(47.46±3.74)%,细胞凋亡数量显著增多(P<0.01),见图9。
8 ELISA检测各组炎症因子IL-6水平
ELISA 检测各组炎症因子IL-6 的分泌水平,结果显示,MB49+M1 组细胞培养上清液中IL-6 的浓度为(72.11±3.66)ng/L,显著(P<0.05)高于MB49 组[(26.89±10.78) ng/L]和MB49+M0 组[(46.11±6.83)ng/L],见图10。
讨 论
肿瘤相关巨噬细胞是肿瘤微环境的关键细胞,在肿瘤存活和进展中起着关键性作用,能响应于各种微环境信号从而改变它的功能表型,主要分为M1型和M2型巨噬细胞[14-15]。
根据以往的研究,M1 型巨噬细胞一直被认为对肿瘤的生长起抑制作用,而M2型巨噬细胞促进肿瘤的生长[2,15]。Jiang 等[16]的研究表明,M1 型巨噬细胞抑制食管鳞状细胞癌细胞的迁移和侵袭。在肺癌中,M1 型巨噬细胞抑制肿瘤细胞增殖并诱导其凋亡,发挥抗肿瘤作用[17]。但近年来有研究表明,M1型巨噬细胞存在促瘤的作用,Jin等[8]观察到M1型巨噬细胞可促进脑胶质瘤U251 细胞的侵袭;Bednarc‑zyk 等[7]检测到M1 型巨噬细胞能诱导乳腺癌细胞T47-D 和MCF-7 发生EMT,并增强细胞的迁移和侵袭能力,靶向M1巨噬细胞可能会抑制EMT并限制乳腺癌的侵袭潜力。目前M1 型巨噬细胞对肿瘤是促进还是抑制作用仍然存在争议,M1 型巨噬细胞在膀胱癌发生和进展中的作用仍不明确,有待进行更多的基础研究。因此,本研究旨在体外明确M1型巨噬细胞对小鼠膀胱癌细胞株的影响。
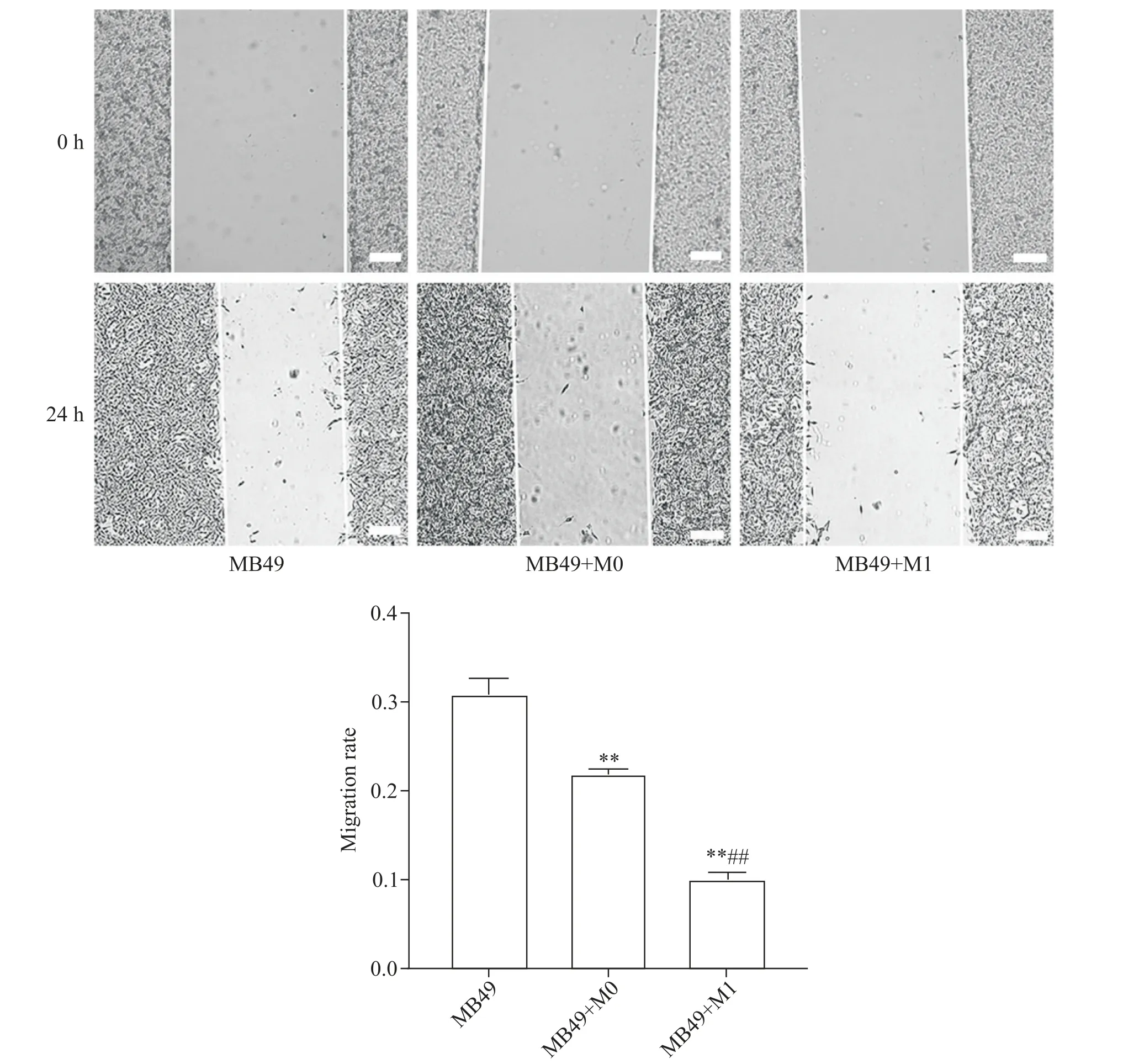
Figure 7.The migration of MB49 cells in each group detected by scratch assay.The scale bar=50 μm.Mean±SD. n=6.**P<0.01 vs MB49 group;##P<0.01 vs MB49+M0 group.图7 划痕实验检测各组MB49细胞迁移情况
肿瘤微环境中巨噬细胞的极化与膀胱癌的发生发展相关[18-20]。Takeuchi 等[19]表明,高密度M2 型巨噬细胞在膀胱癌中可影响微血管、病理结果、肿瘤分级和侵袭性,是预后较差的因素。有体外实验和裸鼠移植瘤模型实验均证实,M2 型巨噬细胞会抑制膀胱癌细胞凋亡,从而促进膀胱癌的增殖和侵袭[20]。而M1 型巨噬细胞与膀胱癌细胞的关系研究甚少。有研究观察到,在外界刺激下,巨噬细胞会发生极化,表型、形态及功能方面的改变,通常会以旁分泌的方式分泌一些物质来调节肿瘤细胞的存活和侵袭[18]。为了观察微环境中M1 型极化的巨噬细胞对膀胱癌的影响,本实验选用小鼠RAW264.7 巨噬细胞和小鼠膀胱癌细胞株MB49 为研究模型。在体外先将RAW264.7 巨噬细胞诱导为M1 亚型,通过对M1 型巨噬细胞表型标志物CD86 和iNOS 进行检测[21-22],构建了成功的M1 型巨噬细胞极化模型且极化比例可达90% 以上,为后续研究M1型巨噬细胞和小鼠膀胱癌细胞株MB49 的关系奠定了实验基础。本研究随后将M1 型巨噬细胞与小鼠膀胱癌细胞株MB49通过Transwell小室在体外进行双层共培养,观察癌细胞MB49活力、迁移能力和侵袭能力的变化及细胞凋亡的情况,结果显示M1型巨噬细胞与小鼠膀胱癌细胞株MB49 共培养后,膀胱癌细胞活力降低,迁移和侵袭能力减弱,细胞凋亡增多,说明M1 型巨噬细胞能抑制小鼠膀胱癌细胞的生长。在以往对膀胱癌的研究中,Dufresne 等[23]观察到与M1 型巨噬细胞共培养的膀胱癌细胞株T24 其活细胞数量较低,同时M1 巨噬细胞衍生因子抑制T24 细胞生长;在裸鼠膀胱癌皮下移植瘤模型中,PD-1 抑制剂nivdumab可使肿瘤组织中M2 型巨噬细胞向M1 型极化,抑制皮下移植瘤的生长速度[20],这与我们的研究结果相一致,证明了M1 巨噬细胞在膀胱癌中起抑癌作用。为了进一步探究微环境中分泌因子与膀胱癌细胞之间的关系,本实验观察了各组中炎症因子IL-6 的浓度,结果显示MB49+M1 组的IL-6 浓度要显著高于其它组。而M1 型巨噬细胞高分泌促炎因子IL-6,推测M1 型巨噬细胞可能通过分泌促炎因子来影响癌细胞的生长。研究也显示,猪苓多糖可通过促进巨噬细胞中促炎因子如IL-1β、TNF-α和iNOS以及表面分子CD86、CD16、CD23和CD40的表达,将巨噬细胞极化为M1型,从而可以抑制膀胱癌细胞T24和EJ细胞的增殖,调节其凋亡,并抑制迁移和EMT[24]。这些研究进一步支持了我们的推测,说明M1型巨噬细胞分泌的促炎因子可以抑制膀胱癌的生长。但我们在本实验中只检测了一种炎症因子的分泌,且肿瘤具有异质性,其微环境作用关系较为复杂,有待更多的研究去证明其中的作用关系。
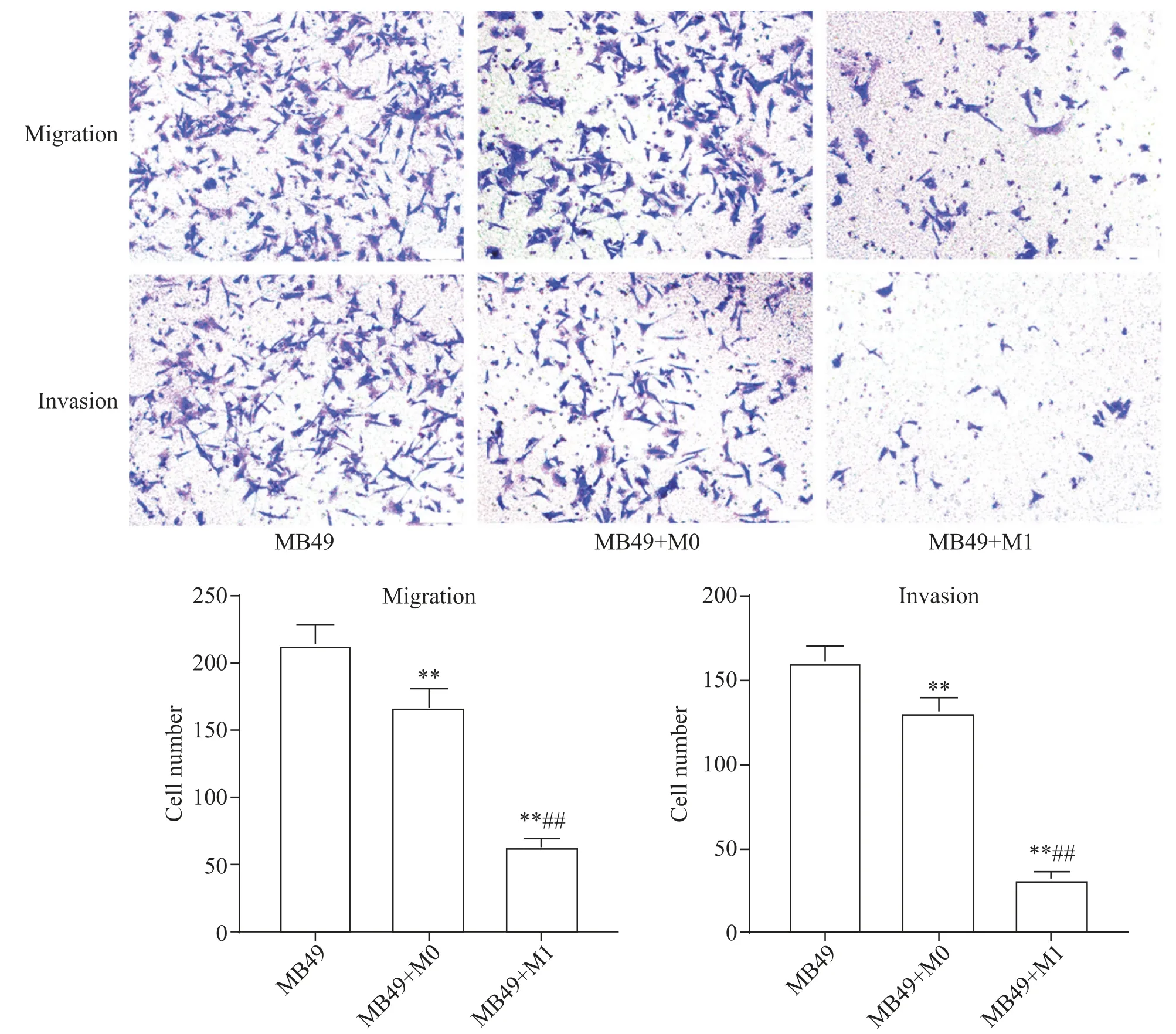
Figure 8.The migration and invasion abilities of MB49 cells in each group detected by Transwell assay.The scale bar=100 μm.Mean±SD. n=3.**P<0.01 vs MB49 group;##P<0.01 vs MB49+M0 group.图8 Transwell实验检测各组MB49细胞迁移和侵袭能力
综上所述,肿瘤微环境中巨噬细胞极化表型的改变影响膀胱癌发展,M1 型巨噬细胞能够抑制小鼠膀胱癌细胞的活力、迁移与侵袭,促进膀胱癌细胞的凋亡。目前刺激肿瘤相关巨噬细胞从M2型到M1型转变已成为肿瘤免疫治疗的一种有前途的策略。有研究通过研发智能纳米药物刺激巨噬细胞表型变化来抑制肿瘤的生长和转移[25]。因此,通过改变膀胱癌微环境中的巨噬细胞极化表型,使其向M1型极化可能是治疗膀胱癌的潜在方式,而我们的这一研究也为临床上膀胱癌的治疗提供了参考资料。
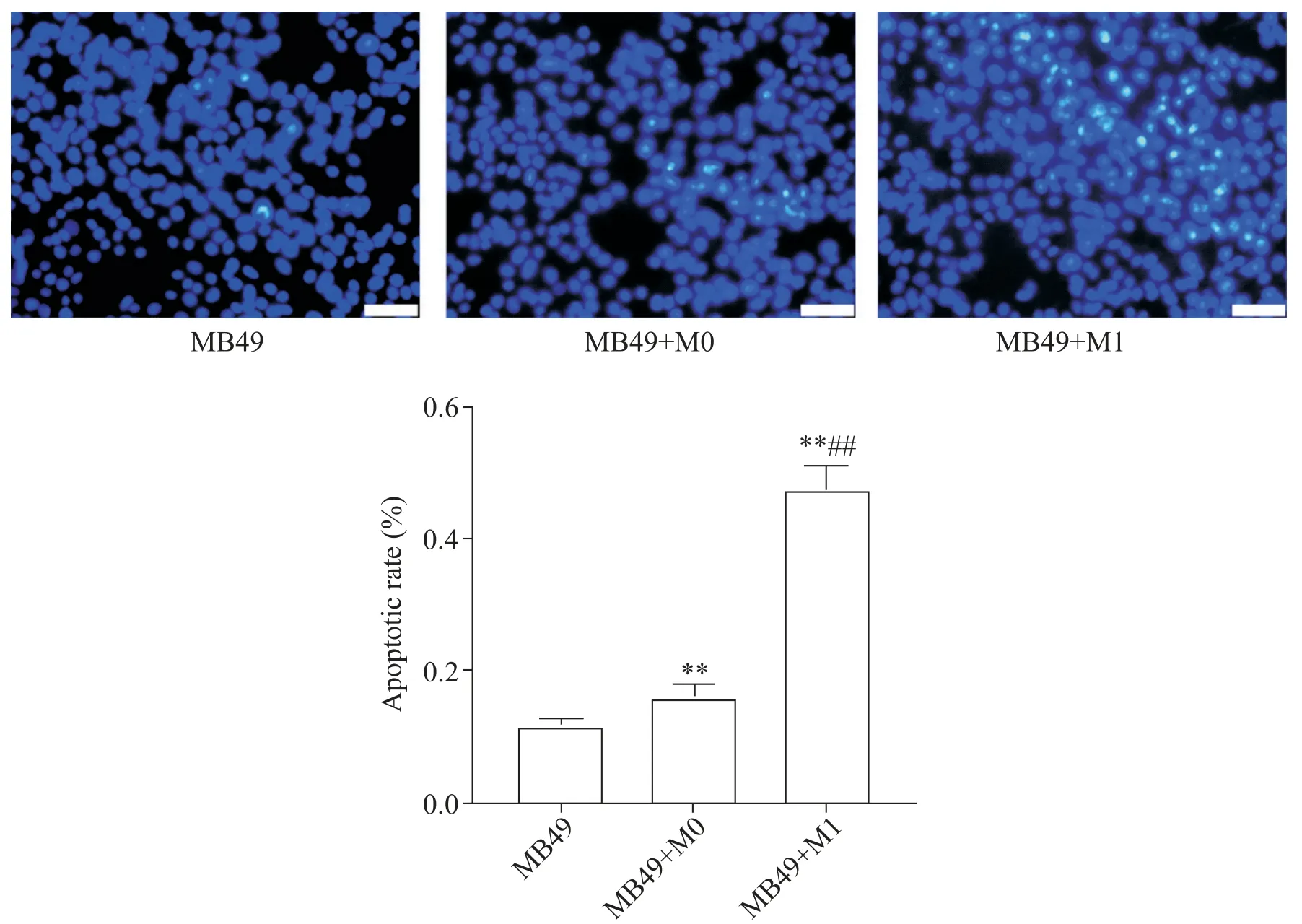
Figure 9.The apoptosis of MB49 cells in each group detected by Hoechst 33258 staining.The scale bar=50 μm.Mean±SD. n=6.**P<0.01 vs MB49 group;##P<0.01 vs MB49+M0 group.图9 Hoechst 33258染色检测各组MB49细胞凋亡情况

Figure 10.The secretion levels of inflammatory factor IL-6 de‑tected by ELISA.Mean±SD. n=3.*P<0.05 vs MB49 group;#P<0.05 vs MB49+M0 group.图10 ELISA检测各组炎症因子IL-6的分泌水平

