好氧反硝化芽孢杆菌JD-014的分离鉴定及脱氮性能
杨 婷, 辛 瑜, 时 祎, 张 梁*, 石孔泉, 张丽娜
(1.江南大学 粮食发酵工艺技术国家工程实验室,江苏 无锡 214122;2.江南大学 生物工程学院,江苏 无锡 214122;3.江苏大有生物科技发展有限公司,江苏 无锡 214122)
近年来,随着食品行业的迅猛发展,食品加工废水的生成量日益增多,尤其是对于腌制类制品和肉制品等的加工过程,更是产生了大量含高浓度氮的有机废水[1-2]。这些不经彻底处理的废水排放会额外增加水体中氮素污染物的积累,不仅导致水体的富营养化,影响水生生物正常的生理机能,还会进一步威胁到人类的健康安全[3-5]。因此,如何有效降低食品工业废水中氮素污染已成为食品工业发展的当务之急[6]。生物脱氮技术目前已被证实是处理氮素污染最经济高效且绿色环保的方法,并已得到广泛的应用[7-8]。其中,好氧反硝化菌的发现打破了传统反硝化只能在严格厌氧条件下进行的限制,好氧反硝化菌可以直接在有氧条件下将氮污染物转化为无害的气态氮,在有效去除氮素污染中表现出了更强的优势和潜力[9-10]。
目前,越来越多的好氧反硝化菌从不同的环境中分离筛选出来,如假单胞菌属(Pseudomonas sp.)[11]、产 碱 杆 菌 属 (Alcaligenes sp.)[4]、 不 动 杆 菌 属(Acinetobacter sp.)[12]、芽孢杆菌属 (Bacillus sp.)[13]等。相较于大多数革兰氏阴性反硝化菌株,反硝化芽孢杆菌是典型的革兰氏阳性菌,具有抗逆性强、可适环境多样、代谢过程中能产生大量胞外酶和维生素等优势。同时,由于大多数芽孢杆菌属于非致病菌,其生物安全性能可靠,在食品工业废水处理领域的氮素去除方面具有更大的应用价值[13-15]。但对于芽孢杆菌相关的好氧反硝化特性以及脱氮代谢机理还未得到明确解析。
基于此,作者从江苏省无锡市某河道中分离筛选出一株具有好氧反硝化功能的菌株,经鉴定为Bacillus subtilis,对该菌株在好氧条件下的反硝化特性和脱氮途径进行了验证,同时探究了不同环境因素对该菌株脱氮性能的影响,以期为反硝化芽孢杆菌在食品加工的废水脱氮处理方面提供理论参考。
1 材料与方法
1.1 材料
1.1.1 样品来源样品取自江苏省无锡市某河道的水体及活性污泥中。
1.1.2 培养基
1)富集培养基(LB培养基,g/L):NaCl 10.0,蛋白胨10.0,酵母浸粉5.0。
2)初筛培养基(BTB培养基,g/L):NaNO30.84,丁 二 酸 钠8.5,KH2PO41.0,FeSO4·7H2O 0.59,MgSO4·7H2O 1.0,CaCl20.09,1 g/dL溴百里酚蓝1 mL。
3)反 硝 化 培 养 基 (DM培 养 基,g/L):NaNO30.84, 丁 二 酸 钠8.5,Na2HPO44.0,KH2PO41.5,MgSO4·7H2O 0.2;微量元素溶液2 mL。其中,微量元素溶液(g/L):EDTA 50.0,ZnSO4·7H2O 3.92,MnCl2·4H2O 5.06,FeSO4·7H2O 5.0,CoCl2·6H2O 1.61,CaCl25.5,(NH4)6Mo7O2·4H2O 1.1,CuSO4·5H2O 1.57。研究菌株的耐亚硝酸盐特性时,将NaNO3替换为NaNO2作为唯一氮源。
另加入2 g/dL的琼脂至LB培养基和BTB培养基中形成固体LB培养基和BTB培养基。所有培养基在121℃下高压蒸汽灭菌20 min。
1.2 方法
1.2.1 好氧反硝化菌株的分离与筛选分别取2 mL水体样品或2 g污泥样品加入到98 mL灭菌后的新鲜LB培养基中,于37℃、200 r/min条件下培养24 h后转接2 mL菌液至新的LB培养基中富集培养,重复3次。将富集后的菌液按梯度稀释法稀释成1×10-1~1×10-9倍,取100 μL菌液涂布于固体LB培养基平板上培养。挑取不同形态的单菌落进行多次划线纯化,并将纯化后的菌株点样于BTB固体培养基中,置于30℃的生化培养箱培养72 h。根据BTB培养基颜色的变化情况初步筛选出具有反硝化能力的菌株。然后,将初筛得到的菌株接种到反硝化培养基DM培养基中,37℃、200 r/min振荡培养72 h后测定NO3--N的质量浓度,选取脱氮率最高的菌株作为目标菌株。
1.2.2 好氧反硝化菌株的鉴定将目标菌株在LB培养基中活化后,利用Biospin细菌DNA提取试剂盒提取基因组DNA,以此为模板,采用细菌16S rDNA通用引物27F(5′-AGAGTTTGATCCTGGCTC AG-3′)和1492R(5′-GGTTACCTTGTTACGACTT-3′)进行PCR扩增。PCR反应体系:2×Taq PCR Master Mix 50 μL,DNA模板1 μL,上下游引物各1 μL,灭菌后的ddH2O定容至100 μL。PCR扩增条件:95℃预变性5 min;94℃变性30 s,55℃退火30 s,72℃延伸1.5 min,30个循环;72℃延伸10 min,4℃保存。扩增后的产物通过1.5 g/dL琼脂糖凝胶电泳检测正确后送至上海生工生物工程股份有限公司进行测序,并将测序结果提交GenBank数据库。通过BLAST比对分析后,选取其他同源性较高的序列,利用Neighbor-Joining法在MEGA 5.2软件构建系统发育树。
1.2.3 好氧反硝化菌株脱氮过程中氮平衡估算为了进一步阐明目标菌株的脱氮途径,采用血清瓶密封培养的方式,通过充入混合气O2和He(体积比约为21∶79)排除瓶内的空气,在37℃、200 r/min的条件下培养120 h后采集血清瓶内顶空的气体,对目标菌株脱氮过程中的O2和N2进行测定。以未接种菌液的血清瓶样品作为空白对照,同时测定脱氮前后相关氮素物质的质量,对其氮平衡进行估算。
1.2.4 目标菌株好氧反硝化酶活测定收集在DM培养基中培养至对数中期的目标菌株菌体,洗涤3次并利用超声破碎法进行细胞破碎,离心后对其上清液进行硝酸盐还原酶(Nap)和亚硝酸盐还原酶(Nir)酶活的测定。测定方法参考文献[13]。
1.2.5 好氧反硝化菌株的脱氮性能影响因素研究将LB培养基中培养至对数期的菌液接种于以NO3--N为唯一氮源的DM培养基中,使其初始OD600保持在0.1。通过改变培养基中的碳源、C/N、温度、转速及盐度,研究不同环境因素对菌株好氧反硝化性能的影响。其中,碳源种类分别为葡萄糖、蔗糖、甘油、丁二酸钠和柠檬酸钠;C/N分别为5、10、15、20、25;温度设置为20、25、30、37℃;转速依次设置为50、100、150、200、250 r/min;盐度设置分别添加NaCl的质量分数为1%、3%、5%、10%。控制单一变量,其余基本条件分别为:温度为37℃,转速为200 r/min,C/N为10,碳源为丁二酸钠,氮源为NaNO3。摇床培养72 h后,考察目标菌株的生长状态以及NO3--N质量浓度的变化。
1.2.6 好氧反硝化菌株耐亚硝酸盐的特性研究在以NO2--N为唯一氮源的DM培养基中,保持C/N为10不变,通过改变NaNO2的添加量从而调整培养基中初始NO2--N质量浓度分别为10、50、100、150、200、300 mg/L,在37℃、200 r/min条件下培养,每24 h取样,考察目标菌株的生长状态以及NO2--N质量浓度的变化。
1.2.7 测定方法定期取样5 mL,室温下于12 000 r/min离心10 min,然后取其上清液进行理化指标的测定。菌体生物量(OD600)采用分光光度法。氮化合物指标的测定参照文献[16],其中NO3--N采用紫外分光光度法测定,NO2--N采用N-(1-萘基)-乙二胺分光光度法测定,NH4+-N采用纳氏试剂分光光度法测定,TN(总氮)采用碱性过硫酸钾消解紫外分光光度法测定,胞内氮根据离心前后菌液TN的差值计算,N2和O2采用配有TCD检测器的气相色谱仪测定。
1.2.8 数据分析采用SPSS 19.0进行单因素方差分析,组间比较采用Duncan’s检验法,P<0.05代表统计学意义上差异显著。
2 结果与分析
2.1 菌株JD-014的分离鉴定
从富集培养及分离纯化后的好氧反硝化初筛菌株中,通过对反硝化性能的评估,复筛得到1株对硝态氮降解能力最强的菌株,将其命名为JD-014。通过对16S rDNA基因测序分析,菌株JD-014序列全长为1 538 bp,将16S rDNA基因序列提交至GenBank数据库,登录号为MK124647。将该序列与数据库中已有细菌的16S rDNA序列BLAST比对分析后,发现菌株JD-014与Bacillus subtilis的相似度高达99%以上,初步确定该菌株为枯草芽孢杆菌(Bacillus subtilis)。以Neighbor-Joining法构建 的系统发育树如图1所示。

图1 菌株JD-014基于16S rRNA基因的系统发育树Fig.1 Phylogenetic tree constructed from 16S rRNA gene sequences of strain JD-014
2.2 菌株JD-014的好氧反硝化性能
如图2所示,在以50 mg/L NO3--N为唯一氮源的DM培养基中,菌株JD-014生长良好,24 h后进入对数生长期,在48 h时菌体生长达到最大,最高OD600为1.24。随着菌株JD-014的不断生长,NO3--N呈现出减少的趋势,72 h后NO3--N质量浓度降为12.32 mg/L,去除率达到76.57%,去除速率为0.56 mg/(L·h),与目前有关报道具有好氧反硝化性能的Bacillus sp.相比,菌株JD-014的去除速率低于菌株B.cereus GS-5(2.69 mg/(L·h))[17],但却高于菌 株B.subtilis BRAZ2B(0.53 mg/(L·h))[18]、Bacillus sp.LY(0.35 mg/(L·h))[19]以及B.cereus X7(0.32 mg/(L·h))[20]。这表明本实验中获得的芽孢杆菌JD-014具有较强的氮素去除能力。此外,培养后期由于菌体的生长进入衰亡期,导致NH4+-N的质量浓度有所升高。
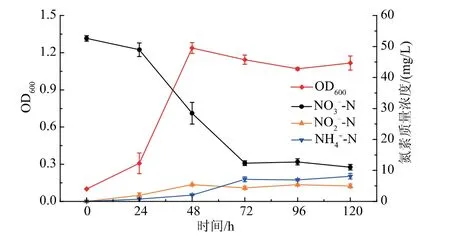
图2 菌株JD-014的生长及脱氮特性Fig.2 Growth and nitrogen removal characteristic of strain JD-014
2.3 菌株JD-014的好氧反硝化途径初步验证
将菌株JD-014在血清瓶密封培养120 h,发现血清瓶顶空能够检测到一定量的N2产生,并且瓶中O2的体积分数由最初的20.7%消耗至8.8%。通过氮平衡比较,菌株JD-014脱氮前后的氮素变化发现(见表1)。当NO3--N为唯一氮源时,菌株JD-014能将18.27%的初始氮源转变为胞内氮,而25.77%的初始氮源则以气态氮(N2)产物的形式逸出。此外,在摇瓶条件下的细胞破碎上清液中也检测到了硝酸盐还原酶和亚硝酸盐还原酶的酶活,其比酶活分别为(4.25±0.75)、(2.61±0.59)mU/mg。由此可见,菌株JD-014能够通过好氧反硝化途径进行氮素的去除。

表1 菌株JD-014氮平衡计算Table 1 Nitrogen balance of strain JD-014
2.4 不同环境因素对菌株JD-014好氧反硝化性能的影响
2.4.1 碳源对菌株JD-014好氧反硝化性能的影响在反硝化进程中,碳源通常作为异养细菌的能量来源和电子供体[21]。如图3所示,不同种类的碳源对菌株JD-014的生长和NO3--N的去除率存在着显著影响。在分别以丁二酸钠、柠檬酸钠为唯一碳源时,菌株JD-014生长良好,并在好氧条件下可保持较好的脱氮能力;在72 h时,菌株JD-014对NO3--N的去除率分别达到76.59%和71.99%。而当碳源为葡萄糖、蔗糖和甘油时,菌株JD-014的生长状态和脱氮性能远远差于以丁二酸钠和柠檬酸钠为碳源时的情况,并且差异显著(P<0.05),以上述3类为碳源时,菌株JD-014对NO3--N的去除率都仅为20%左右。这可能是由于丁二酸钠和柠檬酸钠能够直接参与细胞TCA循环,从而更易被菌株高效利用,而葡萄糖和蔗糖等大分子有机物要先水解成小分子的有机酸后才能被微生物利用[4,21]。本实验结果也与菌株Holomonas sp.Y8[22]以及Pseudomonas sp.HG7[23]在利用有机酸作为碳源时脱氮率更高的结果相一致。
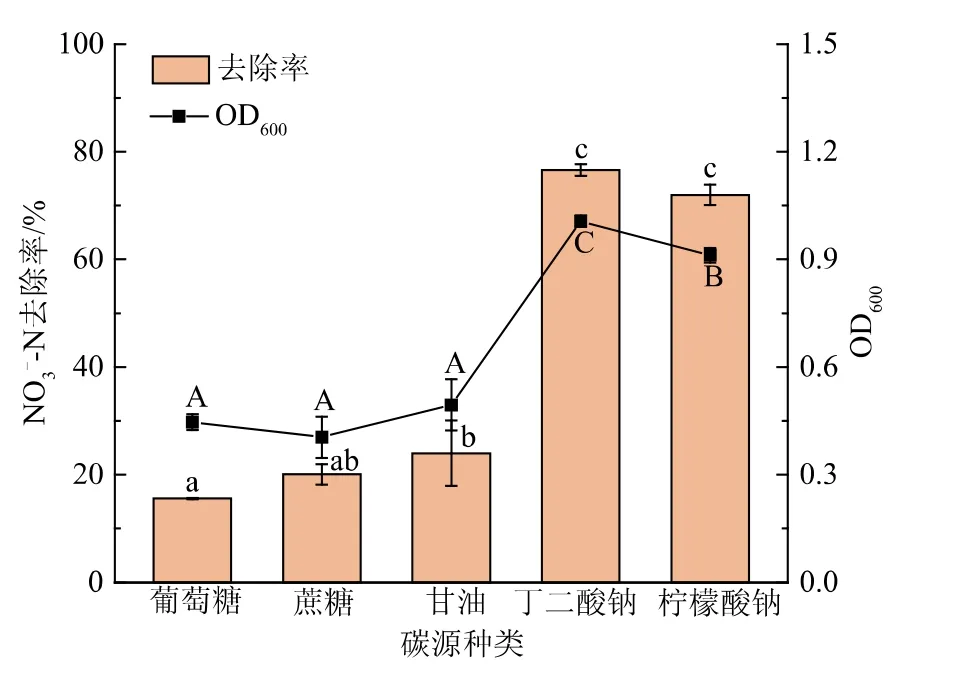
图3 碳源对菌株JD-014生长及脱氮性能的影响Fig.3 Effect of carbon sources on growth and nitrogen removal characteristic of strain JD-014
2.4.2 C/N对菌株JD-014好氧反硝化性能的影响C/N是影响反硝化进程的关键因素之一,C/N较小时,由于碳源的不足导致提供的电子数缺乏,从而抑制菌株的生长,使得脱氮效率有所降低[24]。如图4所示,当C/N为5时,由于提供的碳源不足导致菌株JD-014生长缓慢,OD600仅为0.45,对NO3--N的去除率也较低,为34.90%;当C/N增加至10时,菌株JD-014的生长及对NO3--N的去除均明显提高,NO3--N的去除率为73.40%;当C/N继续增加至15、20和25后,菌株JD-014的生长无明显差异(P>0.05),对NO3--N的去除率分别为72.76%、69.20%、68.79%。这与菌株Cupriavidus sp.S1[25]随着C/N从4增加到12,NO3--N的去除率不断增加,C/N继续升高到28时,脱氮率基本不变的研究结论相似;而高于菌株Klebsiella quasipneumoniae HY3-2[26]好氧反硝化在最佳C/N为2时的去除率。此外,在作者所在团队之前的研究中发现,当固定C/N为10,改变碳源质量浓度分别为100、500、1 000、2 000、3 000 mg/L时,菌株JD-014的生长速率会随着碳源质量浓度的增加而不断升高,而对NO3--N的去除率可以保持在50.07%~94.06%[13]。
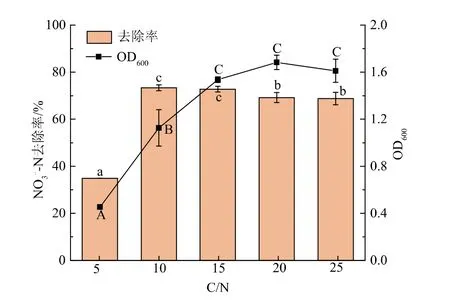
图4 C/N对菌株JD-014生长及脱氮性能的影响Fig.4 Effect of C/N ratio on growth and nitrogen removal characteristic of strain JD-014
2.4.3 温度对菌株JD-014好氧反硝化性能的影响温度对菌株的生长和脱氮性能也会产生影响。温度过高或过低,都会影响细胞内相关功能酶的活性,从而抑制菌体的生长,不利于好氧反硝化的进行。如图5所示,温度对菌株JD-014的生长和脱氮性能存在显著性差异(P<0.05)。在培养温度为20~25℃时,菌株JD-014基本不生长,也基本无法降解NO3--N。由此表明菌株JD-014不能耐受低温环境,在低温条件下脱氮性能明显受到抑制。当温度超过30℃时,菌株JD-014能够正常生长,同时发挥好氧反硝化作用。在温度分别为30℃和37℃条件下,菌株JD-014的菌体生物量OD600分别为0.91和1.13,对NO3--N的去除率分别达到59.47%和76.41%。由此可见,在培养温度为37℃左右时更有利于菌株JD-014好氧反硝化的进行,这与目前报道的大多数好氧反硝化菌的最适脱氮温度为30~37℃相一致[27]。此外,也有一些反硝化菌在极端环境下脱氮效果明显,如菌株Pseudomonas tolaasii Y-11[28]在15℃条件下对NO3--N的去除率达到93.5%,Chelatococcus daeguensis TAD1[29]具有高温脱氮的潜力,50℃下NO3--N的去除率仍在99%以上。
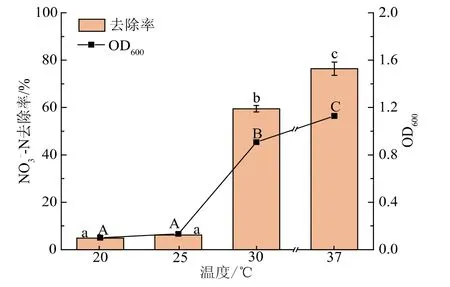
图5 温度对菌株JD-014生长及脱氮性能的影响Fig.5 Effect of temperature on growth and nitrogen removal characteristic of strain JD-014
2.4.4 溶氧对菌株JD-014好氧反硝化性能的影响一般来说,溶氧对大多数反硝化菌株的影响都有一个阈值范围。一定范围内,随着溶氧浓度的提高,菌株的生长代谢活跃旺盛,胞内有关反硝化酶系的表达有所提高,导致脱氮性能增加。而当溶氧超过阈值后,对氮素的去除率反而降低[26,30]。本实验中通过调整摇床的转速来改变溶氧的质量浓度,在转速50、100、150、200、250 r/min的条件下,对应的溶氧质量浓度分别为2.3、3.9、5.0、6.3、6.7 mg/L。如图6所示,随着转速的不断提高,菌株JD-014对NO3--N的去除率呈现出先上升后降低的趋势。转速为50 r/min时,溶氧较低,导致菌株JD-014生长缓慢,OD600为0.33,对 应 的NO3--N的 去 除 率 也 较 低,仅 为15.61%;转速为100~200 r/min时,菌体生物量增加,OD600为0.90~1.10,NO3--N的 去 除 率 提 高 到60.72%~76.96%,进一步说明菌株JD-014是在好氧条件下进行脱氮过程;当转速继续增加到250 r/min时,NO3--N的 去 除 率 显 著 降 低 (P<0.05),为67.30%。由此可见,菌株JD-014发挥好氧反硝化功能较适宜的转速在150~200 r/min,对应的溶氧质量浓度范围为5.0~6.3 mg/L。

图6 转速对菌株JD-014生长及脱氮性能的影响Fig.6 Effect of speed on growth and nitrogen removal characteristic of strain JD-014
2.4.5 盐度对菌株JD-014好氧反硝化性能的影响盐度是好氧反硝化过程进行的一个限制性环境因素。如图7所示,与不含盐度的培养条件相比,当盐度为1%时,菌株JD-014能正常生长和进行相应的好氧反硝化过程,72 h培养后菌体OD600为0.90,NO3--N的去除率达到69.99%;当盐度逐步提高到3%时,菌株JD-014的生长明显受到抑制(P<0.05),OD600仅为0.26,NO3--N的去除率也大幅度降低,为17.83%;当盐度进一步提高到5%和10%时,菌株JD-014由于无法适应高盐浓度的环境,导致菌体几乎不生长,NO3--N的去除率分别为6.58%和4.21%。由此可见,菌株JD-014在1%的盐度下脱氮能力不受影响,但是菌株JD-014具有一定的耐盐潜力,后期可考虑对其进行高盐浓度下的驯化或通过分子手段改造菌株体内的耐盐基因,拓宽菌株JD-014在含盐食品废水脱氮方面的应用范围。

图7 盐度对菌株JD-014生长及脱氮性能的影响Fig.7 Effect of salinity on growth and nitrogen removal characteristic of strain JD-014
2.5 菌株JD-014耐亚硝酸盐的特性研究
高质量浓度的亚硝酸盐对微生物有强烈的毒害作用,一般而言,当NO2--N的质量浓度高于20 mg/L时会抑制反硝化相关酶的活性[31-32]。如图8(a)所示,在以不同质量浓度NO2--N为唯一氮源的好氧反硝化体系中,当NO2--N质量浓度在10~150 mg/L时,菌株JD-014的菌体生物量随着NO2--N质量浓度的增加而升高,对应的OD600最大值分别为0.41、0.72、1.58和1.98;当NO2--N质量浓度进一步提高到200 mg/L和300 mg/L时,菌株JD-014的生长受到一定程度的抑制。菌株JD-014对NO2--N的脱除效果是随着NO2--N质量浓度的增加而依次降低。如图8(b)所示,当NO2--N质量浓度为10 mg/L时,对NO2--N的去除率可以高达99.92%;而当NO2--N质量浓度增加到50、100、150、200、300 mg/L时,NO2--N的去除率分别降低为79.68%、64.19%、58.82%、46.62%和35.02%。文献报道,菌株Bacillus sp.YX-6[32]是一株具有耐NO2--N毒性的好氧反硝化芽孢杆菌,在20 mg/L的NO2--N质量浓度下脱氮率几乎为100%;随着NO2--N质量浓度的增加,Bacillus sp.YX-6对NO2--N的去除率逐渐下降,当其质量浓度提高到100 mg/L时,脱氮率仅为20%。而本研究筛选的同属芽孢杆菌JD-014则能适应于更大范围NO2--N质量浓度,在50~200 mg/L该菌株均能发挥较好的好氧反硝化作用,其脱氮率在45%~80%。由此可见,菌株JD-014在处理高质量浓度亚硝酸盐食品废水中具有巨大的潜在应用价值。

图8 菌株JD-014在不同质量浓度NO2--N下的生长及脱氮特性Fig.8 Growth and nitrogen removal characteristic of strain JD-014 under different concentration of NO2--N
综上,本研究中所筛选的食品安全型微生物Bacillus subtilis JD-014由于其自身具有的独特优势以及所具备的高效好氧反硝化脱氮性能,使其可以广泛适用于多种食品行业加工废水的氮素污染生物处理,如肉制品加工废水(通常含有高质量浓度总氮50~841 mg/L)、啤酒加工废水(总氮质量浓度25~450 mg/L)、乳制品加工废水(总氮质量浓度300~400 mg/L)、腌制品加工废水(总氮质量浓度100~1 000 mg/L)、马铃薯加工废水(总氮质量浓度约620 mg/L)、豆制品加工废水(总氮质量浓度约267.1 mg/L)等[2,33-35]。此外,针对一些高质量浓度亚硝酸盐的食品废水,菌株JD-014具有对高质量浓度亚硝酸盐良好的耐受性,在这类高氮废水处理中更占优势,从而能更好地促进水体健康持续发展。
3 结语
本研究从江苏省无锡市某河道水体中筛选出1株具有好氧反硝化性能的菌株JD-014,经16S rDNA序列比对及系统发育分析,初步鉴定为枯草芽孢杆菌(Bacillus subtilis)。在以50 mg/L NO3--N为唯一氮源时,NO3--N去除速率为0.56 mg/(L·h)。通过气态氮的产生、氮平衡估算以及酶活测定等方面分析,证实了菌株JD-014可以通过好氧反硝化途径进行氮素去除。此外,对不同环境因素分析中发现,菌株JD-014在丁二酸钠和柠檬酸钠为碳源、C/N为10~25、温度为37℃、转速为150~200 r/min、盐度为1%以下时具备最佳的好氧反硝化性能。此外,菌株JD-014还具有较好的亚硝酸盐耐受性,在NO2--N质量浓度高达200 mg/L时脱氮率仍可达到46.62%。作者为进一步深入研究芽孢杆菌的好氧反硝化提供了重要理论依据,同时也为食品工业废水中氮素的污染去除提供了优良的候选菌株。

