超声辅助碱溶酸沉法提取鸡腿菇蛋白质工艺优化
李惟栋,王永霞,孙敏,王娜,韩春超*
山东中医药大学药学院(济南 250355)
鸡腿菇(Coprinus comatus)学名毛头鬼伞,属真菌门、担子菌亚门、层菌纲、伞菌目、鬼伞科、鬼伞属。鸡腿菇广泛分布于世界各地,在我国主要产于北方各省[1]。现代研究表明鸡腿菇具有抗氧化[2]、降血糖[3]、减轻肝损伤[4]、抗肿瘤[5]、提高免疫力[6]等功效,且鸡腿菇栽培容易,适应性广,因此针对鸡腿菇的开发和应用前景广阔[7]。
鸡腿菇干品中蛋白质含量占比11.8%~29.5%,其中氨基酸种类齐全,包含人体必需的8种氨基酸,值得强调的是,像鸡腿菇这样的蘑菇中的蛋白质也很容易消化,通常消化率在71%~90%。2 g蘑菇蛋白质等于1 g肉蛋白质。因此,在东欧的蘑菇有时被称为“森林肉”[8]。
针对鸡腿菇蛋白质提取的研究较少,试验采用响应面优化超声波辅助碱溶酸沉法提取鸡腿菇蛋白质的工艺,并测定鸡腿菇蛋白质提取率和纯度,为鸡腿菇蛋白质功能性研究及保健食品的开发提供理论基础。
1 材料与方法
1.1 材料与试剂
鸡腿菇子实体鲜品(徐州菇馨蘑菇农场);考马斯G-250(天津市科密欧化学试剂有限公司);牛血清标准蛋白(北京奥科斯科技有限公司);氢氧化钠(NaOH)、盐酸(HCI)、磷酸(H3PO4)、95%乙醇、硫酸铜(CuSO2·5H2O)、硫酸钾(K2SO4)、硫酸(H2SO4)、对硝基苯酚(C6H5NO3)、乙酸钠(CH3COONa·3H2O)、无水乙酸钠(CH3COONa)、乙酸(CH3COOH)、37%甲醛(HCHO)、乙酰丙酮(C5H8O2):分析纯,国药集团化学试剂有限公司。
1.2 仪器与设备
WD-9415F型超声波清洗器(北京六一生物科技有限公司);EU-2000A紫外可见分光光度计(上海昂科拉仪器有限公司);PHS-3C PH计(上海仪电科学仪器股份有限公司);101型电热鼓风干燥箱(北京市永光明医疗仪器有限公司);TDL-5-A旋转离心机(上海安亭科学仪器厂);FD-1A-50冷冻干燥机(杭州川一实验仪器有限公司)。
1.3 方法
1.3.1 原料处理
取新鲜鸡腿菇置于40 ℃电热鼓风干燥箱中烘干,烘干后将鸡腿菇置于超高速多功能粉碎机中粉碎并过0.180 mm(80目)孔径筛,将鸡腿菇粉末保存于真空干燥器中备用。
1.3.2 鸡腿菇蛋白质提取
取5 g鸡腿菇粉末置于烧杯中,按照相应料液比(1∶10~1∶30 g/mL)加入蒸馏水溶解,用0.1 mol/L NaOH溶液调节鸡腿菇溶液pH 9~13,将烧杯置于超声中,选择相应的超声频率0~200 W,恒温30~70 ℃振荡一定时间(20~100 min)。常温下冷却后离心10 min(4 000 r/min),取上清液,用0.1 mol/L HCl调节pH至等电点,在4 ℃静置沉淀12 h后,离心10 min(4 000 r/min),取沉淀用蒸馏水溶解后用0.1 mol/L NaOH调至中性,使用超滤除去盐和小分子杂质,最后用真空冷冻干燥机冷冻干燥得到鸡腿菇蛋白质粉末。
1.3.3 鸡腿菇蛋白质提取率测定
1.3.3.1 配制考马斯亮蓝溶液
取100 mg考马斯亮蓝G-250溶于50 mL 95%乙醇中,加100 mL 85%磷酸,加水稀释至1 L,棕色瓶保存。
1.3.3.2 牛血清蛋白标准曲线绘制
用 标准的结晶牛血清白蛋白(BSA)配制成20 mg/100 mL的标准蛋白溶液,取6支试管,分别加入0,0.2,0.4,0.6,0.8和1.0 mL的标准蛋白质溶液,用水补足到1 mL,加入4 mL双缩脲试剂。充分摇匀后,在室温(20~25 ℃)下放置15 min,在595 nm处进行比色测定。用未加蛋白质溶液的第1支试管作为空白对照液,以蛋白质的含量为横坐标,吸光度为纵坐标绘制标准曲线。
1.3.3.3 鸡腿菇提取液蛋白含量测定
取2~3支试管,用上述同样的方法,测定未知样品的蛋白质含量。
1.3.3.4 鸡腿菇粉末蛋白质含量测定
采用GB 5009.5—2016凯氏定氮法测定鸡腿菇粉末蛋白质含量。
1.3.3.5 鸡腿菇蛋白质提取率计算
根据式(1)计算鸡腿菇蛋白质提取率。

1.3.4 单因素试验
鸡腿菇蛋白提取工艺中,固定提取工艺条件:pH 11、提取温度40 ℃、提取时间40 min、料液比1∶20 g/mL、超声频率50 W,每次单因素试验取5 g鸡腿菇粉末,分别考察pH(9,10,11,12和13)、提取温度(30,40,50,60和70 ℃)、料液比(1∶10,1∶15,1∶20,1∶25和1∶30 g/mL)、提取时间(20,40,60,80和100 min)、超声频率(0,50,100,150和200 W)这5个因素对鸡腿菇蛋白质提取率的影响,选择pH、提取温度、提取时间、料液比、超声频率5个因素中最优的水平进行后续的响应面试验。
1.3.5 响应面优化
在1.3.4单因素试验的基础上,运用软件设计专家(Design-Expert 12)中的响应面优化设计,以A(pH)、B(提取时间)、C(超声频率)、D(提取温度)这4个单因素为自变量,以鸡腿菇蛋白质提取率为响应值进行工艺条件优化,相关试验因素水平编码见表1。

表1 响应面因素水平编码
1.3.6 等电点测定
用移液枪吸取5组鸡腿菇提取液(pH 11),每组10 mL。分别用0.1 mol/L盐酸调节各组提取液pH至2.5,3.0,3.5,4.0和4.5,在4 ℃静置2 h后,离心(4 000 r/min,10 min),取上清液。用移液枪吸取1 mL上清液,加入4 mL考马斯亮蓝溶液,振荡混匀5 min后,在595 nm处测定吸光度,吸光度的最小值为鸡腿菇蛋白质等电点。
1.3.7 鸡腿菇蛋白质纯度测定
将最优条件下的鸡腿菇提取液调节至鸡腿菇蛋白质等电点,静置1 h后离心取沉淀,将沉淀进行超滤后,冷冻干燥后得到鸡腿菇蛋白质粉末。采用GB 5009.5—2016《食品安全国家标准 食品中蛋白质的测定》中凯氏定氮法测定鸡腿菇蛋白质粉末的蛋白质含量。鸡腿菇蛋白质纯度根据式(2)计算。

2 结果与分析
2.1 单因素试验
2.1.1 pH对鸡腿菇蛋白质提取率的影响
固定提取时间40 min、超声频率50 W、提取温度40 ℃、料液比1∶20 g/mL,不同pH对蛋白质提取率影响如图1所示。随着提取液pH不断升高,蛋白质提取率呈现先上升后下降趋势,其中在pH 9~12的范围内,蛋白质提取率增幅明显,pH 12时提取率达到最大的30.3%,这可能是因为在碱性环境中,蛋白质分子之间相互排斥,同时蛋白质分子的次级键被破坏,从而促进蛋白质溶解度增加[9-10]。pH继续升高时,蛋白质提取率反而下降,这可能是由于过高的pH导致蛋白质过度水解和变性,从而降低了蛋白质溶解度[11]。因此,选择pH 11,12和13进行后续的响应面优化试验。

图1 pH对鸡腿菇蛋白质提取率的影响
2.1.2 提取时间对鸡腿菇蛋白质提取率的影响
固定提取pH 11、超声频率50 W、提取温度40 ℃、料液比1∶20 g/mL,不同提取时间对蛋白质提取率影响如图2所示。在一定范围内,鸡腿菇蛋白质提取率随提取时间的延长,提取率呈上升趋势,在60 min时提取率达到最大值27.31%,但是超过60 min后蛋白质提取率逐步下降,这可能是由于提取时间短,蛋白质溶出不充分,而时间过长导致蛋白质在碱溶液中过度水解和变性,从而使提取率降低,同时增加多余杂质溶出[12]。因此选择提取时间40,60和80 min进行后续响应面优化试验。

图2 提取时间对鸡腿菇蛋白质提取率的影响
2.1.3 超声频率对鸡腿菇蛋白质提取率的影响
如图3所示,随着超声频率增加,蛋白质提取率呈现先上升后下降趋势,超声频率100 W时,蛋白质提取率达到最大值27.56%,这可能是因为随着超声频率增大,空化作用和机械作用愈加强烈,分子扩散速度加快,促进蛋白质溶出[13],同时超声频率过大,可能促进某些蛋白酶溶出或蛋白质变性,导致蛋白质提取率下降[14]。因此选择超声频率50,100和150 W进行响应面优化试验。

图3 超声频率对鸡腿菇蛋白质提取率的影响
2.1.4 温度对鸡腿菇蛋白质提取率的影响
如图4所示,随着温度升高,蛋白提取率也随之增大,温度超过40 ℃时,呈现明显下降趋势。温度低于40 ℃时,温度较低,反应速度较慢,随着温度的上升,分子间运动加剧,有效碰撞次数增多,反应速率的提升导致提取率的上升。40 ℃时蛋白提取率达到最高值,为24.76%,温度超过40 ℃时,高温会破坏蛋白质的空间构象,蛋白质疏水基团展开暴露,蛋白质变性使提取率下降[15-16]。因此选取30,40和50 ℃进行后续的响应面优化试验。
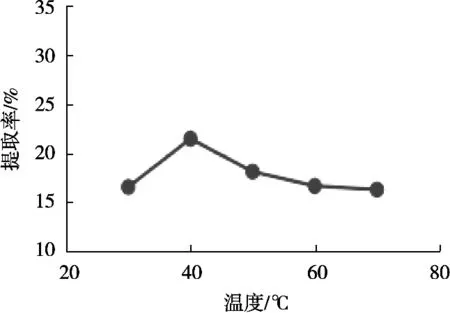
图4 提取温度对鸡腿菇蛋白质提取率的影响
2.1.5 料液比对鸡腿菇蛋白质提取率的影响
如图5所示,随着提取料液比中液体比例增加,蛋白质提取率不断增大,在1∶25 g/mL后蛋白质提取率趋于平稳。

图5 料液比对鸡腿菇蛋白质提取率的影响
2.2 响应面优化试验
2.2.1 响应面试验设计及结果
根据单因素试验结果,以影响鸡腿菇蛋白提取率的提取液pH、提取时间、超声频率、提取温度为自变量,以蛋白提取率为响应面的响应值,利用Box- Behnken共设计29组试验,因素水平见表1,试验结果见表2。

表2 响应面试验设计方案及结果
2.2.2 响应面模型的建立及分析
Box-Behnken试验设计及结果如图1所示,利用Design-Expert 12.0进行二次多元回归拟合,得到pH(A)、时间(B)、超声频率(C)和提取温度(D)与响应值提取率(Y)的关系。多元二次回归方程为:Y=29.68+3.43A-0.752 6B+3.03C+1.08D+2.52AB+ 0.540 4AC+1.5AD+1.3BC-1.03BD+1.19CD-3.85A2-1.95B2-4.18C2-4.94D2。
根据表3的方差分析结果可知,该响应面模型差异极显著(p<0.000 1),模型失拟项不显著(p= 0.331 7>0.05),说明试验方法与设计可靠、合理,且其他未知因素对该试验结果影响较小。方程模型的确定系数R2=0.941 5,模型拟合良好,模型成立。由p值可知:一次项A、C,二次项A2、B2、C2和D2和交互项AB对蛋白得率影响极显著(p<0.01);一次项D的p值小于0.05,作用显著;一次项B,交互项AC、AD、BC、BD、CD的p值大于0.05,交互作用不显著。由F值可知各因素对蛋白提取率影响的大小为A>C>D>B,即pH>超声频率>提取温度>提取时间。

表3 回归模型方差分析结果
2.2.3 交互作用对蛋白提取率影响的响应面分析
响应面曲面和等高线共同反映各因素对鸡腿菇蛋白质提取率的影响大小[17]。如图6所示,pH与提取时间的交互作用显著,其中pH的变化对鸡腿菇蛋白质提取率影响最大。结合图6可知,提取温度、提取时间、超声频率两两之间的交互作用相对较小,提取率对超声频率改变的敏感程度大于提取温度,提取率对提取时间改变的敏感程度最低。因此4个因素对鸡腿菇蛋白质提取率影响次序为pH>超声频率>提取温度>提取时间。与方差分析结果一致。

图6 各因素交互对鸡腿菇蛋白提取率影响的响应面图
2.2.4 最佳工艺验证试验
利用Desig-Expert 12.0软件优化回归模型进行的工艺参数,确定提取鸡腿菇蛋白质的最适工艺条件:pH 12.62、提取时间66.27 min、超声频率124.23 W、提取温度42.31 ℃,预测蛋白质提取率为31.49%。为证明响应面优化设计的合理性与可靠性,进行试验验证。考虑到实际操作的可行性,将工艺条件修改为pH 12.6、提取时间66 min、超声频率125 W、提取温度42 ℃。进行3次验证试验,得到的蛋白提取率为32.02%±0.35%。这与模型预测值的相对偏差为1.6%,说明该提取条件参数可靠,具有较好的可行性。
2.3 鸡腿菇蛋白质等电点
如图7所示,pH 3时,上清液的吸光度最低,为曲线的最低点,说明此时上清液中蛋白质含量最低。蛋白质处于等电点时,蛋白质分子所带的正电荷与负电荷恰好相等,相同电荷间作用力抵消,因此极易发生碰撞而产生沉淀,导致蛋白质容易析出。所以pH 3为鸡腿菇蛋白质等电点。

图7 鸡腿菇蛋白质等电点
2.4 鸡腿菇蛋白质冻干粉含量测定
按照1.3.7的方法测定鸡腿菇冻干粉中蛋白质含量,经过测定,蛋白质鸡腿菇冻干粉末中蛋白质含量为84.51%。
3 结论
采用超声辅助碱溶酸沉法提取鸡腿菇蛋白质,并结合响应面优化设计得到鸡腿菇蛋白提取的最佳工艺,确定最佳提取工艺:pH 12.6、提取温度42 ℃、提取时间66 min、超声频率125 W。在此条件下进行3次核对检验试验,鸡腿菇蛋白质提取率为32.02%± 0.35%,这与模型预测值的相对偏差为1.6%,说明该模型对试验拟合程度较高,工艺合理可靠。同时经过试验检测鸡腿菇蛋白质冻干粉含量为84.5%,说明经过该法提取的鸡腿菇蛋白质含量占比较高,进一步纯化成本低。该试验结果可为鸡腿菇提供利用途径。

