超声诱导大豆亲脂蛋白复合姜黄素及其特性研究
朱秀清,衣程远,刘琳琳,曾剑华,王子玥,李美莹,谷雪莲,孙冰玉*
1(哈尔滨商业大学 食品工程学院 黑龙江省普通高校食品科学与工程重点实验室 黑龙江省谷物 食品与综合加工重点实验室,黑龙江 哈尔滨,150076) 2(中国海洋大学 食品科学与工程学院,山东 青岛,266003)
大豆分离蛋白(soybean isolation protein,SPI)不仅包含β-伴球蛋白(7S)和球蛋白(11S),还包含与磷脂等脂类结合的亲脂性蛋白,称为大豆亲脂蛋白(soybean lipophilic protein,SLP)。在大豆分离蛋白中,这3种蛋白质的含量分别为23%、46%和31%[1]。SLP是一种与磷脂等极性脂紧密结合的膜蛋白,是由多种蛋白组成的混合蛋白,既含有少量变性的7S、11S,还含有相对分子质量为17、18、31和34 kDa的油体结合蛋白,油体结合蛋白主要包括3部分结构:两性N-末端区域、中间为反平行β-折叠的疏水区域以及长度不固定的两性C-末端区域。SLP中磷脂主要成分为磷脂酰乙醇胺、磷脂酰肌醇、磷脂酰胆碱、甘油磷脂以及少量的溶血磷脂[1]。相比于SPI、7S及11S,SLP可以明显降低血液中胆固醇的含量,以富含SLP的蛋白组分为食物来源的糖尿病患者,可以有效抑制其糖尿病肾病综合症的发生[2]。
姜黄素(curcumin,Cur)是一种低相对分子质量的天然多酚化合物,存在于姜黄的根茎中。姜黄素主要用作食品着色剂,其具有广泛的药理活性,包括抗炎、抗氧化、抗肿瘤等活性[3]。但是,姜黄素在水溶液中的溶解度极低,生物利用度差,是限制姜黄素作为保健剂应用的主要问题。为了提高姜黄素的生物利用度,人们采用了多种方法,通过包封,生物活性化合物可以免受环境因素的影响,以可控方式溶解和传递。
有研究表明,蛋白质能够作为壁材,用于包埋、传递食品功能因子[4-5]。邓楚君等[6]证明了热变性乳铁蛋白与姜黄素的结合能力较强,热变性能够提高乳铁蛋白对姜黄素的包埋率,为开发基于乳铁蛋白为载体运载疏水性多酚提供了理论依据。PATE等[7]利用玉米醇溶蛋白制备负载姜黄素的纳米颗粒,以提高姜黄素在水中的分散性及生物活性。姜黄素与蛋白质结合可以极大改善姜黄素的稳定性,同时也与蛋白质的类型和性质密切相关。通过荧光光谱法可知,姜黄素与大豆7S 蛋白以及大豆11S 蛋白的结合强度均较弱[8]。TAPAL等[9]的研究表明姜黄素分子通过疏水相互作用在SPI的非极性区域结合,而SLP是一种膜蛋白,即是一种高度疏水及亲油的蛋白[4],能够与生物活性物质形成稳定的复合物。高强度超声波处理是食品工业中新兴的一种技术手段,该技术已经被成功应用于制备纳米级的药物输送载体,目前国内外利用超声技术对大豆亲脂蛋白包埋姜黄素的研究还未见报导。
本研究以SLP为包埋壁材,通过超声诱导促进SLP和姜黄素的结合,以包埋率作为监测指标,考察了超声辅助条件对SLP-Cur复合物包埋效果的影响,并对复合物3级结构、粒径、电位的变化加以分析。通过测定复合物抗氧化性、姜黄素在肠胃中的释放率来评价其功能特性,以期为SLP的开发利用提供理论支撑。
1 材料与方法
1.1 材料与仪器
冷榨大豆粕,黑龙江鹤旭食品有限公司;姜黄素,国药集团化学试剂有限公司;胃蛋白酶,酶活力975 U/mg、胰蛋白酶,酶活力200 U/mg,上海如吉生物科技发展有限公司;正己烷、三羟甲基氨基甲烷(Tris)、甲醇、冰醋酸、β-巯基乙醇、考马斯亮蓝、DPPH、乙醇、浓盐酸、NaOH、PBS、十二烷基硫酸钠溶液(sodium dodecyl sulfate,SDS)均为分析纯。
PHS-3C型pH计,上海仪电科学仪器有限公司;79-1型磁力搅拌器,江苏国华仪器厂;ALPHA 1650型紫外可见分光光度计,上海谱元仪器有限公司;LAMBDA 365型紫外光谱仪,美国Perkin Elmer股份有限公司;721E型电子天平,上海恒平科学仪器有限公司;ALPHA 1-2 LD plus型冷冻干燥机,德国CHRIST公司;KH19A型台式高速高性能离心机,湖南凯达科学仪器有限公司;Scientz-IID型超声波细胞粉碎机,宁波新芝生物科技公司;Nano-ZS-90型电位及粒度分析仪,英国Malvern公司。
1.2 实验方法
1.2.1 SLP的制备
参考曾剑华等[10]的方法,取40 g冷榨大豆粕于200 mL正己烷中,46 ℃摇床4 h,4 000 r/min离心5 min,将沉淀物在55 ℃下干燥。将干燥后的脱脂豆粕用0.5 mol/L pH 8.5的Tris-HCl缓冲液于55 ℃水浴提取60 min,再次以4 000 r/min离心15 min,取上清液,将上清液pH值调至6.4后静置30 min,然后4 000 r/min离心20 min,取上清液调pH值至5.2后静置30 min,将pH值调回5.5,4 000 r/min离心20 min,分离出沉淀即为SLP;将SLP沉淀用适量去离子水溶解后pH调至7,冷冻干燥后备用。
1.2.2 SLP基本成分的测定
蛋白质含量测定参照GB 5009.5—2016《食品中蛋白质的测定》中的凯氏定氮法;灰分的测定参照GB 5009.4—2016《食品中灰分的测定》;水分含量测定参照GB 5009.3—2016《食品中水分的测定》的直接干燥法;脂肪含量测定参照GB 5009.6—2016《食品中脂肪的测定》的索氏抽提法。
1.2.3 聚丙烯酰胺凝胶电泳的测定
将不同超声处理条件的SLP样品配制成质量浓度为2 mg/mL的溶液,取0.5 mL样品溶液加入0.5 mL样品缓冲液(0.2 mL 10% SDS和50 μL 0.01 mol/L的β-巯基乙醇)混匀,沸水浴5 min后上样,上样量为20 μL。采用浓缩胶体积分数5%、分离胶体积分数12%,电压恒定为120 V进行凝胶电泳。取出凝胶后放入考马斯亮蓝染液中染色30 min,再用甲醇、冰醋酸溶液脱色至背景清晰[10]。
1.2.4 姜黄素-乙醇标准曲线的建立
参考冯芳等[8]的方法,用95%(体积分数)乙醇精确配制质量浓度为 5、4、3、2、1 μg/mL的姜黄素标准溶液。取适量溶液进行紫外全波长扫描,确定姜黄素最佳检测波长为426 nm,并测定不同质量浓度姜黄素的吸光值。以姜黄素质量浓度为横坐标,吸光值为纵坐标绘制标准曲线,得到的标准曲线:Y=0.181 4X-0.024 6,R2=0.998。
1.2.5 SLP-Cur复合物的制备及条件优化
1.2.5.1 SLP与姜黄素的质量比对SLP-Cur复合物制备效果的影响
由于SLP的本质是脂质-蛋白质复合物,可将SLP溶于缓冲液(0.01 mol/L,pH 7.4磷酸盐缓冲液)配制成质量浓度为10 mg/mL的SLP溶液,将姜黄素溶于乙醇配制成5 mg/mL的姜黄素溶液,分别将姜黄素溶液稀释成1、2、3、4、5 mg/mL,分别与SLP溶液混合后(体积比为1∶3),SLP与姜黄素的质量比分别为30∶1、15∶1、10∶1、7.5∶1、6∶1,室温下搅拌1 h,避光室温条件下于磁力搅拌器上搅拌2 h,8 000 r/min离心10 min,取沉淀物用无水乙醇充分溶解,在9 000 r/min条件下离心10 min去除蛋白质聚集体,上清液用紫外可见分光光度计在426 nm处测定吸光值,并根据标准曲线计算姜黄素的含量[11]。
1.2.5.2 超声时间对SLP-Cur复合物制备效果的影响
取4 mg/mL的姜黄素溶液加入SLP溶液中(体积比为1∶3),在180 W功率下放入超声粉碎机中分别振荡10、20、30、40、50 min,避光室温条件下于磁力搅拌器上搅拌2 h,8 000 r/min离心10 min,取沉淀物用无水乙醇充分溶解,在9 000 r/min条件下离心10 min去除蛋白质聚集体,上清液用紫外可见分光光度计测定波长426 nm处的吸光值,并根据标准曲线计算姜黄素的含量。将上清液冷冻干燥后得到SLP-Cur复合物粉末,并对不同超声时间下制备的复合物粉末进行三级结构测定,确定最优的超声处理时间。
1.2.5.3 超声功率对SLP-Cur复合物制备效果的影响
选择4 mg/mL姜黄素加入SLP溶液中(体积比为1∶3),分别在120、150、180、210、240 W的功率下进行超声处理20 min。避光室温条件下于磁力搅拌器上搅拌2 h,8 000 r/min 离心10 min,取沉淀物用无水乙醇充分溶解,在9 000 r/min条件下离心10 min去除蛋白质聚集体,上清液用紫外可见分光光度计在426 nm波长处测定吸光值,并根据标准曲线计算姜黄素的含量。将上清液冷冻干燥后得到SLP-Cur复合物粉末,并对不同超声功率下制备的复合物粉末进行三级结构测定,确定最优的超声处理功率。
1.2.6 包埋率的测定
包埋率定义为结合在复合物中的姜黄素所占总蛋白的百分比[4],按公式(1)计算:

(1)
1.2.7 三级结构的测定
参照LIANG等[12]的方法并略作改动。分别将不同条件下制备的SLP-Cur溶液10 mL放入高速离心机中,在9 000 r/min条件下离心15 min。取离心后的上清液作为样品,以PBS缓冲液为空白对照,进行紫外光谱扫描,扫描频率10 nm/s,扫描波长范围260~310 nm。所得的一阶紫外光谱通过Origin 2017软件微分得到二级衍生紫外光谱。
1.2.8 粒径与电位的测定
将10 mL制备好的SLP-Cur溶液放入高速离心机中,在9 000 r/min条件下离心15 min,取离心后的上清液,采用Nano-ZS-90型电位及激光粒度分析仪测定其流体动力学粒径及其分布,用去离子水稀释样品,分散相的折射率为1.471,分散剂折射率为1.330,每个取样检测3次,取平均值。将样品稀释1~500倍,用DTS1060C电位皿测定电位[13]。
1.2.9 抗氧化性测定
DPPH自由基清除能力是衡量物质抗氧化能力的一种有效方法。取2 mL样品溶液与2 mL 6×10-5mol/L的DPPH溶液充分混匀,避光静置30 min,于517 nm处测吸光度A1。同理测定2 mL样品溶液与2 mL无水乙醇充分混匀后的吸光度A2,2 mL蒸馏水与2 mL DPPH溶液充分混匀后的吸光度A0[14-15]。同时以相同条件下直接水提的SLP-Cur溶液作对照,DPPH自由基清除率的计算按照公式(2)进行。
空白调零:2 mL无水乙醇+2 mL蒸馏水
(2)
1.2.10 体外释放率的测定
释放率的测定参考TANG等的方法[16-17],稍作修改。为研究释放曲线,将SLP-Cur复合物样品溶于温度为37 ℃的20 mL PBS(pH 7.4)中,分别加入0.1 mol/mL HCl(pH 1.5)溶液后,在摇床中(37 ℃、100 r/min)混合10 min,加入10 mg胃蛋白酶模拟胃消化60 min,然后用0.4 mol/mL NaOH溶液将反应液的pH调至7.0,加入20 mg胰酶模拟小肠消化60 min。在预定时间点,取出2 mL该溶液,并添加回2 mL新鲜缓冲溶液,以保持相同的总溶液体积。稀释后,在426 nm处用紫外可见分光光度计测定其吸光度At,根据标准曲线及公式(3)确定姜黄素累积释放率。

(3)
式中:At,t时刻样品的吸光度;b,姜黄素标准曲线的截距;a,姜黄素标准曲线的斜率;n,溶液稀释的倍数。
1.3 数据处理
采用Excel 2013和SPSS 22.0对数据进行处理和显著性分析(least significant difference,LSD,P<0.05),通过Origin 2017绘图,实验结果除有特殊说明外,均为3次平均值±标准偏差。
2 结果与分析
2.1 SLP的特征
2.1.1 SLP的基本成分
表1为SLP的主要成分,在SLP中粗蛋白所占的比例为78.36%,灰分所占比例为5.57%,水分所占比例为2.03%,粗脂肪含量为11.89%,这是因为SLP中含有大量磷脂等极性脂,因而脂肪含量较高。

表1 SLP基本成分 单位:%
2.1.2 SLP的相对分子质量
图1为SLP的凝胶电泳图,SLP中既含有7S、11S球蛋白,还含有相对分子质量为17、18、31及34 kDa 的油体结合蛋白。由图谱可以看出,超声处理并不会改变SLP的亚基种类,即超声处理并不会改变SLP的一级结构,而是有效保留了SLP的亚基结构。
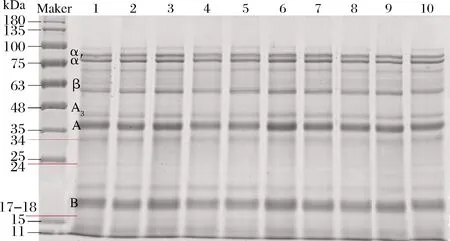
1-未经处理的SLP;2~6-180 W功率下分别超声处理10、20、30、 40、50 min的SLP;7~10-超声处理20 min条件下,分别在 120、150、210、240 W功率下超声处理的SLP图1 不同超声条件下SLP凝胶电泳图谱Fig.1 SDS-PAGE patterns of SLP under different ultrasonic treatments
2.2 姜黄素标准曲线的建立
如图2所示,姜黄素在无水乙醇中的标准曲线为Y=0.181 4X-0.024 6,线性相关系数为R2=0.998,线性关系较好。

图2 姜黄素在无水乙醇中的标准曲线Fig.2 Standard curve of curcumin in absolute ethanol solution
2.3 制备条件对SLP-Cur复合物制备效果的影响
2.3.1 SLP与姜黄素的质量比对SLP-Cur复合物制备效果的影响
如图3所示,用质量浓度10 mg/mL的SLP溶液分别与质量浓度1、2、3、4、5 mg/mL的姜黄素乙醇溶液以3∶1的体积比制备复合物溶液,SLP与姜黄素的质量比依次为30∶1、15∶1、10∶1、7.5∶1、6∶1。随着姜黄素浓度的不断增加,包埋率逐渐增加,当SLP与姜黄素的质量比为7.5∶1时,包埋率达到最大值,之后随着姜黄素浓度的增加,包埋率有下降的趋势。原因可能是随着姜黄素含量增多,需要更多蛋白质来运载姜黄素,当SLP与姜黄素质量比为7.5∶1时,蛋白质所能承载的姜黄素达到饱和。因此,本实验选取SLP与姜黄素的质量比7.5∶1时为最优水平。

图3 SLP与姜黄素的质量比对SLP-Cur包埋率的影响Fig.3 Effect of the mass ratio of SLP to curcumin on the encapsulation efficiency of SLP-Cur注:不同字母代表差异显著,P<0.05(下同)
2.3.2 超声时间对SLP-Cur复合物制备效果的影响
由图4可知,随着超声时间的增加,包埋率呈现先升高后降低的趋势,在超声20 min时包埋率达到最高值,原因可能是超声波会破坏蛋白质的非共价键,从而使蛋白质分子在一定程度上展开,暴露出更多的疏水区域,有利于与姜黄素结合。超声处理20 min后,大豆亲脂蛋白对姜黄素的包埋率开始下降,SUI等[18]指出在300 W条件下超声12 min后如果持续延长超声时间,则过量的能量会导致大豆蛋白分子内的疏水区域过多暴露在外界的水环境中,形成不溶性聚集体,使溶解性降低,而本实验是在超声功率为180 W进行,因此形成不溶性聚集体的时间会有所延长,降低了包埋率。

图4 超声时间对SLP-Cur包埋率的影响Fig.4 Effect of ultrasonic time treatments on the encapsulation efficiency of SLP-Cur
图5为不同超声时间诱导下SLP-Cur复合物溶液紫外吸收光谱图、粒径及电位变化图。由于大豆蛋白侧链含有不同的色氨酸、酪氨酸和苯丙氨酸残基,会产生不同的紫外吸收峰,分析氨基酸残基的相对移动可以反映出蛋白质三级构象的变化[19]。色氨酸和酪氨酸均在280 nm处出现特征吸收峰,由于谱峰的信号叠加很难分辨出峰的具体特征,因此对紫外吸收光谱进行求导得到其二阶导数光谱,用于分析近紫外区域复杂的蛋白谱图迁移信息[20]。由图5-a可知,SLP-Cur复合物溶液紫外光谱的二阶导数值随着超声时间的增加而增大,超声处理20 min时达到最大值,并且红移程度最大;继续延长超声诱导时间,复合物的紫外吸收逐渐降低。未超声时大豆亲脂蛋白中的疏水基团埋藏在蛋白分子的内部,超声波的空穴效应和微束流效应促进了疏水基团的暴露[21],更有利于姜黄素结合在蛋白质的疏水区域,使大豆亲脂蛋白对姜黄素的包埋率达到最高;之后过度的能量又会使蛋白质分子重新形成不溶性聚集体,疏水基团被包埋,此时,大豆亲脂蛋白与姜黄素结合的疏水位点减少,使包埋率降低。
由图5-b可知,复合物溶液粒径总体呈单峰分布,粒径集中分布在106~190 nm,说明复合物溶液比较稳定。SLP-Cur复合物经过超声处理,在前30 min内,复合物粒径逐渐变小,且超声20 min时与超声30 min时复合物的粒径变化不大。CHANDRAPALA等[22]观察到超声处理后溶液的平均粒径降低,这是由于超声波的空穴效应产生了机械剪切力等物理作用使蛋白颗粒被粉碎,从而使蛋白质表面分子发生解离,粒径降低。在超声处理40、50 min时,复合物的粒径有变大的趋势,且峰值变宽,可能是过度的能量使蛋白形成不溶性聚集体导致粒径增大,不利于与姜黄素结合,与包埋率、三级结构结果相吻合。
由图5-c可知,超声时间为20 min时复合物Zeta电位绝对值最高,粒子间的静电斥力最大,体系趋于稳定[23];随着超声时间的进一步延长,复合物的Zeta电位绝对值逐渐减小,说明此时体系内分子表面静电荷密度减小,静电相互作用减弱。原因可能是超声作用使得SLP疏水基团暴露的同时带有羧基的氨基酸暴露出来,电位绝对值增大[24]。在前20 min静电斥力占主导作用使得蛋白分子分散,之后随着疏水基团的不断暴露,疏水作用占据主导,包埋了带有负电荷的氨基酸并形成新的更大体积的聚集体。综上,选择超声时间20 min为最优水平。

a-二阶导数光谱;b-粒径;c-电位图5 不同超声时间对SLP-Cur的二阶导数光谱、粒径、电位的影响Fig.5 Second derivative absorbance,particle size distribution and Zeta potential of SLP-Cur under different ultrasonic time
2.3.3 超声功率对SLP-Cur复合物制备效果的影响
由图6可知,随着超声功率的增加,包埋率在功率为210 W时达到最大值,之后随着超声功率增加而下降。根据李杨等[25]研究,适当的超声处理会使SLP的溶解性及疏水作用有所提高,而继续增加超声功率及超声时间,则会对SLP的性能产生一定的负面影响,原因可能是能量过多使蛋白质过度解折叠,大量疏水残基暴露于表面,相互作用的机会增加,重新形成了不溶性聚集体,导致复合物包埋效率下降。

图6 超声功率对SLP-Cur包埋率的影响Fig.6 Effect of ultrasonic power treatments on the encapsulation efficiency of SLP-Cur
图7为不同超声功率时SLP-Cur复合物溶液紫外吸收光谱图、粒径及电位变化图。由图7-a可知,SLP-Cur复合物溶液紫外光谱的二阶导数值随着超声功率的提高呈现先升高后降低的趋势。在超声功率为180 W达到最大值0.001 6,这是因为超声功率的增大促使色氨酸、酪氨酸等氨基酸残基暴露,紫外吸收增大,表征色氨酸和酪氨酸残基侧链基团的275 nm波长处的吸收峰发生了明显的红移,向280 nm处移动,表征酪氨酸残基侧链基团的296 nm波长处的吸收峰发生了一定程度的红移,并伴随着紫外吸收强度的增强,蛋白质的构象发生了改变,氨基酸残基向疏水强的环境移动[20]。紫外吸收强度增高,表明SLP的三级结构发生一定程度的展开,芳香族氨基酸残基暴露于蛋白质表面。蛋白质的三级结构发生改变,可能是SLP与姜黄素的相互作用改变了蛋白质微环境,姜黄素从极性环境向弱极性环境迁移。超声功率180 W时,复合物的紫外光谱红移程度最大,峰值最高,此时最有利于SLP与姜黄素结合,容易得到包埋率最优效果。但是继续增大超声功率后,紫外吸收逐渐降低,这是因为过度的能量使蛋白质分子发生物理聚集,让原本展开的蛋白结构重新聚合,氨基酸残基被重新包埋,因而紫外吸收降低,而在蛋白分子聚集的过程中,部分姜黄素与蛋白发生物理吸附使包埋率在210 W时有所提高。
由图7-b可知,复合物粒径总体呈单峰分布,说明体系较为稳定。在超声功率增加到180 W之前,复合物粒径逐渐变小,继续增加超声功率后复合物粒径开始变大。可能是因为在较高功率条件下处理的蛋白发生相互作用增加了分子间的碰撞与聚集,从而表现出粒径轻微的增加,这与DESRUMAUX等[26]提出的“过度加工”概念相符,乳液粒径在中等功率时达到小尺寸,在高功率下粒径又会增大。结合包埋率发现,在180 W功率下,蛋白分子的解离与聚合同时进行,且聚合处于主导地位,因而在210 W条件下通过分子的聚集吸附了部分姜黄素分子,虽然包埋率有所提高,但并不稳定。
由图7-c可知,与超声120 W相比,超声150、180 W时溶液的Zeta电位绝对值有所提高,这是因为SLP的带电基团在超声波的作用下暴露于分子表面,Zeta电位绝对值增大。之后增加超声功率对溶液电位绝对值影响并不明显,电位绝对平均值在(24.7±0.23)mV左右。超声使蛋白质分子链展开的同时,部分蛋白质分子在超声波产生的空泡内爆、微射流和湍流作用下发生聚集,使带电荷氨基酸掩埋于分子内部[23],因此电位绝对平均值变化并不明显。但与150 W功率下复合物溶液的粒径相比,在180 W功率下复合物溶液粒径最小,体系更加稳定。综上,本实验选择180 W为最优水平。

a-二阶导数光谱;b-粒径;c-电位图7 不同超声功率对SLP-Cur的二阶导数光谱、粒径、电位的影响Fig.7 Second derivative absorbance,particle size distribution and Zeta potential of SLP-Cur under different ultrasonic power
2.4 SLP-Cur复合物的抗氧化能力
DPPH自由基清除能力是衡量物质抗氧化性的一种有效方法[27]。与未超声处理的复合物相比,超声处理提高了复合物的DPPH自由基清除能力(图8)。未超声复合物与超声后复合物的包埋率分别为(16.13±0.66)%、(19.63±0.06)%,DPPH自由基清除率分别为(52.6±0.64)%、(59.3±0.66)%,说明超声提高了复合物的DPPH自由基清除能力,原因可能是超声促进了蛋白质结构的打开,氨基酸基团与自由基更易接触。经过模拟体外胃消化与肠消化后,胃蛋白酶消化物跟胰蛋白酶消化物的DPPH自由基清除能力降低,原因是与姜黄素结合的SLP肽链逐渐水解,释放出姜黄素。由于姜黄素本身的DPPH自由基清除率低于消化物的DPPH自由基清除率,可以肯定消化物的DPPH自由基清除能力来自SLP。并且超声后不同阶段的消化产物DPPH自由基清除率有所下降,说明超声在不影响蛋白质可消化性的前提下提高了复合物的抗氧化性。

图8 SLP-Cur的DPPH自由基清除能力Fig.8 DPPH free radical clearance of SLP-Cur注:不同字母表示差异显著,P<0.05,不同数字代表不同组别(下同)
2.5 SLP-Cur复合物的体外释放率
在消化过程中,pH和离子强度、蛋白酶酶解、其他表面活性剂等因素可能会导致SLP-Cur复合物发生巨大的变化。而SLP作为一种蛋白质,极容易被消化液中的胃蛋白酶、胰蛋白酶等酶解,因而可能会影响其对姜黄素的输送特性以及在消化液中的稳定性。本实验采用胃蛋白酶和胰蛋白酶模拟体外消化,研究了经过超声诱导与未超声复合物在模拟胃液中的姜黄素的释放率。如图9可知,经过超声处理与未经超声处理的SLP-Cur复合物在消化0.5 h时姜黄素释放量分别达到(43±2.8)%、(62±3.5)%,说明SLP在模拟胃消化条件下被迅速降解,释放出姜黄素,这与本研究中测定的复合物DPPH自由基清除率结果相符。SLP对姜黄素具有一定的保护作用,但在0.5~1 h的消化阶段,姜黄素被迅速释放出来,这时SLP被降解使姜黄素的释放速度加快。在整个胃消化阶段,超声处理后的复合物相比于未超声处理复合物姜黄素释放率减少4%,这可能是由于超声处理促进二者结合的缘故。

图9 消化时间对姜黄素释放率的影响Fig.9 Curcumin release rate changes during digestion
3 结论
本文采用超声技术,探究制备SLP-Cur复合物的最佳条件以及超声对复合物功能性质的影响,结果表明,在SLP与姜黄素的质量比为7.5∶1、超声时间20 min、超声功率180 W条件下,大豆亲脂蛋白对姜黄素的包埋效果最好,包埋率高达(19.63±0.06)%。SLP-Cur复合物电位绝对值较大,复合物体系较为稳定。紫外光谱、激光粒径扫描结果表明,超声处理使SLP中氨基酸残基向疏水强的环境移动,芳香族氨基酸残基暴露于蛋白质表面,增强了SLP的疏水性,有利于与姜黄素的结合,有效提高了SLP对姜黄素的包埋率。此外,通过抗氧化活性的测定及体外消化模拟实验,结果表明,超声诱导可以有效提高复合物的抗氧化能力,更好地保护姜黄素,减少了姜黄素在胃中的释放率。综上所述,超声诱导对于大豆亲脂蛋白与姜黄素的复合产生了积极影响,有望为大豆亲脂蛋白与多酚类生物活性物质相互作用的研究提供参考依据。

