LDHs及其复合材料处理重金属废水的研究进展
罗相萍,游少鸿, 2,刘崇敏, 2,黄永香,何慧军, 2
(1.桂林理工大学环境科学与工程学院,广西桂林 541006; 2.广西环境污染控制理论与技术重点实验室,广西桂林 541006)
重金属废水主要指矿山开采、机械制造、化学工业、印染、电子、医疗等生产过程中产生的含重金属的废水。重金属在自然界中很难被降解,并且会随着人类活动和食物链进入人体和动物体内〔1〕,对其健康造成危害〔2〕。目前,重金属废水的处理方法主要有化学沉淀法〔3〕、离子交换法〔4〕、吸附法〔5〕、生物法〔6〕等,其中吸附法因成本低、操作简单、效率高等优点被广泛应用于重金属废水的处理〔7-8〕。常见的吸附剂有活性炭、硅胶材料、黏土矿物等无机吸附材料和纤维素基、壳聚糖基、木质素基、淀粉基等天然高分子吸附材料,还包括细菌、藻类在内的生物吸附材料。此外,飞灰、炉渣等工业废弃物也可作为吸附材料应用于重金属废水的处理〔9〕。相比之下,层状双氢氧化物(Layered double hydroxides,LDHs)具有化学组分多变、易结晶和合成、结构正电荷密度大、对各种化学组分具有包容性等特点,且具有较大的比表面积和较高的阴离子交换容量,是理想的污染物储存载体和阴离子交换吸附材料〔10〕,可作为吸附剂去除废水中重金属离子。
笔者首先综述了LDHs的组成、性质及其复合材料的制备方法;其次,对LDHs及其复合材料在重金属废水中的研究应用进行了介绍,在此基础上分别总结了LDHs及其复合材料在吸附废水中重金属阳离子、重金属阴离子及共存重金属阴阳离子过程中存在的作用机理;最后,对LDHs及其复合材料在处理重金属废水领域的应用前景进行了分析与展望。
1 LDHs及其复合材料概述
1.1 LDHs的组成
层状双氢氧化物(LDHs),又称水滑石、类水滑石或阴离子黏土,是一种具有层状结构的阴离子多金属化合物。结构与层状水镁石类似,通式可表示为分别代表二价(Ca2+、Mg2+、Zn2+、Mn2+和Ni2+等)以及三价(Al3+、Fe3+和Cr3+等)金属阳离子,An-表示可交换的层间阴离 子(如Cl-、NO3-、CO32-等),x的范围为0.17~0.33〔11〕,m为层间结晶水数,其值可由m= 1-Nx/n计算得到,N为阴离子占据的位置数目,n为阴离子的电荷数。空间结构〔10〕如图 1所示。
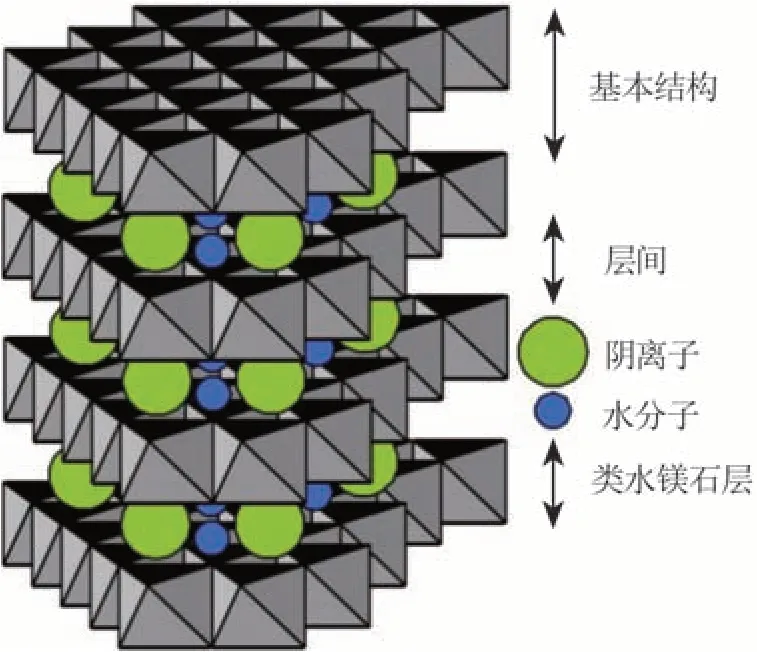
图 1 LDHs的空间结构Fig.1 Hierarchical structure of LDHs
1.2 LDHs的性质
LDHs的结构特征使其具有特殊的物理化学特性:(1)酸碱性。酸性与金属氢氧化物及层间阴离子种类有关〔12〕,碱性与阳离子种类及M—O键的性质有关,LDHs可作为碱催化剂,同时又是酸吸附剂〔13〕。(2)层间阴离子可交换性。LDHs具有客体阴离子可插层性,主体层板与层间客体阴离子间存在静电、氢键等分子间作用力,很多功能性阴离子可通过分子间作用力被引入LDHs层间,形成一类新型LDHs基复合材料〔14〕。(3)热稳定性〔15〕。金属离子与羟基通过配位键形成的层板有序结构使LDHs具有一定的稳定性。加热过程中,LDHs依次脱去层间水、阴离子和层板羟基。一般情况下,当温度升至500℃以上时,LDHs才转变为具备尖晶石结构的双金属氧化物(Layered double oxides,LDOs)。(4)记忆效应。LDHs煅烧温度在500℃以内时,LDOs在溶液中可能恢复为LDHs。(5)晶体尺寸、分布的可调控性。通过在LDHs合成过程中改变晶化温度、时间和晶体成核速率可控制晶体生长速度〔16〕。(6)阻燃性。LDHs以脱除层间水分子及阴离子、羟基的形式吸热隔氧〔17〕,达到阻燃的目的。
1.3 LDHs及其复合材料的制备方法
目前,LDHs的制备研究已经很成熟,可根据需求用不同路线合成各种LDHs,常用的合成法包括:(1)共沉淀法。即在一定条件下,通过金属离子混合溶液与碱溶液发生共沉淀反应制得LDHs。刘奕祯等〔18〕利用MgCl2·6H2O和AlCl3·9H2O配制的金属混合溶液与NaOH和Na2CO3配制的混合碱液,在pH为9.0、温度为70℃时反应,经过离心、洗涤、干燥、研磨后得Mg/Al-LDH,再经煅烧后得Mg/Al-LDO用于吸附Cr(Ⅵ)。(2)水热合成法〔19〕。该方法通常在高压反应釜中进行,采用尿素、六次亚甲基四胺等作为碱源,得到的LDHs结构非常规整且尺寸较大〔20〕。曾晨等〔21〕采用尿素-水热法合成了晶相单一、结构完整的片层状NiCr-LDHs,并总结了不同制备条件对LDHs结构和形貌的影响。
单一LDHs因官能团较少、耐酸碱性较差、重复使用率低且易聚集等缺点,难以推广到环境修复领域的实际应用中〔22〕。为增加LDHs材料的层间距离、比表面积和表面官能团,继而增加其与重金属离子的作用位点,提升吸附性能,研究人员常采用煅烧〔23〕、插层〔24〕、表面修饰〔25〕和合成复合材料〔26〕等方法对LDHs进行表面改性。
LDHs复合材料的制备方法主要有:(1)插层法。崔哲〔27〕用溶液插层的方法合成聚丙烯(PP)/MgAl LDH纳米复合材料,结果表明LDH片层含量会改变PP的成核机理,当LDH片层质量分数超过5%,成核方式由均相成核变为异相成核。(2)重构法。黄火秀〔28〕通过重构法合成了镁铝层状双金属氢氧化物/N,O-羧甲基壳聚糖(Mg-Al-LDH/CMCS)纳米复合物,当温度高于最大分解温度(280℃)时,Mg-Al-LDH/CMCS纳米复合物的热稳定性显著提高,与纯CMCS相比,硬度和模量分别增加41%和30%。(3)层离/自装配法。通过层层组装〔29〕的方法,以Zn-Cr-NO3-LDH、Zn-Al-NO3-LDH、Zn-Ti-NO3-LDH为前驱体,合成基于剥离的锌铬、锌铝、锌钛LDH单层和典型的Dawson型多金属氧酸盐阴离子(P2W18)静电作用的新型超薄膜(UTFs),即Zn-Cr-P2W18UTFs、Zn-Al-P2W18UTFs和Zn-Ti-P2W18UTFs。结果表明,材料性能的提高是由于多金属氧酸盐阴离子和LDH单层(剥离)的强化学键作用,层板和层间存在协同作用。(4)原位聚合法。V.N.PRIYA等〔30〕采用简单的水热原位聚合法,制备壳聚糖辅助Fe-Al双层氢氧化物/还原氧化石墨烯复合材料(FAH-rGO/CS)用于去除废水中As(Ⅴ),Fe-Al双层氢氧化物和壳聚糖通过基体表面与复合材料的相互作用激发了氧化石墨烯的吸附能力,使As(Ⅴ)去除率高达97%。(5)原位生成法。张启彦等〔31〕通过水热合成原位生长法制备出二氧化钛-氧化石墨烯/镁铝层状双金属氢氧化物(TiO2-GO/LDHs)复合材料,GO的加入使TiO2颗粒分散更均匀,不易团聚,从而能更好地去除污染物。
2 LDHs及其复合材料处理重金属废水的应用及机理研究
2.1 LDHs及其复合材料处理重金属废水的应用
相比于传统吸附剂,LDHs及其复合材料因其特殊的二维层状结构,具有较大的比表面积和较高的阴离子交换容量,对重金属离子具有很好的吸附性能,且可通过改性使其具有磁性或通过原位生长法使其生长在生物质炭等材料上,从而实现吸附剂与废水的固液分离〔32〕,避免二次污染。此外,大多数LDHs材料吸附重金属后可通过解吸实现材料的再生,是一类新型环保吸附剂。
LDHs及其复合材料对废水中重金属离子的去除效果明显,部分重金属在LDHs基材料上的吸附行为见表 1。改性LDHs材料可实现对重金属离子的特异性和高效去除〔33〕,可能是因为改性后LDHs具有更强的稳定性、更多的表面活性位点和官能基团。
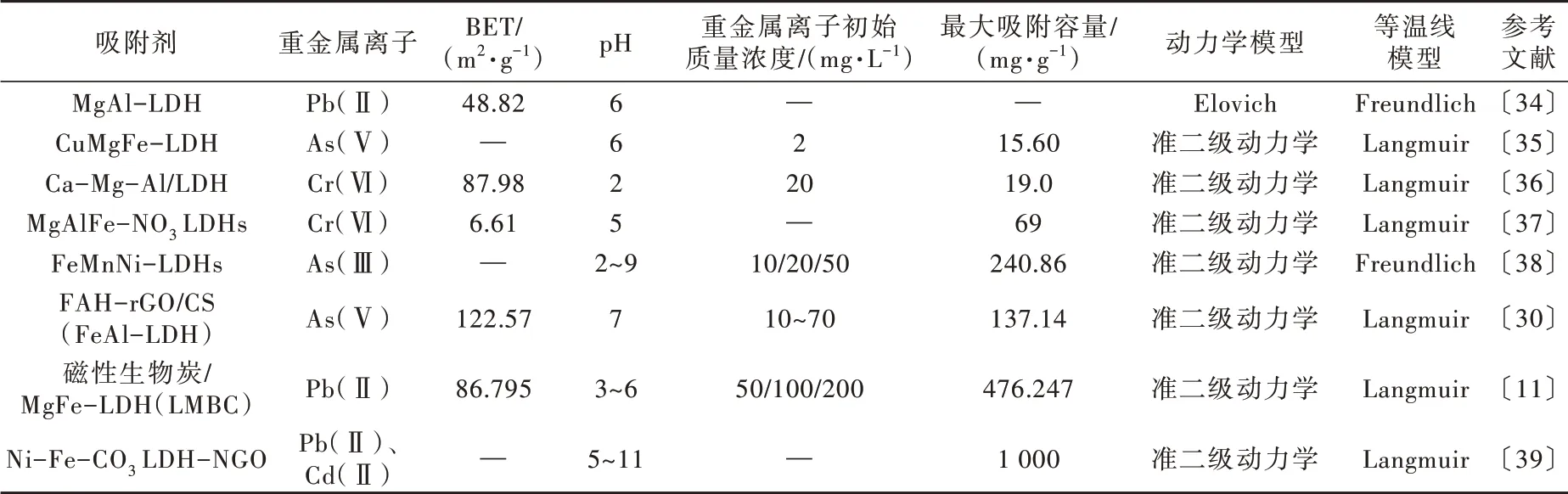
表 1 重金属在LDHs基材料上的吸附Table 1 The adsorption of heavy metals on LDH-based materials
2.1.1 LDHs及其复合材料吸附重金属阳离子
张树芹〔34〕制备了MgAl-LDH,其对Pb2+有很强的吸附作用,XPS结果表明,MgAl-LDH对Pb2+的吸附属于非特定吸附。M.SHAFIQ等〔40〕采用共沉淀法制备了镍-锌-铁层状双氢氧化物(NiZnFe-LDH)及其与单壁碳纳米管(CNTs)、香蕉生物炭(Bb)的复合材料(LDH/CNT、LDH/Bb),并研究了3种材料对Cu2+的吸附性能。实验表明,当最佳接触时间为30 min,初始Cu2+质量浓度为 20 mg/L时,LDH/Bb对Cu2+的去除效率最高(95%)。在最佳pH为5.0时,3种材料对Cu2+的去除率都有所提升,其中LDH/Bb比NiZnFe-LDH和LDH/CNT具有更高的Cu2+去除效率。SIP等温模型表明LDH/Bb比其他 2种吸附剂表现出更高的吸附能量和非均质性。因此,生物炭复合NiZnFe-LDH可以作为去除废水中Cu2+的有效吸附剂。Meiqing CHEN等〔41〕采用MgMn-LDH煅烧制备MgMn-LDO,并对比了改性前后材料对Cd2+的吸附性能。在单一体系中,当吸附剂投加量为0.1 g/L,p H为5.0,Cd2+初始浓度为0.05 mmol/L时,Cd2+在MgMn-LDO上的吸附平衡时间远少于MgMn-LDH,且MgMn-LDO对Cd2+的最大吸附量为8.234 mmol/g,高于MgMn-LDH,这归因于MgMn-LDO活性位点增多。此外,MgMn-LDO可重复使用5个循环而无任何显著的效率损失。因此,煅烧后的MgMn-LDO是一种很好的Cd固定化可回收材料。
2.1.2 LDHs及其复合材料吸附重金属含氧阴离子
A.JAISWAL等〔42〕通过尿素水解法合成Co/Bi-LDH,研究其对Cr(Ⅵ)的吸附行为。在最佳条件(吸附剂剂量为0.1 g,接触时间为 120 min,p H为7,温度为 283 K)下,Co/Bi-LDH对Cr(Ⅵ)的最大吸附容量为 277.7 mg/g。热力学研究显示,Cr(Ⅵ)吸附是自然发生的,并且是放热的。0.1 mol/L的NaHCO3能轻松再生Co/Bi-LDH。Co/Bi-LDH是一种可有效用于从液相中去除重金属物质的可再生新材料。Huabin WANG等〔43〕通过制备层状双氢氧化物功能化生物炭MgAl-LDH/BC去除电镀废水中CrO42–,CrO42–通过官能团还原成Cr3+,Cr3+通过取代Al3+形成MgCr-LDH结构得以去除。MgAl-LDH/BC对CrO42–的吸附量为330.8 mg/g,比BC高416%。该功能化MgAl-LDH纳米片制备的生物炭实现了高效去除重金属离子的目的,为工业废水净化提供了可行性。
2.1.3 LDHs及其复合材料吸附类金属离子
王宁宁〔44〕通过“盐-(羟)氧化物法”合成的CaAl-LDH可将矿坑废水中锑离子由 1360μg/L降至32μg/L;CaAl-LDH与聚合氯化铝铁絮凝剂组合可将总锑降至 24.4μg/L,且出水p H在8.5~9.0之间,处理后废水中剩余锑离子远低于《锡、锑、汞工业污染物排放标准》(GB 30770— 2014)的限值(0.3 mg/L),该法找到一种性能优良的能使矿坑废水中锑达标排放的潜在絮凝-吸附剂。梁杜鹃等〔45〕制备了硝酸根型层状双金属氢氧化物(MgAl-NO3-LDH),MgAl-NO3-LDH通过离子交换作用达到去除微量目标离子As(Ⅲ)、As(Ⅴ)的目的。使用酸盐法对吸附后材料脱附再生后,MgAl-NO3-LDH对As(Ⅲ)、As(Ⅴ)仍有较好的吸附效果。Xiaofeng SHI等〔46〕采用两性离子甘氨酸对Fe/Mg-LDH进行改性,制备了一种对As(Ⅴ)、P(Ⅴ)、Cr(Ⅵ)等含氧阴离子具有高吸附能力的G-Fe/Mg-LDH吸附剂。实验表明,当Fe、Mg物质的量比为0.02 mol/0.02 mol时,G-Fe/Mg-LDH具有良好的吸附性能。G-Fe/Mg-LDH对含氧阴离子的最佳吸附pH为6,且As(Ⅴ)的最大吸附量高达830 mg/g,优于以往报道的大多数高效吸附剂。
2.1.4 LDHs及其复合材料的再生性
Hui ZHANG等〔47〕通过化学自组装法制备了具有良好吸附性能,且易分离、环保、可重复使用的Fe3O4@C@MgAl-LDH新型磁性复合材料。在40℃和pH为6.0条件下,Cr(Ⅵ)的最大吸附量为 152.0mg/g,且循环6次后吸附量仍达 120.0 mg/g。施周等〔48〕合成了磁性NiFe2O4/ZnAl-LDH材料,在NiFe2O4/ZnAl-LDH投加量为4 g/L、p H为 2、Cr(Ⅵ)质量浓度为50 mg/L条件下,Cr(Ⅵ)去除率达89.5%,且在外加磁场作用下能实现与水溶液的快速分离,0.1 mol/L的Na2CO3可使NiFe2O4/ZnAl-LDH轻松再生(经4次再生后去除率仍达83.1%)。因此NiFe2O4/ZnAl-LDH可作为去除水中Cr(Ⅵ)的良好吸附剂。A.BARUAH等〔39〕合成了镍-铁层状双氢氧化物/氮掺杂氧化石墨烯纳米复合材料(NiFe-CO3-LDH-NGO),该纳米复合材料对水中Pb2+表现出非常高的吸附效率,最大吸附量为986 mg/g,吸附金属离子后的吸附剂用稀盐酸溶液提取再生,3个吸附周期后,纳米复合材料保留了超过70%的原始效率,是一种可再生的吸附剂。NiFe-CO3-LDH-NGO复合材料在处理重金属污染废水方面具有很大的应用潜力。
2.2 LDHs及其复合材料处理重金属废水的机理研究
2.2.1 重金属阳离子的去除机理
Xuewen LUO等〔49〕提出了一种结合污泥水热碳化和LDHs原位制备的工艺,得到水热碳/LDHs(HL)复合材料。与碳结合后,结晶良好的LDHs切片更薄,可用作去除水中Pb2+的高效吸附剂。吸附实验结果表明,Pb2+在HL复合材料上的吸附行为可通过拟二级动力学模型和Langmuir等温线很好地表达,最大吸附容量为62.441 mg/g。X射线光电子能谱(XPS)和傅里叶变换红外光谱(FTIR)表明,HL复合材料对Pb2+的吸附机理主要包括静电作用和表面共沉淀。谢沅沅〔50〕制备的磁性碳/镁铁水滑石纳米复合材料对Pb2+的最大吸附量可达到758.35 mg/g,对该复合材料的吸附机理进行分析后发现,它对Pb2+的吸附包括表面络合作用、沉淀作用、同晶替代、静电吸引和物理吸附综合作用。魏英民〔51〕用体积分数为 15%的甘油液改性镁铝LDH得到纯度较高、表面积大、分散度好的G-LDH,研究了其对水中Cd(Ⅱ)的吸附效果。改性后的G-LDH对Cd(Ⅱ)的饱和吸附量高达875.0 mg/g,较未改性的LDH,Cd(Ⅱ)去除率提高了 17.0%。经过煅烧后的G-LDO具有更大的比表面积和更丰富的孔隙结构,因此更易发生吸附并能更好地发挥“记忆效应”,促进Cd(Ⅱ)的化学沉淀,G-LDO对Cd(Ⅱ)的吸附效果更好。G-LDO是通过表面物理吸附、表面络合、化学沉淀,特别是重构引导促进吸附来去除Cd(Ⅱ)的。黄祺祺〔52〕采用溶剂热法合成了磁性氧化石墨烯/水滑石纳米复合材料(MGL),比表面积高达78.07 m2/g,Cu2+、Pb2+、Cd2+在该材料上的最大吸附量分别为 23.04、 192.3、45.05 mg/g。3种离子在该复合材料上吸附机理主要是:(1)与MGL复合材料表面含氧官能团的络合;(2)在MGL复合材料表面形成重金属氢氧化物或碳氧化物沉淀;(3)Cu2+、Pb2+、Cd2+对Mg2+的同构置换。
LDHs及其复合材料对重金属阳离子的去除机制主要如下:(1)重金属阳离子与材料表面羟基、金属-氧(M—O)等含氧官能团发生络合作用,将重金属阳离子固定在材料表面;(2)重金属阳离子与LDHs层间释放出的CO32-、OH-等阴离子发生反应,以碳酸盐或氢氧化物沉淀的形式得以去除;(3)在吸附过程中,重金属阳离子与LDHs中同价态金属阳离子发生同晶取代,将污染物金属阳离子固定在材料中形成新的LDHs;(4)带负电的材料与重金属阳离子之间存在静电引力,有利于吸附反应的进行。
2.2.2 重金属含氧阴离子的去除机理
王敦球等〔53〕制备了蔗渣炭/镁铝双金属氧化物(LDO),并研究了其对As(Ⅴ)的吸附性能。实验表明,吸附As(Ⅴ)后,LDH层间出现AsO43-,其反应机理主要是AsO43-通过LDO“记忆效应”嵌入层间。Yanwei GUO等〔35〕合成了含碳酸盐插层的介孔Cu/Mg/Fe-LDH,研究其对砷酸盐的吸附性能。结果表明,砷酸盐在Cu/Mg/Fe-LDH上的吸附行为可以通过Langmuir等温线和准二级动力学模型很好地表达,共存离子(如HPO42-、CO32-、SO42-和NO3-)可与砷酸盐竞争Cu/Mg/Fe-LDH的吸附位点。该吸附剂可使砷酸盐质量浓度低于 10μg/L,砷酸盐在吸附剂上的吸附主要归因于离子交换过程。J.MATUSIK等〔54〕合成了埃洛石-MgAl-LDH,研究其对水中As(Ⅴ)和Cr(Ⅵ)的去除效率和机理。实验表明,在较宽的p H(3~7)范围内,溶液中As(Ⅴ)和Cr(Ⅵ)均表现出较高的去除率。材料中埃洛石的存在对As(Ⅴ)的去除起到积极作用,As(Ⅴ)通过阴离子交换和化学吸附去除。XPS结果表明在pH为7时,Cr(Ⅵ)被部分还原为Cr(Ⅲ),低p H下除阴离子交换机制外,Cr(Ⅵ)还通过与LDH中释放出来的Mg2+形成MgCrO4而被去除。
LDHs及其复合材料对阴离子的去除机制主要如下:(1)LDHs层间有大量可交换的阴离子,在反应过程中LDHs层间CO32-等阴离子可与污染物阴离子发生交换,使得污染物阴离子进入LDHs层间得以吸附锁定;(2)LDHs表面及进入层间的污染物阴离子通过与LDHs表面及层板羟基、金属-氧(M—O)等含氧基团发生作用形成络合物得以去除;(3)LDOs具有重构“记忆效应”,在重构过程中污染物阴离子可进入LDHs层间得以固定;(4)在吸附过程中,污染物阴离子还可通过与LDHs中具有氧化或还原性的金属阳离子发生氧化还原反应,转化为更易去除的其他价态阴离子得以去除。
2.2.3 共存阴、阳重金属离子的去除机理
Xianyang YUE等〔55〕通过共沉淀法制备了Mg-Al-Cl层状双氢氧化物(Cl-LDH),用于同时去除水溶液中的Cu(Ⅱ)和Cr(Ⅵ)。与单一体系Cu(Ⅱ)或Cr(Ⅵ)相比,当Cl-LDH投加量为 2.0 g/L时,Cl-LDH在30 min内就能将共存的Cu(Ⅱ)(20 mg/L)和Cr(Ⅵ)(40 mg/L)完全去除,Cl-LDH对Cu(Ⅱ)和Cr(Ⅵ)的吸附量分别提高81.05%和49.56%。吸附过程包括Cr(Ⅵ)与Cl-在Cl-LDH夹层中的阴离子交换、Mg2+与Cu2+同 构 取 代、Cu2Cl(OH)3沉 淀 的 形 成 及Cu2Cl(OH)3对Cr(Ⅵ)的吸附。Junqin LIU等〔56〕通过煅烧制备MgZnFe-CO3层状双氢氧化物(CMZF),在低质量浓度(1000μg/L)及光照条件下,研究了As(Ⅲ)和Cd(Ⅱ)在水/CMZF界面上的去除机理和相互作用。实验表明,光氧化作用和吸附耦合过程是去除As(Ⅲ)的重要原因,Cd(Ⅱ)的去除归因于沉淀作用和吸附耦合过程。在光氧化过程中,As(Ⅲ)首先被吸附到CMZF表面,被空穴(h+)或ROS(1O2,)夺走 2个电子,从而被氧化成毒性较小的As(Ⅴ),根据固-液界面上的浓度差,氧化后的As(Ⅴ)会停留在CMZF表面或进入本体溶液。在沉淀过程中,Cd(Ⅱ)被带负电荷的CO32-吸引,在CMZF表面或层间迅速析出CdCO3晶体。插层的As(Ⅲ)或As(Ⅴ)可将团聚的大块Cd CO3调节成纳米Cd CO3并固定在CMZF的夹层中。在吸附过程中,CMZF吸附剂对As(Ⅲ)、氧化生成的As(Ⅴ)和残留的Cd(Ⅱ)进行特殊吸附,并由—OH基团配位,形成复合三元络合物,其中氧化形成的带负电荷的As(Ⅴ)能中和Cd(Ⅱ)阳离子间的静电斥力,起到阴离子架桥作用,从而使CMZF与Cd(Ⅱ)之间产生更强的吸引力。而Cd(Ⅱ)则通过表面络合或配位以及增强氢键来提高对As(Ⅲ)的吸附。As(Ⅲ)和Cd(Ⅱ)的去除机理及相互作用如图 2所示。
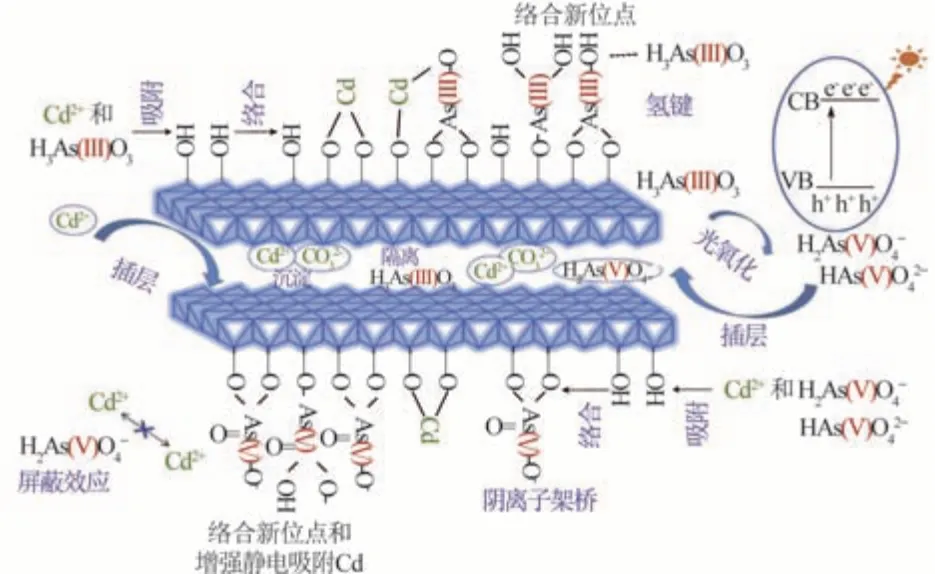
图 2 CMZF吸附剂去除砷和镉的机理示意Fig.2 Schematic dragram of the arsenic and cadmium removal mechanism by CMZFadsorbent
LDHs及其复合材料对共存重金属阴、阳离子的去除机制主要如下:(1)LDHs层间CO32-等阴离子与污染物阴离子的离子交换作用;(2)层间释放的CO32-、OH-等与污染物阳离子之间的沉淀作用;(3)溶液中共存污染物重金属阴、阳离子与材料表面—OH、M—O等官能团之间通过络合作用形成三元络合物,促进LDHs对共存重金属阴、阳离子的协同吸附作用;(4)污染液中共存的重金属阴、阳离子间的静电作用力可大幅度增强吸附剂对彼此共存异电荷离子的去除效果。
3 结语与展望
吸附法是目前处理重金属废水的重要方法,工业废水中存在的典型有毒重金属阳离子或含氧阴离子,如Pb2+、Hg2+、Cd2+和CrO42-等,已成为研究的热点〔57〕。开发成本低廉、去除效果好、无污染的吸附材料是目前研究的重点。国内外学者在LDHs去除废水中重金属方面做了不少研究,也取得了可喜的进展,但仍需进一步深入探究,主要体现在以下几个方面:
(1)LDHs及其复合材料在去除重金属离子方面应用广泛,但大多都是针对单一重金属污染治理,对于含共存阴、阳重金属离子、重金属-有机物复合型污染治理的研究却很少。因此,对于LDHs及其复合材料选择性吸附特定重金属离子或协同吸附重金属复合型污染物的研究还需深入。
(2)目前,LDHs及其复合材料对于重金属废水的去除机制研究大多集中在材料本身与污染物离子的相互作用方面,对于污染物离子与LDHs发生同晶取代后生成的新LDHs的研究较少。了解发生同晶取代后材料的性质对研究LDHs去除重金属的特异性是非常重要的,这将为开发低成本的LDHs类吸附剂提供一个新的视角。
(3)目前,LDHs及其复合材料在实际废水处理中的应用研究不够成熟,对重金属废水的研究大多停留在实验室阶段,不能大规模使用。因此,开发合理的制备方法以研制高效、低成本的LDHs及其复合材料,并研究其在实际重金属废水中的应用是各位学者需要共同努力的一个重要方向。

