花椒叶黄酮的提取工艺优化及其抗氧化活性检测
金伟嘉,卢利平,2*,刘晓莹,李佳怡,杨扬
(1.西北民族大学 生命科学与工程学院,甘肃 兰州 730030;2.生物医学研究中心中国马来西亚国家联合实验室,甘肃 兰州 730030)
花椒(Zanthoxylumbungeanum)属芸香科、花椒属,是我国特有的具有悠久种植历史的一种食物香料,尤其在我国北方是著名的香料及油料树种[1]。花椒除了是我国食品工业中常用的香辛调味料[2]以外,还具有一定的药用价值[3]。花椒叶作为花椒的典型副产品,它的特点包括麻香味浓厚和营养成分丰富。花椒叶中富含黄酮类化合物、糖苷、多酚、芳香油等多种活性成分[4-5],其中黄酮类化合物具有抑菌[6]、抗癌[7-8]、抗氧化[9]、降血脂[10]、降血压、保护心脏、抗衰老、抗炎等药理活性[11],已被广泛应用于食品、化妆品、药品等领域[12-13],因而可知,对花椒叶中黄酮类化合物进行开发利用具有较高的研究价值。
花椒栽植被甘肃作为贫困山区精准扶贫富民产业的主要行业来培育,栽植面积逐渐扩大[14],品质优异,花椒产品远销国内外,受到一致好评。但对于花椒资源主要是果实的采收与加工,忽略了对花椒叶中各组成成份的开发与综合利用,极大地浪费了花椒叶这一低值副产品。花椒叶中富含黄酮类化合物,可作为良好的黄酮提取原材料,其中大红袍因其色泽鲜艳,麻味更浓,是最具代表性的花椒优良品种。因此,对花椒叶中黄酮类化合物的提取进行优化,并对生物活性进行研究可以提高花椒叶的附加值,延长花椒产品产业链,同时增加了山区椒农的经济收入,也对扶贫工作起到一定的辅助作用。本试验采用超声波辅助法探讨天水花椒叶中黄酮类化合物的提取工艺,并通过Box-Behnken设计响应面进行优化,以此确定最佳工艺参数,为花椒叶的进一步开发应用提供参考。
1 材料与方法
1.1 材料
花椒叶(大红袍花椒叶,2020年5月采摘自甘肃甘谷县大象山镇);无水乙醇、丙酮、亚硝酸钠、九水合硝酸铝、氢氧化钠(粒)、水杨酸、硫酸亚铁、抗坏血酸、30%过氧化氢均为分析纯(兰州市奥科生物技术有限公司);芦丁标准品(Solarbio公司);1,1-二苯基-2-苦基肼(DPPH)(上海麦克林生化科技有限公司)。
AR224CN电子分析天平(奥豪斯仪器(常州)有限公司);TD5Z离心机(湖南凯达科学仪器有限公司);SB-500DTY超声波清洗机(宁波新芝生物科技股份有限公司);WJX-200型高速多功能粉碎机(上海缘沃工贸有限公司);HH-S4A电热恒温水浴锅(北京科伟永兴仪器有限公司);DHG-9420A电热鼓风干燥箱(上海一恒科学仪器有限公司);L3S可见分光光度计(上海仪电分析仪器有限公司)。
1.2 方法
1.2.1 花椒叶黄酮提取工艺流程
大红袍花椒叶干燥→粉碎过筛→脱色处理→超声提取→离心→黄酮提取液。
1.2.2 原料处理
洗净新鲜摘取的花椒叶,除去叶柄,自然晾干,在60 ℃烘箱中烘至恒重,即得干燥的花椒叶。粉碎花椒叶并过80目筛(孔径0.177 mm),丙酮浸泡过夜后,进行抽滤,将抽滤过后的花椒叶粉放置30 ℃烘箱中烘干至恒重,完成脱色处理,将处理好的花椒叶粉放入封口袋,密封保存备用。
1.2.3 提取
向比色管中加入准确称量好的1 g花椒叶粉,在超声频率40 kHz下,在一定体积分数的乙醇溶液、液料比、浸提时间、浸提温度下进行超声波辅助处理。过滤收集,在提取2次后合并上清液,于12 000 r·min-1离心15 min,最终提取液为定容至50 mL的上清液。
1.2.4 芦丁标准曲线的绘制
称量适量的芦丁标准品,用30%乙醇溶液配制得到0.2 mg·mL-1的芦丁标准品储备液。通过吸取不同体积(0、0.5、1.0、1.5、2.0 mL)的芦丁标准品准备液置于10 mL具塞试管中来设置不同浓度梯度,加入80%乙醇溶液补到5 mL,加入0.3 mL 5%亚硝酸钠溶液,摇匀静置6 min,加入10% Al(NO3)3溶液0.3 mL,反应6 min,再加入4% NaOH溶液4 mL,混合均匀后用蒸馏水定容至刻度线,15 min后于510 nm波长处测定其吸光值[15]。
1.2.5 黄酮含量的测定
准确移取0.5 mL花椒叶提取液放到10 mL具塞试管中,以80%乙醇溶液定容到5 mL,混合均匀后同1.2.4节操作方法进行反应,于波长510 nm处测量其吸光值,花椒叶中黄酮浓度依据标准曲线推算,并计算黄酮的得率[16]。
1.3 单因素试验设计
1.3.1 乙醇体积分数对黄酮得率的影响
控制液料比为30∶1 mL·g-1,浸提温度为50 ℃、浸提时间为50 min,研究乙醇体积分数分别为45%、50%、55%、60%、65%、70%时对花椒叶黄酮得率的影响。
1.3.2 浸提时间对黄酮得率的影响
控制液料比为30∶1 mL·g-1,乙醇体积分数为60%,浸提温度为50 ℃,研究浸提时间分别为25、30、35、40、45、50 min时对花椒叶黄酮得率的影响。
1.3.3 浸提温度对黄酮得率的影响
控制液料比为30∶1 mL·g-1,乙醇体积分数为60%,浸提时间为40 min,研究浸提温度分别为40、45、50、55、60、65 ℃时对花椒叶黄酮得率的影响。
1.3.4 液料比对黄酮得率的影响
控制乙醇体积分数为60%,浸提温度为55 ℃,浸提时间为40 min,研究液料比分别为20∶1、25∶1、30∶1、35∶1、40∶1、45∶1 mL·g-1时对花椒叶黄酮得率的影响。
1.4 响应面优化试验
在单因素试验的基础上,按照Box-Behnken设计原理工艺优化选取乙醇浓度(A)、浸提时间(B)、浸提温度(C)、液料比(D)4个因素作为自变量,以花椒叶黄酮得率为响应值,依据试验因素和水平设计进行响应面试验设计,优化黄酮的提取工艺。
-1、0、1水平:A分别为55%、60%和65%;B分别为35、40和45 min;C分别为50、55和60 ℃;D分别为30∶1、35∶1和40∶1 mL·g-1。
1.5 大红袍花椒叶黄酮抗氧化能力的测定
许多研究发现自由基与人体的健康息息相关,自由基含量超过一定标准,会干扰人体正常的新陈代谢活动,甚至会诱发心血管疾病、癌症等[17-18],因此,测定其抗氧化能力是具有一定意义的。
1.5.1 DPPH清除能力的测定
参照宋岩等[19]的方法测定。采用最优工艺参数提取大红袍花椒叶样品中的黄酮,稀释提取液得到质量浓度为30、60、90、120、150 μg·mL-1的黄酮提取液,各取1.0 mL于10 mL具塞试管中,再分别加入精确吸取2 mL的0.2 mol·L-1DPPH溶液,充分混匀后,室温静置避光30 min,测定于517 nm处的吸光值;用无水乙醇替代样品溶液测得吸光值,用无水乙醇替代DPPH溶液测得吸光值,配制同浓度VC溶液作为阳性对比,计算自由基清除率。
1.5.2 OH自由基清除能力的测定
测定方法采用水杨酸比色法[20]进行测定,配制相同浓度的VC溶液作为阳性对比,计算羟基自由基的清除率。
1.6 数据处理
最终结果取3次平行试验的平均值,利用Office Excel数据分析软件、Origin 8.0制图软件和Design-Expert 8.06响应面设计软件进行结果分析。
2 结果与讨论
2.1 芦丁标准曲线
芦丁标准曲线如图1所示,以芦丁标准品浓度为横坐标,517 nm处吸光值为纵坐标进行绘制。得到标准曲线方程为:y=8.687 1x+0.002 6,相关系数R2=0.999 3,且在0.01~0.05 mg·mL-1呈现良好的线性关系。

图1 芦丁标准品浓度与吸光值的标准曲线
2.2 单因素影响
2.2.1 乙醇体积分数对黄酮得率的影响
由图2可得,随着乙醇体积分数的增大,黄酮得率先逐渐上升,当乙醇体积分数为60%时,黄酮得率达到最高;继续提高乙醇体积分数,黄酮得率下降趋势明显。依据相似相溶规律可知,黄酮溶于乙醇的量与两者极性密切相关,花椒叶中黄酮的极性与60%的乙醇溶液相近,故得率为最大值。随着乙醇体积分数继续增大,观察到提取液的颜色开始向绿色转变,这可能是由于醇溶性杂质、色素等其他成分溶出量的增加,这些会同黄酮类化合物形成竞争关系,导致黄酮得率下降[21]。根据花椒叶黄酮得率变化规律,选取55%~65%的乙醇体积分数进行响应面优化试验设计。

图2 乙醇体积分数对黄酮得率的影响
2.2.2 浸提时间对黄酮得率的影响
由图3可得,在一定时间范围内,大红袍花椒叶黄酮得率呈现先增加后减少的变化规律,在浸提时间为40 min时,黄酮得率最高为13.85%;浸提时间超过40 min后,黄酮得率不增反而有缓慢下降趋势。原因可能为随着时间的增加,黄酮提取会越来越充分,但时间过长会使得黄酮部分结构破坏,导致得率降低[22]。根据花椒叶黄酮得率变化规律,浸提时间选取35~45 min进行响应面优化试验设计。

图3 浸提时间对黄酮得率的影响
2.2.3 浸提温度对黄酮得率的影响
由图4可得,在浸提温度40~55 ℃黄酮得率,随着浸提温度的上升而增大,当温度超过55 ℃后,黄酮得率开始下降。这是因为在一定的温度范围能够促进黄酮分子的运动速率,从而提高黄酮的溶出,但是超过一定温度界限,黄酮中热稳定性较低的结构被破坏,其他杂质的析出比例上升,因而黄酮的得率会有所降低[23]。根据花椒叶黄酮得率变化规律,浸提温度选取50~60 ℃进行响应面优化试验设计。

图4 浸提温度对黄酮得率的影响
2.2.4 液料比对黄酮得率的影响
由图5可得,在液料比为20∶1~35∶1 mL·g-1,黄酮得率随着液料比的升高而升高,当液料比超过35∶1 mL·g-1后,黄酮得率呈下降趋势。这是由于当浸提液含量占比较小时,花椒叶中黄酮不能完全溶出;随着溶剂量增加,杂质溶出量增加导致黄酮提出率降低,过量的乙醇导致黄酮损失[24]。根据花椒叶黄酮得率变化规律,液料比选取30∶1~40∶1 mL·g-1进行响应面优化试验设计。

图5 液料比对黄酮得率的影响
2.3 响应面设计
2.3.1 响应面法试验设计结果
基于单因素试验结果,通过Design-Expert 8.06软件设计,以A、B、C、D为自变量,以花椒叶黄酮得率为响应值进行响应面分析,响应面试验设计方案及结果如表1所示,其中25、26、27、28、29是中心试验,其余为析因试验。得到黄酮提取液的拟合回归方程为:Y=15.25-0.11A+0.030B+0.32C-1.12D+0.038AB+0.084AC-0.17AD+0.24BC-0.18BD+0.16CD-2.01A2-2.19B2-2.33C2-1.60D2。

表1 响应面设计方案及黄酮得率

2.3.2 响应面法试验设计分析
RSM图形可以直观评估乙醇体积分数、浸提温度、浸提时间和液料比对黄酮得率的影响,如图6~11所示。交互效应的强弱趋向可以被响应面坡度陡峭程度和等高线椭圆形状反映,交互效应强弱水平可以从投影面的等高线形状中观察,曲面倾斜度越大,则该因素对响应值的影响越显著[25]。对比图6~11,液料比对黄酮得率的影响最大,其次是浸提温度和浸提时间,乙醇体积分数影响较小。各因素等高线椭圆形状不明显,表明其交互作用不显著,符合回归方程的方差分析结果[26]。

图6 乙醇体积分数与浸提时间对黄酮得率的影响

图7 乙醇体积分数与浸提温度对黄酮得率的影响

图8 乙醇体积分数与液料比对黄酮得率的影响

图9 浸提温度与浸提时间对黄酮得率的影响

图10 浸提时间与液料比对黄酮得率的影响

图11 浸提温度与液料比对黄酮得率的影响
2.3.3 验证试验
通过Design-Expert 8.06软件设计分析结果,得到黄酮得率取得最大值时的工艺条件为:乙醇体积分数59.94%,浸提时间40.12 min,浸提温度55.29 ℃,液料比33.26 mL·g-1,在此条件下,黄酮得率为15.45%。考虑实际情况,适当调整工艺条件,即乙醇体积分数60%,浸提时间40 min,浸提温度55 ℃,液料比33∶1 mL·g-1。为进一步验证该工艺的准确性,在此条件下进行3组验证试验,测得的实际黄酮得率平均值为15.40%(表2),接近理论预测值(相对误差为0.32%),说明响应面法优化花椒叶黄酮的提取工艺条件具有可行性。

表2 验证试验的黄酮得率
2.4 大红袍花椒叶黄酮提取液的抗氧化能力
2.4.1 DPPH自由基清除率
由图12可得,质量浓度在30~150 μg·mL-1内随样品浓度的增加,清除率逐渐增加,在浓度范围内,黄酮提取液对DPPH的清除效果略高于VC溶液,当浓度在150 μg·mL-1时,VC的清除能力开始超过黄酮提取液。综合来看,表明大红袍花椒叶黄酮具有较好的DPPH清除能力。

图12 大红袍花椒叶黄酮对DPPH自由基的清除能力
2.4.2 OH自由基清除率
由图13可得,黄酮提取液与VC溶液对OH自由基的清除能力随着样品浓度的升高逐渐增强,在浓度范围内,黄酮提取液对OH自由基的清除能力相较于VC溶液更优,当样品质量浓度为150 μg·mL-1时,对OH自由基的清除率达到72.50%,表明花椒叶黄酮的抗氧化性良好。
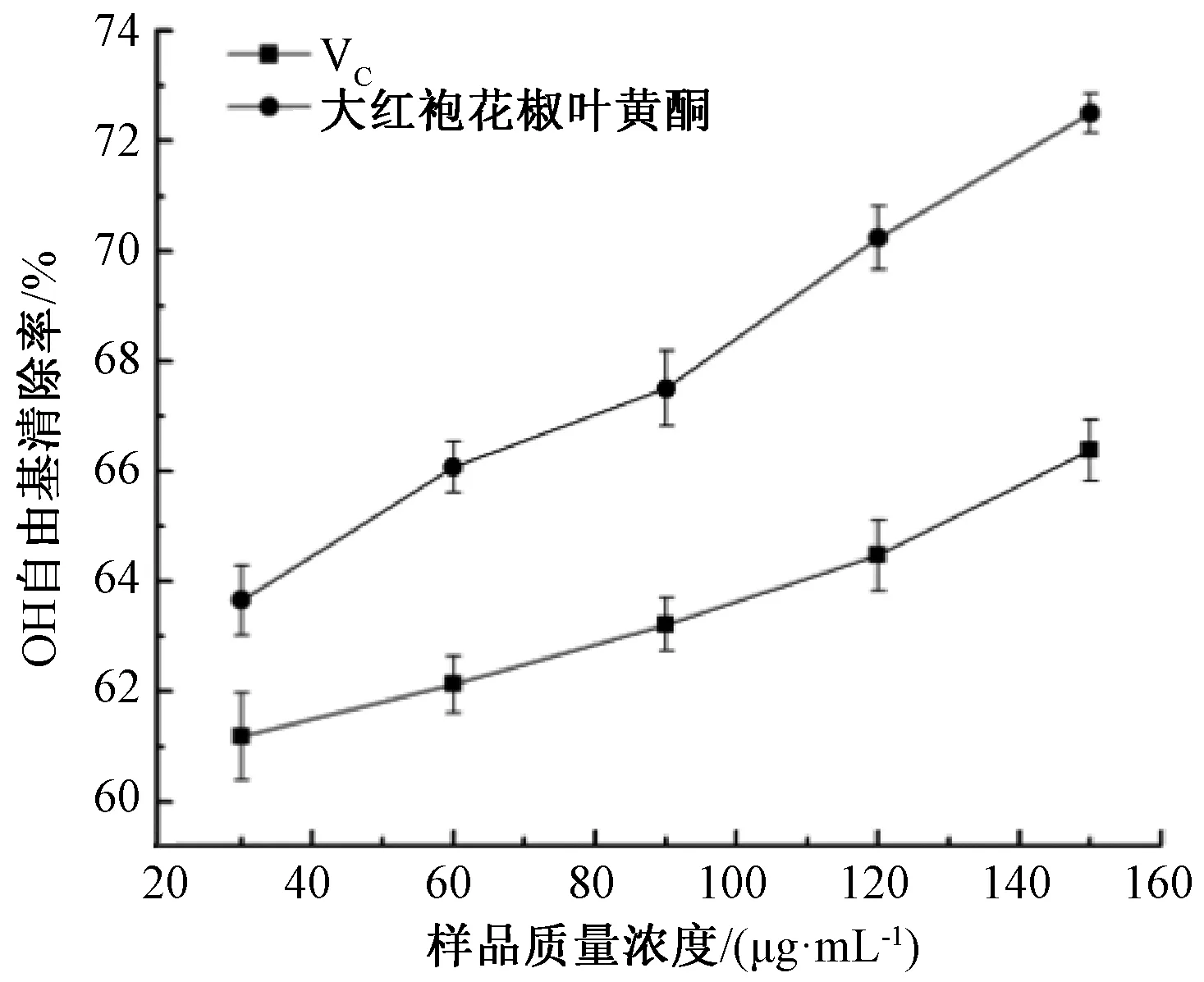
图13 大红袍花椒叶黄酮对OH自由基的清除能力
3 小结
采用响应面法优化了超声辅助提取大红袍花椒叶黄酮的工艺,建立了乙醇体积分数、浸提温度、浸提时间和液料比对大红袍花椒叶黄酮浸提量影响的回归模型。结果表明,各因素对黄酮得率的影响次序为液料比>浸提温度>浸提时间>乙醇体积分数,由此得到最佳提取工艺条件为:乙醇体积分数60%,浸提时间40 min,浸提温度55 ℃,液料比33∶1 mL·g-1,在该条件下,大红袍花椒叶中黄酮得率达到(15.40±0.05)%。从抗氧化活性试验得出大红袍花椒叶黄酮对DPPH和OH自由基的清除效果良好,可作为提取天然抗氧化剂的原料,提高花椒叶的附加价值,为花椒副产物的开发利用提供理论参考。

