基于色谱指纹图谱和含量测定相结合的青风藤质量控制方法研究
任明军,胡云飞,朱永波,仇 萍,李 正,李文龙*
基于色谱指纹图谱和含量测定相结合的青风藤质量控制方法研究
任明军1, 2,胡云飞1, 2,朱永波3,仇 萍3,李 正1, 2,李文龙1, 2*
1.天津中医药大学中药制药工程学院,天津 300193 2.省部共建组分中药国家重点实验室,天津 301617 3.湖南正清制药集团股份有限公司,湖南 怀化 418000
建立青风藤的液相色谱指纹图谱与含量测定方法,更全面、合理地控制青风藤药材的质量。建立青风藤药材的液相色谱指纹图谱方法,对74批青风藤药材进行分析,使用《中药色谱指纹图谱相似度评价系统(2012版)》对74批青风藤药材进行相似度评价,确定共有峰,使用SIMCA-P(V 14.1)软件对74批青风藤药材的指纹图谱数据进行正交偏最小二乘判别分析(orthogonal partial least squares discriminant analysis,OPLS-DA),从活性物质中选择对青风藤产地及部位影响较大的共有成分作为青风藤的质量控制成分,对其进行含量测定,并分析测定结果。方法学验证结果表明,所建方法适用于青风藤药材指纹图谱和含量测定;经化学计量学分析与文献调研,最终选择木兰花碱和青藤碱作为青风藤的质量控制成分含量测定。结果表明,不同药用部位的青风藤中青藤碱含量差异较大,而不同产地的青风藤中木兰花碱含量差异较大,青风藤根茎与根中的青藤碱含量较藤茎中青藤碱含量高,湖北产青风藤中木兰花碱较其他产地高。所建立的青风藤指纹图谱和含量测定方法色谱峰分离度、拖尾因子、准确度、线性、精密度、稳定性、重现性等参数均符合《中国药典》2020年版要求,可对青风藤进行准确的定性和定量分析,适用于青风藤药材的质量控制。
青风藤;青藤碱;木兰花碱;正交偏最小二乘判别分析;指纹图谱
青风藤性平,味苦、辛;归肝经、脾经,具有通经络、祛风湿和利小便等功效,被用于治疗风湿痹痛、麻痹瘙痒和关节肿胀等症[1]。现代药理研究表明,青风藤具有抗炎、抑制免疫应答、抗肿瘤、抑制血管生成、抗心律失常、镇痛、抗溶血等药理作用[2-5]。目前已从青风藤中分离并鉴定出137种生物碱类成分,以及挥发油、三萜等其他种类化学成分[6-14]。
青风藤始载于宋代《图经本草》,于《本草纲目》《植物名实图考》《本草品汇精要》也有记载[15]。《中国药典》、《欧洲药典》和《英国药典》中均规定青风藤为防己科植物风藤(Thumb.) Rehd.et Wils.和毛青藤(Thumb.) Rehd.et Wils.var.Rehd.et Wils.的干燥藤茎,但在《日本药典》和《韩国药典》中,根茎和藤茎均可作为药用部位[1, 16-19]。前期产地、市场调研发现,青风藤根茎和根中主要药效成分青藤碱含量较藤茎高,目前市场上青风藤根茎、藤茎和根混用问题严重。《中国药典》2020年版中以青藤碱含量作为青风藤质量控制的标准,文献中也多采用类似做法[20-22]。但中药作为一种复杂体系,化学成分多样,单一成分的含量测定难以全面控制青风藤药材的质量。指纹图谱信息丰富,能够对药材质量进行全面反映,被国内外用作天然药物质量控制的有效方法,化学模式识别是确定质量标志物的重要方法[23],因此本实验使用化学模式识别方法分析了不同药用部位和产地的青风藤指纹图谱信息,结合药理作用等确定了青风藤的质量标志物,并建立了青风藤的指纹图谱和含量测定方法,以期更为全面地控制青风藤的质量,为区分和修正青风藤药用部位提供参考。
1 仪器与材料
1.1 仪器与软件
Waters 2695型高效液相色谱仪,配备2998型PDA检测器(美国Waters公司),BGZ-140型电热鼓风干燥箱(上海博讯医疗生物仪器股份有限公司),WB400US型超声清洗机(上海望标仪器有限公司),ME55型电子天平(瑞士Metter-toledo公司),TG16-WS型离心机(湖南湘仪实验室仪器开发有限公司),JK-200DB型数控超声波清洗器(安徽合肥金尼克机械制造有限公司),Milli-Q型超纯水系统(美国Millipore公司)。
采用《中药色谱指纹图谱相似度评价系统(2012版)》计算青风藤色谱指纹图谱相似度;采用SIMCA-P(V 14.1)数据处理软件对指纹图谱进行数据处理。
1.2 试剂及材料
对照品青藤碱(批号110774-201808)购自中国食品药品检定研究院,木兰花碱(批号P23J11L119379)购自上海源叶生物科技有限公司,质量分数大于98%。
甲醇、乙醇,购自国药集团化学试剂有限公司,乙腈购自美国天地有限公司,氨水购自阿拉丁科技(中国)有限公司,甲酸铵购自上海易恩化学技术有限公司,超纯水由Milli-Q型超纯水系统制备。
青风藤药材均采集于青风藤主产区,并经天津中医药大学王春华副研究员鉴定青风藤样品均为防己科植物青藤(Thunb.) Rehd.et Wils.或毛青藤(Thunb.) Rehd.et Wils.var.Rehd.et Wils,样品信息见表1。
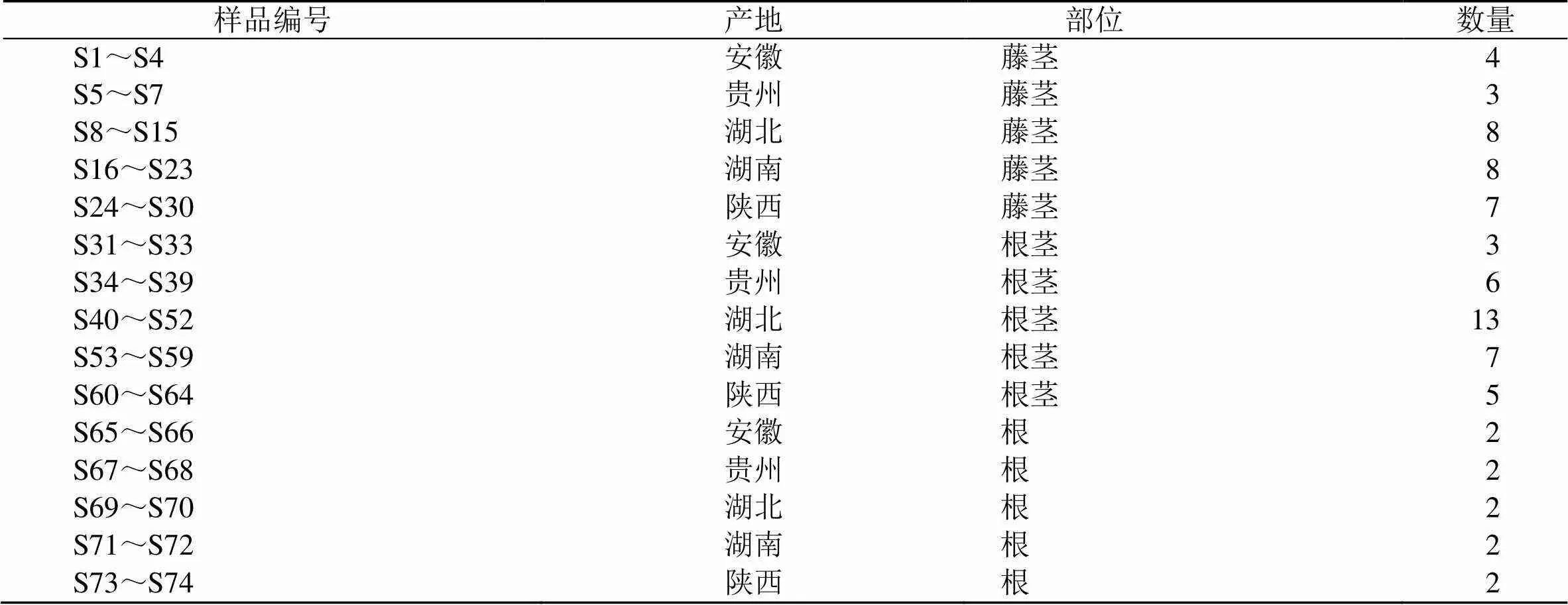
表1 样品信息
2 方法与结果
2.1 指纹图谱的建立
2.1.1 对照品溶液的制备 分别取对照品青藤碱5.70 mg与木兰花碱5.92 mg置于5 mL量瓶中,加甲醇至刻度,即得青藤碱与木兰花碱的混合对照品储备液。
2.1.2 供试品溶液的制备 精密称取过50目药筛的本品粉末约0.5 g,置具塞锥形瓶中,精密加入70%乙醇20 mL,密塞,超声处理20 min(功率200 W,频率40 kHz),滤过,并用70%乙醇20 mL冲洗滤渣,合并滤液与洗液,60 ℃下回收溶剂至干,残渣加甲醇溶解,转移至20 mL量瓶中,加甲醇至刻度,摇匀,离心取上清液,即得。
2.1.3 色谱条件 Waters 2695液相色谱仪;色谱柱:Waters XBrige C18(250 mm×4.6 mm,5 µm);流动相为水(10 mmol/L甲酸铵,用氨水调节pH至10.0,A)-乙腈(B),梯度洗脱,0~15 min,5%~15% B;15~30 min,15%~20% B;30~37 min,20%~21% B;37~45 min,21% B;45~50 min,21%~30% B;50~60 min,30%~95% B。体积流量1.0 mL/min;检测波长262 nm;柱温25 ℃;进样量5 µL。
2.1.4 精密度试验 精密称取过50目药筛的本品粉末约0.5 g(样品编号为S19),照“2.1.2”项下条件提取样品,按“2.1.3”项下色谱条件连续进样6次,以青藤碱为参照峰,计算3个共有峰相对保留时间RSD小于0.1%,相对峰面积RSD小于1%,表明仪器精密度良好。
2.1.5 稳定性试验 精密称取过50目药筛的青风藤粉末约0.5 g(样品编号为S19),按照“2.1.2”项下条件提取样品,分别于制备后0、2、4、8、13、24 h按“2.1.3”项下色谱条件进样,以青藤碱为参照峰,计算3个共有峰相对保留时间RSD小于0.1%,相对峰面积RSD小于1.5%。
2.1.6 重复性试验 精密称取过50目药筛的同一批青风藤药材粉末6份(样品编号为S19),每份约0.5 g,按照“2.1.2”项下条件提取样品,按“2.1.3”项下色谱条件分别进样,以青藤碱为参照峰,计算3个共有峰相对保留时间RSD小于0.1%,相对峰面积RSD小于3.0%。
2.1.7 指纹图谱的建立及相似度评价 精密称取过50目药筛的74批不同产地及部位的青风藤药材粉末,每批约0.5 g,按照“2.1.2”项下方法制备供试液,按“2.1.3”项下色谱条件进样,记录74批青风藤药材色谱图,图1为空白、青藤碱与木兰花碱混标和编号为S19的青风藤样品色谱图。将实验所得青风藤液相色谱数据导入《中药色谱指纹图谱相似度评价系统(2012版)》进行分析。将S19号样品设置为青风藤指纹图谱的参照图谱,时间窗口设置为0.5,采用中位数生成对照图谱,青风藤液相色谱指纹图谱中5和20号色谱峰为共有峰,使用对照品对色谱图中色谱峰进行指认,5号色谱峰为木兰花碱,20号色谱峰为青藤碱,青风藤色谱指纹图谱相对保留时间RSD小于2.59%,说明74批青风藤样品色谱峰保留时间较稳定,74批青风藤样品色谱峰相对峰面积RSD差别较大,最高为135.46%,表明74批青风藤样品质量相差较大。为方便观察,分别以S19、S53和S71 3批次样品为参照图谱,生成青风藤藤茎、根茎和根的指纹图谱,如图2~4所示。
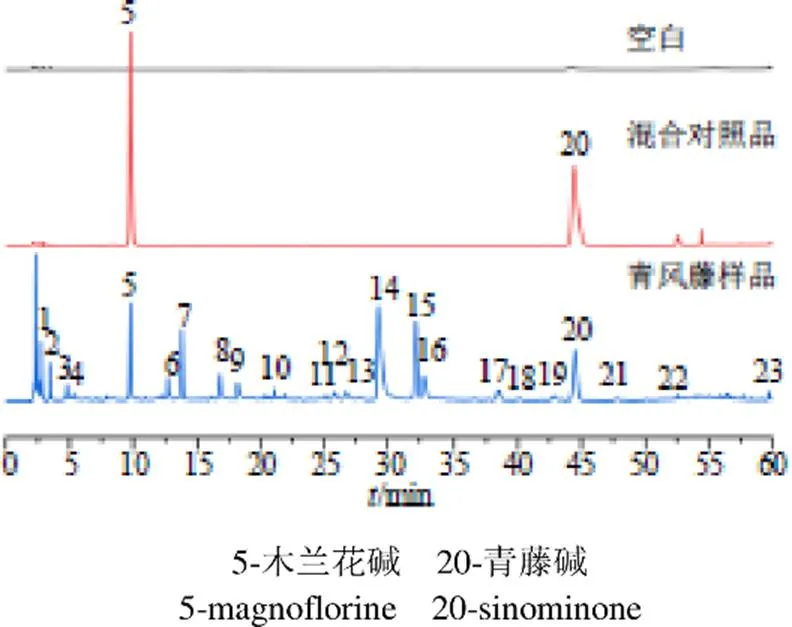
图1 空白、混合对照品、青风藤样品的液相色谱图

图2 30批青风藤藤茎的液相色谱指纹图谱
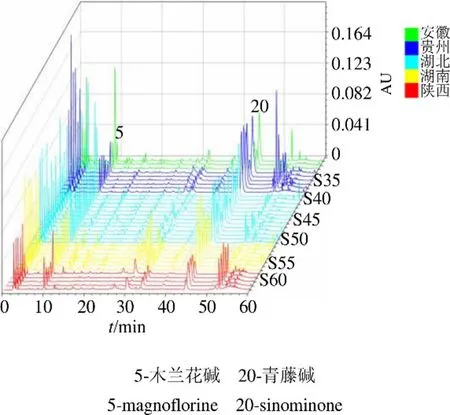
图3 34批青风藤根茎的液相色谱指纹图谱
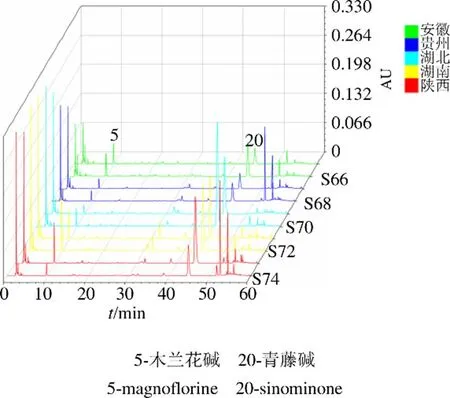
图4 10批青风藤根的液相色谱指纹图谱
2.1.8 正交偏最小二乘判别分析(orthogonal partial least squares discriminant analysis,OPLS-DA) OPLS-DA是在偏最小二乘判别分析(partial least squares discriminant analysis,PLS-DA)基础上发展出的算法,相对于PLS-DA,OPLS-DA将变量中系统标量分为同线性相关和同正交的2部分,随正交变异组分的增加,可增加解释性、减少误差[24-27]。
为寻找青风藤不同部位的质量差异成分,将74批青风藤样品指纹图谱数据导入SIMCA-P(V 14.1)进行OPLS-DA。根据先验知识将青风藤按部位分类,进行OPLS-DA,并对不同部位青风藤的OPLS-DA结果进行优化,当使用3个主成分时所得OPLS-DA结果最好,如图5所示,从图中可知,藤茎与根茎聚类趋势明显,根的内部质量差异较大,但也能聚为一类。不同部位青风藤OPLS-DA的分类变量的解释程度参数(2)为0.884,模型预测参数(2)为0.597,表明模型的拟合效果和预测能力满意。使用SIMCA-P(V 14.1)软件得到青风藤不同部位OPLS-DA的VIP值条形图,如图6所示。

图5 不同部位的青风藤样品OPLS-DA得分图

图6 不同部位的青风藤样品OPLS-DA的VIP图
为寻找不同产地青风藤的质量差异成分,将74批青风藤样品指纹图谱数据导入SIMCA-P(V 14.1)进行OPLS-DA。首先根据先验知识将青风藤按产地分为5类,进行OPLS-DA,并对不同产地青风藤OPLS-DA的参数进行优化,当使用4个主成分时所得OPLS-DA结果最好,结果如图7所示,从图中可知陕西、贵州和湖南的青风藤样品可以分别聚为一类,且组间差异较小,安徽与湖北的青风藤样品与其他产地青风藤样品分离趋势明显,但安徽与湖北的青风藤样品不能分别聚为一类,而是安徽与湖北2个产地的青风藤样品聚集为一类。经调研发现安徽与湖北青风藤采集地的纬度接近,安徽青风藤采集地的纬度为北纬 30°~36°,湖北青风藤采集地的纬度为北纬 27°~30°,安徽与湖北两地纬度相近可能是这2个产地青风藤品质较为相近的原因。不同产地青风藤OPLS-DA的分类变量的解释程度参数(2)为0.678,模型预测参数(Q2)为0.531,表明模型的拟合效果和预测能力满意。使用SIMCA-P(V 14.1)软件得到不同产地青风藤OPLS-DA的VIP值条形图,结果如图8所示。
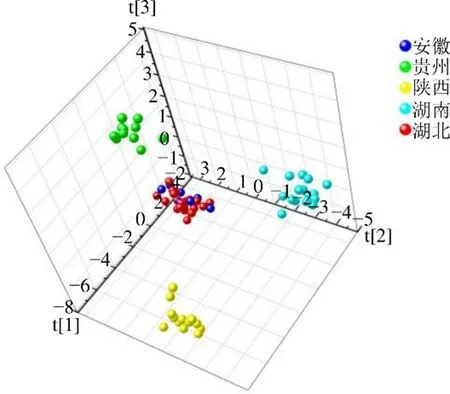
图7 不同产地的青风藤样品OPLS-DA得分图
2.1.9 指标成分选择 由图6可知,青风藤不同部位判别分析的VIP值大于1的共有峰有1个,保留时间为44.41 min(20号色谱峰);由图8可知,不同产地青风藤判别分析VIP值大于1的共有峰有2个,保留时间为44.41 min(20号峰)和9.73 min(5号峰),经对照品比对保留时间为9.73 min(5号峰)的色谱峰为木兰花碱,保留时间为44.41 min(20号峰)的色谱峰为青藤碱。查阅文献可知青藤碱为青风藤的主要药效成分,木兰花碱具有抗炎,抗糖尿病等药理作用[28],也是青风藤的主要药效成分之一,综上考虑,建议选择青藤碱和木兰花碱作为青风藤的质量标志物。
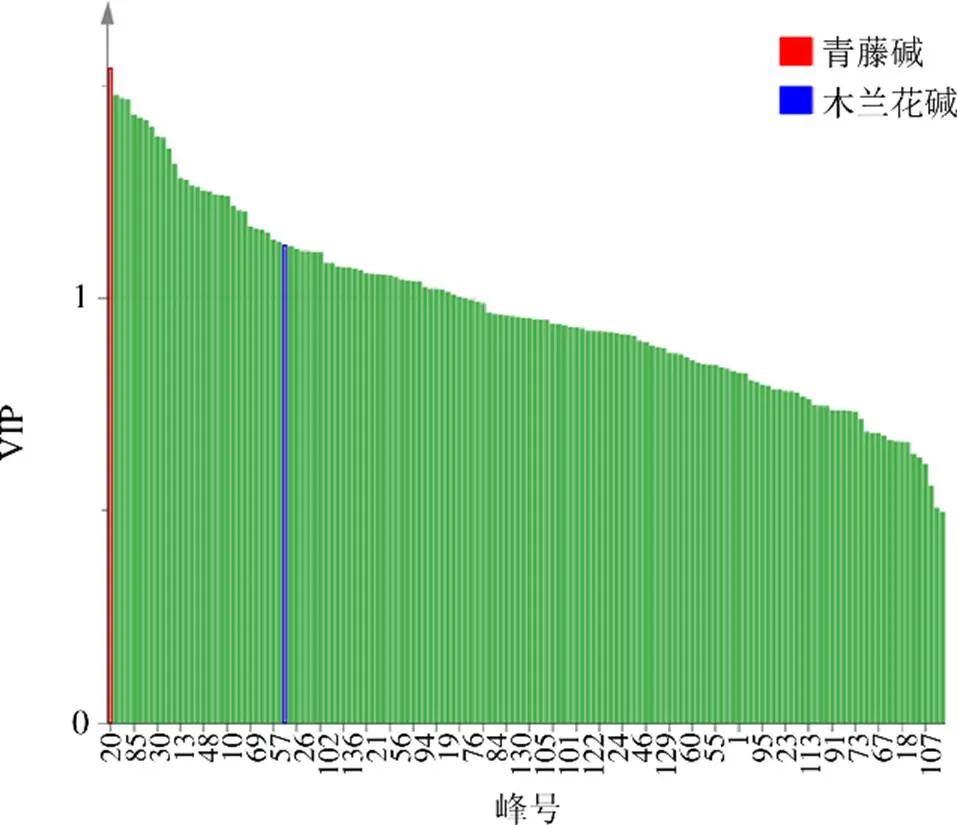
图8 不同产地的青风藤样品OPLS-DA的VIP图
2.2 含量测定
2.2.1 对照品溶液制备 同“2.1.1”项下方法。
2.2.2 供试品溶液制备 同“2.1.2”项下方法。
2.2.3 色谱条件 同“2.1.3”项下方法。
2.2.4 线性关系考察 取“2.1.1”项下制备的对照品储备液,以甲醇依次稀释2、4、8、16、32、64倍,按“2.1.3”项下色谱方法进行测定,记录数据,以样品浓度为横坐标(),以峰面积为纵坐标(),进行线性回归,得回归方程与相关系数,结果见表2。
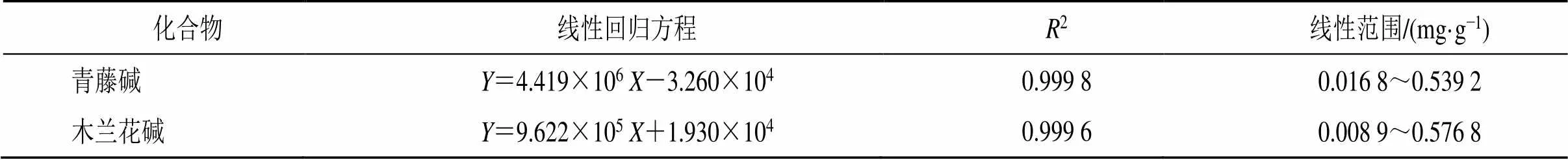
表2 青藤碱与木兰花碱线性回归方程及对应的相关系数
2.2.5 精密度试验 精密称取过50目药筛的青风藤粉末约0.5 g(样品编号为S19),按照“2.1.2”项下方法提取样品,按“2.1.3”项下色谱条件连续进样6次,计算木兰花碱和青藤碱峰面积RSD分别为0.25%和0.38%,表明仪器精密度良好。
2.2.6 稳定性试验 精密称取过50目药筛的青风藤粉末约0.5 g(样品编号为S19),按照“2.1.2”项下条件提取样品,分别于制备后的0、2、4、8、12、24 h,按“2.1.3”项下色谱条件进样,计算木兰花碱和青藤碱峰面积RSD分别为1.19%和1.73%,表明供试液在24 h内稳定性良好。
2.2.7 重复性试验 精密称取过50目药筛的同一批青风藤药材粉末6份(样品编号为S19),每份约0.5 g,按照“2.1.2”项下条件提取样品,按“2.1.3”项下色谱条件分别进样,计算木兰花碱和青藤碱峰质量分数RSD分别为0.70%和0.71%。
2.2.8 加样回收率试验 精密称取同一批已测定过含量的青风藤样品粉末6份(样品编号为S19),每份0.25 g,分别精密加入适量的对照品,按“2.1.2”项下方法提取样品,按“2.1.3”项下色谱条件进样,测定木兰花碱和青藤碱的峰面积,木兰花碱和青藤碱加样回收率分别为92.54%和96.44%,RSD分别为1.09%和1.02%。
2.2.9 样品测定 精密称取过50目药筛的74批青风藤药材粉末,每批约0.5 g,按照“2.1.2”项下条件制备供试品,按“2.1.3”项下色谱条件分别进样,计算74批样品中木兰花碱和青藤碱的含量。根据含量测定结果将不同产地及药用部位的青藤碱和木兰花碱分别作图,不同产地及药用部位青风藤的青藤碱含量如图10所示,不同产地及药用部位青风藤的木兰花碱含量如图11所示。由图10可知药用部位对青藤碱含量影响较大,青风藤根茎与根中的青藤碱含量较藤茎中青藤碱含量高,青藤碱是青风藤的主要有效成分,因此建议将根茎也作为药用部位,出于可持续发展考虑,不建议将根作为青风藤的药用部位;由图11可知产地对木兰花碱含量影响较大,湖北生长的青风藤中木兰花碱较其他产地高。
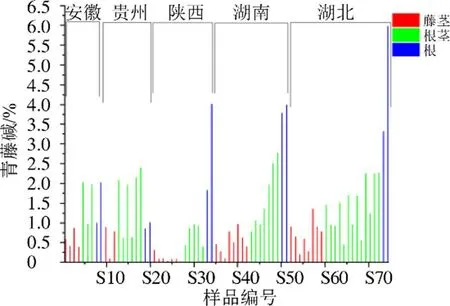
图10 74批不同部位和产地青风藤中青藤碱含量
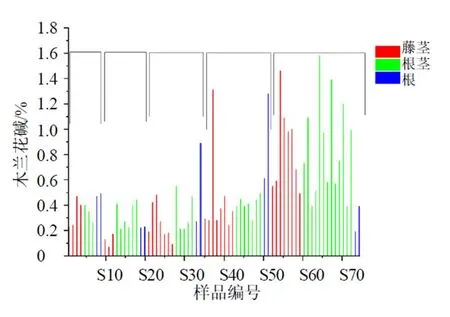
图11 74批不同部位及产地青风藤中木兰花碱含量
3 讨论
3.1 提取方法考察
实验考察了甲醇提取、70%乙醇提取、甲醇提取甲醇复溶、甲醇提取70%乙醇复溶、70%乙醇提取甲醇复溶、70%乙醇提取70%乙醇复溶共6种样品提取方法,结果发现使用甲醇提取、70%乙醇提取、甲醇提取70%乙醇复溶和70%乙醇提取70%乙醇复溶时木兰花碱前置拖尾均较严重,当使用70%乙醇提取甲醇复溶和甲醇提取甲醇复溶时,木兰花碱对应的色谱峰峰形较好,但70%乙醇较甲醇更加安全且成本更低,因此最终选用70%乙醇提取甲醇复溶作为青风藤样品的提取方法。考察了60%、70%、80%、90%和纯乙醇共5种提取溶剂浓度,结果发现在考察的乙醇浓度中,乙醇浓度越低提取效果越好,但提取方法需要蒸干溶剂,溶剂中水比例越高蒸干越慢,因此选用70%乙醇作为提取溶剂浓度。最终确定青风藤样品提取方法为精密称取过50目药典筛的本品粉末约0.5 g,置具塞锥形瓶中,精密加入70%乙醇20 mL,密塞,超声处理20 min(功率200 W,频率40 kHz),滤过,并用70%乙醇20 mL冲洗滤渣,合并滤液与洗液,60 ℃回收溶剂至干,残渣加甲醇溶解,转移至20 mL量瓶中,加甲醇至刻度,摇匀,离心取上清液,即得。
3.2 色谱条件优化
实验考察了甲酸水-甲醇、甲酸水-乙腈、乙酸水-甲醇、三乙胺水-甲醇、乙二胺水-甲醇、二乙胺水-乙醇、甲酸铵水-甲醇、甲酸铵水–乙腈等8种流动相体系,结果发现甲酸水体系青藤碱分离效果不好且拖尾严重,三乙胺水/乙二胺水/二乙胺水–甲醇体系色谱峰峰形好,但色谱峰的信息较少,且对色谱柱损伤大,甲酸铵水-乙腈体系色谱峰丰富、峰形好,故选用甲酸铵水-乙腈做流动现象;考察了262、267、277、283 nm 4个不同的检测波长,其中262 nm和283 nm是通过阅读文献和药典选择的,267 nm和277 nm是通过全波长扫描选择说的,实验结果表明使用262 nm和267 nm作为检测波长时色谱峰较多,但使用267 nm作为检测波长时木兰花碱色谱峰的分离度不稳定,所以最后选择262 nm作为青风藤的检测波长;考察了pH=9.0、9.5、10.0 3种不同的流动相pH,结果表明pH=10.0时青藤碱色谱峰较pH=9.5和pH=9.0时青藤碱色谱峰分离更好,所以选用pH=10.0作为本实验流动相水相的pH值;考察了20、25、30 ℃3种不同的色谱柱柱温,温度为25 ℃时青藤碱分离效果较好;考察了5、10、15 µL 3种不同进样量,结果表明只有进样量为5 µL时木兰花碱色谱峰较好,增加进样量时木兰花碱色谱峰前置拖尾较严重,故选用5 µL作为进样量;通过对比最终选择检测波长262 nm、10 mmol/L甲酸铵水溶液,氨水调节pH=10.0乙腈作为流动相体系、柱温25 ℃、进样量5 µL作为本实验的色谱条件。
4 小结
本课题组建立了青风藤的液相色谱指纹图谱和含量测定方法测定了74批青风藤药材,使用化学计量学方法对不同产地和药用部位的青风藤进行区分,根据差异成分选择了青藤碱和木兰花碱作为青风藤的质量标志成分对青风藤进行质量控制。但本实验仅考虑了青藤碱和木兰花碱2个药效成分,未能全面考虑青风藤的药效成分。因此今后将进一步建立基于质谱的青风藤分子指纹图谱,获得更全面的青风藤化学成分信息,并使用化学计量学方法和网络药理学方法进行分析,以判别不同产地、不同药用部位和不同基原青风藤、筛选差异成分和潜在药效成分,更合理地选择青风藤的质量标志成分,为青风藤的质量控制和质量标准建立提供参考。
利益冲突 所有作者均声明不存在利益冲突
[1] 中国药典 [S].一部.2020: 253.
[2] Zhu L H, Hao Y R, Guan H J,.Effect of sinomenine on vascular smooth muscle cell dedifferentiation and neointima formation after vascular injury in mice [J]., 2013, 373(1/2): 53-62.
[3] 王玺, 张智勇, 仇萍, 等.青风藤、青藤碱及其相关制剂的研究进展 [J].中国药学杂志, 2021, 56(2): 85-93.
[4] 刘强, 周莉玲, 李锐.青藤碱的研究概况 [J].中草药, 1997, 28(4): 247-249.
[5] 程维明.青风藤化学成分及青藤碱大鼠体内代谢研究[D].沈阳: 沈阳药科大学, 2005.
[6] Wang X L, Jin H Z, Li Z X,.8-Demethoxyrunanine from[J]., 2007, 78(7/8): 593-595.
[7] 宋永彬, 程维明, 曲戈霞, 等.青风藤化学成分的分离与鉴定 [J].沈阳药科大学学报, 2007, 24(2): 79-81.
[8] Jin H Z, Wang X L, Wang H B,.Morphinane alkaloid dimers from[J]., 2008, 71(1): 127-129.
[9] 李艳红.四种药用植物次生代谢物化学成分及生物活性研究 [D].昆明: 昆明理工大学, 2015.
[10] 杨丽娟.青风藤和地不容的化学成分及生物活性研究 [D].昆明: 云南大学, 2019.
[11] Wang L J, Jiang Z M, Xiao P T,.Identification of anti-inflammatory components inbased on spectrum-effect relationship and chemometric methods [J]., 2019, 167: 38-48.
[12] 刘丙蕊.青风藤中生物碱的提取分离和活性研究 [D].杨凌: 西北农林科技大学, 2011.
[13] 曾秋初.青风藤及其混淆品称钩风的本草考证与鉴别 [J].中草药, 1991, 22(1): 42-45.
[14] European Pharmacopoeia Commission.European Pharmacopoeia [S].Strasbourg: European Directorate for the Quality of Medicines & Health Care, 2016.
[15] British Pharmacopoeia Commission Office.European Pharmacopoeia [S].London: The Stationery Office, 2007.
[16] Japanese Pharmacopoeia Committee.The Japanese Pharmacopoeia [S].Tokyo: 2016.
[17] Korean Pharmacopoeia Committee.The Korean Pharmacopoeia [S].Chungcheongbuk-do: The Ministry of Food and Drug Safety, 2013.
[18] Jiang Z M, Wang L J, Pang H Q,.Rapid profiling of alkaloid analogues inby an integrated characterization strategy and quantitative analysis [J]., 2019, 174: 376-385.
[19] 沙振方, 孙文基.青风藤中青藤碱的HPLC法测定 [J].中药材, 1989, 12(10): 36-37.
[20] 王慧, 叶卿, 赵亮, 等.反相离子对色谱法测定青风藤中青藤碱的含量 [J].第二军医大学学报, 2010, 31(2): 193-195.
[21] 孙立丽, 王萌, 任晓亮.化学模式识别方法在中药质量控制研究中的应用进展 [J].中草药, 2017, 48(20): 4339-4345.
[22] Trygg J, Wold S.Orthogonal projections to latent structures (O-PLS) [J]., 2002, 16(3): 119-128.
[23] 漆小泉、王玉兰、陈晓亚.植物代谢组学:方法与应用[M].北京: 化学工业出版社, 2011: 154.
[24] Trygg J.Prediction and spectral profile estimation in multivariate calibration [J]., 2004, 18(34): 166-172.
[25] 王俊, 许多宽, 肖勇, 等.基于化学指标的烟叶产区正交偏最小二乘判别分析 [J].中国烟草科学, 2017, 38(1): 91-96.
[26] Xu T, Kuang T T, Du H,.Magnoflorine: A review of its pharmacology, pharmacokinetics and toxicity [J]., 2020, 152(5): 1-16.
Quality control ofbased on chromatographic fingerprints and content determination
REN Ming-jun1, 2, HU Yun-fei1, 2, ZHU Yong-bo3, QIU Ping3, LI Zheng1, 2, LI Wen-long1, 2
1.College of Pharmaceutical Engineering of TCM, Tianjin University of Traditional Chinese Medicine, Tianjin 300193, China 2.State key Laboratory of Component-based Chinese Medicine, Tianjin 301617, China 3.Hunan Zhengqing Pharmaceutical Group Co., Ltd., Huaihua 418000, China
To establish the HPLC fingerprints and content determination methods to control the quality of Qingfengteng () more comprehensively and reasonably.The HPLC fingerprints method ofwas established, and 74 batches ofwere analyzed.The similarities of 74 batches ofwere evaluated using the similarity evaluation software of traditional Chinese medicine chromatographic fingerprint (2012 Edition), and the common peaks were determined.SIMCA-P (V 14.1) was used to reduce the dimension of HPLC fingerprints of 74 batches of, and the orthogonal partial least squares discriminant analysis (OPLS-DA) was carried out.From the active substances, the common components which have a great influence on the origins and medicinal parts ofwere selected as the quality control components of, and their content was determined and the determination results were analyzed.The results of methodological verification showed that the method was suitable for fingerprint and content determination of.After chemometrics analysis and literature research, magnoflorine and sinomenine were selected as the quality markers of, and the contents of sinomenine and magnoflorine in 74 batches ofwere determined.The results showed that the medicinal parts had a great influence on the content of sinomenine, and the origins had a great influence on the content of magnoflorine in.The content of sinomenine in the rhizome and root ofwas higher than in the stem, and the content of magnoflorine in the samples from Hubei Province were higher than other origins.The chromatographic peak resolution, tailing factor, accuracy, linearity, precision, stability, reproducibility and other parameters of the established HPLC fingerprints and content determination methods meet the requirements of Chinese Pharmacopoeia (2020 edition), which can be used for accurate qualitative and quantitative analysis of, and are suitable for the quality control of.
; sinomenine; magnoflorine; OPLS-DA; HPLC fingerprints
R286.2
A
0253 - 2670(2022)05 - 1338 - 07
10.7501/j.issn.0253-2670.2022.05.007
2021-08-09
天津市科技计划项目(20ZYJDJC00090);国家重点研发计划资助项目(2018YFC1707904,2018YFC1707000);正清风痛宁(青风藤)全产业链关键技术研究项目(2020SK1020)
任明军,男,硕士研究生,主要从事中药质量控制技术研究。
通信作者:李文龙,男,副研究员,博士生导师,主要从事中药制药过程分析技术研究。E-mail: wshliwenlong@126.com
[责任编辑 时圣明]

