急性低氧胁迫对黄条鰤抗氧化酶和磷酸酶活性的影响
曹新宇 高铭鸿 杨旭 杨祯 汪忠林 刘欣悦 姜晨


摘要 [目的]探討黄条鰤(Seriola aureovittata)在急性低氧胁迫下的应激响应机制。[方法]将体质量(621.13±63.29)g的黄条鰤置于养殖水槽中,通过药物调节水体中溶解氧含量,使其控制在(2.0±0.2)mg/L内,分别急性低氧胁迫0(对照组)、2、4和6 h,分析其肝脏和肌肉中氧化应激指标的变化。[结果]急性低氧胁迫后,黄条鰤肝脏中总超氧化物歧化酶(T-SOD)活性降低,与胁迫前相比差异显著(P<0.05);过氧化氢酶(CAT)活性与胁迫前相比显著升高(P<0.05);总抗氧化能力(T-AOC)随着胁迫时间的变化呈现先下降后升高的趋势;酸性磷酸酶(ACP)和碱性磷酸酶(AKP)活性都呈现先升高后下降的趋势。急性低氧胁迫后,在黄条鰤肌肉中总抗氧化能力(T-AOC)显著降低(P<0.05),而总超氧化物歧化酶(T-SOD)活性则显著升高(P<0.05)。[结论]急性低氧胁迫会影响鱼体肝脏和肌肉中的抗氧化酶及磷酸酶的活性,在低氧胁迫过程中黄条鰤会通过调节抗氧化酶的活性来激活体内抗氧化防御系统,从而保护机体免受缺氧导致的氧化损伤。
关键词 黄条鰤;低氧胁迫;抗氧化酶;磷酸酶;应激响应机制
中图分类号 S 965.335 文献标识码 A 文章编号 0517-6611(2022)03-0088-04
doi:10.3969/j.issn.0517-6611.2022.03.023
Effects of Acute Hypoxia Stress on the Activities of Antioxidant Enzymes and Phosphatase in Seriola aureovittata
CAO Xin-yu,GAO Ming-hong,YANG Xu et al
(Key Laboratory of Mariculture & Stock Enhancement in North China’s Sea, Ministry of Agriculture and Rural Affairs, Dalian Ocean University, Dalian, Liaoning 116023)
Abstract [Objective] To explore the stress response mechanism of Seriola aureovittata under acute hypoxic stress. [Method] S.aureovittata with the body mass of (621.13±63.29) g was placed in the aquaculture tank, the content of dissolved oxygen in the water was adjusted by drugs. The content of dissolved oxygen in the water was controlled within the range of (2.0±0.2) mg/L for acute hypoxic stress for 0 (control group), 2, 4, and 6 hours, the changes of oxidative stress indices in the liver and muscle of S.aureovittata were analyzed. [Result] After acute hypoxia stress, total superoxide dismutase (T-SOD) activity in the liver of S.aureovittata reduced, which was significantly different from that before the stress (P<0.05). Catalase (CAT) activity in S.aureovittata significantly increased after acute hypoxic stress(P<0.05). Total antioxidant capacity (T-AOC) showed a trend of first decline and then rise with the stress time. The activities of acid phosphatase (ACP) and alkaline phosphatase (AKP) showed an trend of first increase and then decrease. In the muscle of S.aureovittata, the total antioxidant capacity (T-AOC) significantly reduced after acute hypoxic stress (P<0.05), while the total superoxide dismutase (T-SOD) activity significantly increased (P<0.05). [Conclusion] Acute hypoxia stress would affect the antioxidant enzymes and phosphatase activities in the liver and muscle of S.aureovittata. During hypoxia stress process, S.aureovittata would activate the antioxidant defense in the body by regulating the activity of antioxidant enzymes, so as to protect the body from oxidative damage caused by hypoxia.
Key words Seriola aureovittata;Hypoxia stress;Antioxidant enzymes;Phosphatase;Stress response mechanism
基金项目 国家重点研发计划项目(2019YFD0901005)。
作者简介 曹新宇(1997—),男,辽宁大连人,硕士研究生,研究方向:水产养殖。通信作者,副教授,博士,从事水产养殖研究。
收稿日期 2021-06-22
溶解氧是鱼类生存环境中一个重要的环境因子,能够直接或间接影响鱼类的生存、生长发育和代谢[1-2]。近年来,受气候变化和人类活动等因素的影响,水体缺氧问题日益严重,对近岸地区海水养殖造成了巨大的经济损失[3]。研究发现,适宜的溶解氧含量可以促进鱼类的摄食、生长发育和繁殖,但低溶氧的水体会使鱼类正常的呼吸和生理代谢发生紊乱,机体产生大量的活性氧,诱导机体发生细胞凋亡、组织损伤和蛋白质降解等,最终造成氧化损伤[4-6]。为了降低活性氧对机体的损伤,生物体会启动氧化应激响应机制。在低氧环境下,鲫(Carassius auratus)肌肉与鳃组织中超氧化物歧化酶、过氧化氢酶、总抗氧化能力以及总蛋白质量浓度显著升高[7];军曹鱼(Rachycentron canadum)肝脏组织中碱性磷酸酶活性先下降后升高,酸性磷酸酶活性显著上升[8];西伯利亚鲟(Acipenser baerii)血清中丙二醛、总蛋白含量均呈先上升后下降的趋势[9];花鲈(Lateolabrax maculatus)鰓组织中超氧化物歧化酶、过氧化氢酶、谷胱甘肽-S-转移酶活性以及丙二醛含量均出现不同程度的升高[10]。
黄条鰤隶属鲈形目(Perciformes)鲹科(Carangidae)鰤属(Seriola),全球分布范围很广,在我国主要分布于渤海、黄海和东海,在东亚朝鲜半岛、日本、非洲南部、印度、南非海域、印度洋、澳大利亚和美国等均有分布[11]。黄条鰤具有生长速度快、个体大、肉味鲜美、营养丰富等特点,适合网箱养殖[12-13],在国际商品鱼类消费市场上深受消费者的喜爱。近年来,只有部分地区开展了人工养殖,有关养殖黄条鰤生理生化方面的研究较少,国内尚未见到有关黄条鰤受低氧胁迫后抗氧化酶以及磷酸酶活性变化的研究报道。笔者以黄条鰤为试验材料,分析低氧胁迫下的鱼体肝脏和肌肉中的总超氧化物歧化酶、过氧化氢酶、碱性磷酸酶活性以及总抗氧化能力等指标的变化,旨在为进一步研究黄条鰤氧化应激和适应机制提供基础资料。
1 材料与方法
1.1 试验材料
试验用鱼来自大连富谷食品有限公司同一批次繁育的鱼苗,选取外形完整无损伤、活力正常、体长(33.06±1.98)cm 、体质量(621.13±63.29)g 的试验用鱼。
1.2 试验设计
将27尾鱼随机平均分配,暂养在3个200 L(养殖水体约150 L)的水槽中,每日投喂饲料1次,每天早上换水,换水量为养殖水体的1/2。暂养期间水体中溶解氧含量为(7.36±0.25)mg/L,水温为(18.04±0.27)℃。为确定水体中的溶解氧含量,进行了预试验。通过向水体中添加亚硫酸钠来降低水体中的溶解氧含量,使溶解氧含量分别为1.0、2.0和2.5 mg/L。当溶解氧含量为1.0 mg/L时,30 min后黄条鰤就出现侧翻现象,而当溶解氧含量为2.0 mg/L时6 h后试验鱼仍未出现侧翻现象,最终将水体中溶解氧含量定为2.0 mg/L。正式试验前一天停止投喂。试验开始前,完成对照组的取样(每个水槽取3尾鱼),此时水体中的溶解氧含量为(7.06±0.38)mg/L。随后向水体中加入亚硫酸钠,待水体中的溶解氧含量降至2.0 mg/L左右时,调节空气的注入流量来控制水体中的溶解氧含量;分别在2、4和6 h进行鱼体样本取样,每个水槽取2尾,低氧胁迫期间水体中的溶解氧含量为(2.04±0.18)mg/L,水温为(18.16±0.14)℃。整个试验期间,每10 min使用多功能溶氧仪监测1次水体中的溶解氧含量。
1.3 样品采集与保存
将各个时间点的试验鱼体放入MS-222 的水溶液(200 mg/L)中快速麻醉,用滤纸擦净鱼体表面水分后,置于冰板上进行解剖。取鱼体肝脏和肌肉组织放入1.5 mL离心管中,经过液氮预冷后放置在-80 ℃ 冰箱中保存。
1.4 相关指标测定
测定黄条鰤肝脏和肌肉中总超氧化物歧化酶(T-SOD)、过氧化氢酶(CAT)、酸性磷酸酶(ACP)、碱性磷酸酶(AKP)活性以及总抗氧化能力(T-AOC),所用试剂盒均购自南京建成生物工程有限公司,参照说明书进行检测。吸光度使用多功能酶标仪(SpectraMax i3x,USA)进行测定。
1.5 数据处理
利用 SPSS 18.0 统计软件对试验数据进行
单因素方差分析(One-way ANOVA),运用Duncan多重比较
进行差异显著性检验,P<0.05表示差异显著。试验数据均以平均值±标准差表示。
2 结果与分析
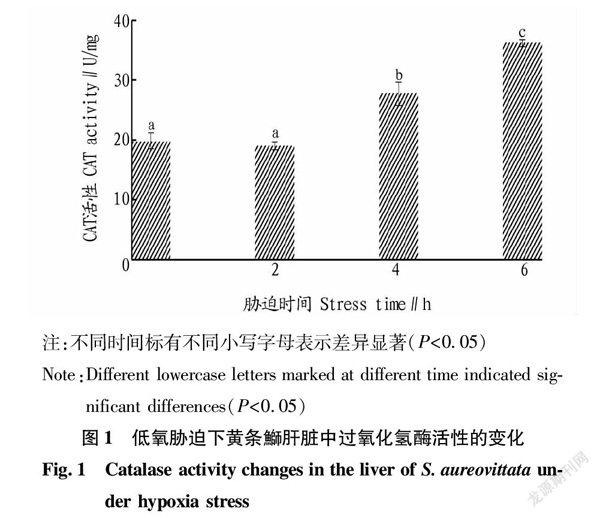
2.1 过氧化氢酶(CAT)活性的变化
从图1可以看出,低氧胁迫后,黄条鰤肝脏中CAT活性在前2 h没有明显变化(P>0.05);胁迫4 h CAT活性较0 h时显著升高(P<0.05);胁迫6 hCAT活性达到最大值,与0 h时相比显著升高(P<0.05)。
2.2 总超氧化物歧化酶(T-SOD)活性的变化
从图2可以看出,黄条鰤肝脏中T-SOD活性随着胁迫时间的增加而减低,胁迫4~6 h与0 h时相比显著降低(P<0.05);在肌肉中,低氧胁迫2 h后T-SOD活性与0 h时相比显著升高(P<0.05),低氧胁迫6 h T-SOD活性达到最大值。
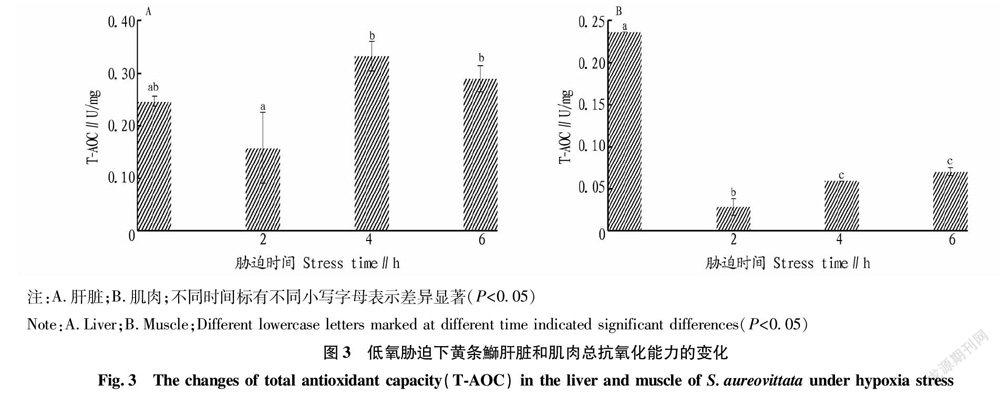
2.3 总抗氧化能力(T-AOC)的变化
从图3可以看出,低氧胁迫后黄条鰤肝脏和肌肉中的总抗氧化能力整体上均呈现先下降后升高的趋势。低氧胁迫2 h后肝脏中总抗氧化能力较0 h时有所降低;低氧胁迫4、6 h肝脏中总抗氧化能力较2 h时有所升高,与0 h时相比无显著差异(P>0.05)。低氧胁迫4、6 h后肌肉中总抗氧化能力较2 h时略有升高,但仍与0 h时差异显著(P<0.05)。
2.4 酸性磷酸酶(ACP)活性的变化
从图4可以看出,黄条鰤肝脏中ACP活性呈现出先升高后降低的变化趋势,低氧胁迫4 h ACP活性达到最大值,低氧胁迫6 h逐渐恢复到初始水平。
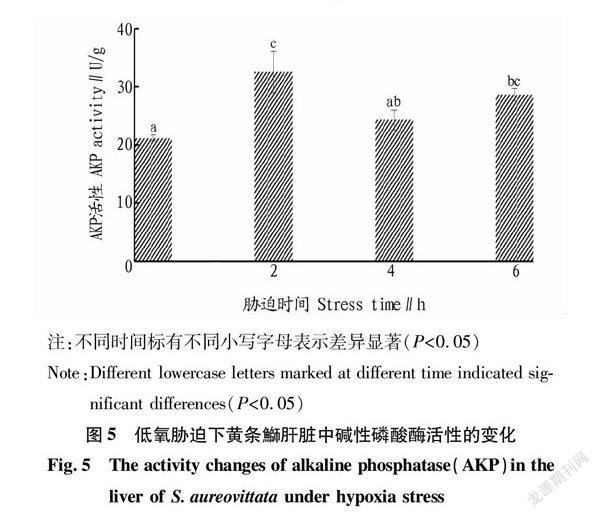
2.5 碱性磷酸酶(AKP)活性的变化
从图5可以看出,随着胁迫时间的增加,黄条鰤肝脏中AKP活性整体上呈现出先升高后降低的变化趋势。低氧胁迫2 h,黄条鰤肝脏中AKP活性达到最大值;低氧胁迫4 h有所降低,与0 h时相比无显著差异(P>0.05);低氧胁迫6 h AKP活性较4 h时略有上升,但与0 h时相比存在显著差异(P<0.05)。
3 讨论
3.1 低氧胁迫对黄条鰤肝脏和肌肉氧化应激的影响
当鱼类处于低氧环境时,有氧呼吸速率下降,活性氧自由基大量增加,细胞内过多的自由基会攻击各种生物膜中所含的不饱和脂肪酸,发生连锁脂质过氧化反应[14-15]。生物机体在长期的进化过程中形成了一套抗氧化保护机制,用来清除多余的自由基,保护细胞免受氧化损伤。超氧化物歧化酶、过氧化氢酶和总抗氧化能力等是鱼体抗氧化机制中重要的组成部分,在机体的氧化与抗氧化平衡中起着重要作用。研究发现,超氧化物歧化酶可以促使超氧阴离子(O2-)歧化为H2O2和H2O,随后过氧化氢酶再将H2O2催化为H2O和O2,因此超氧化物歧化酶和过氧化氢酶可以有效清除机体中过多的自由基,减少机体的氧化损伤[15]。
该试验中低氧胁迫后黄条鰤肝脏T-SOD活性显著低于胁迫前(P<0.05),低氧胁迫2 hCAT活性与胁迫前无显著差异(P>0.05),表明肝脏抗氧化酶系统不能有效清除机体内的自由基,机体出现氧化应激,表明低氧胁迫已对鱼体产生氧化损伤。这与郭志雄等[16]急性低氧胁迫对大规格军曹鱼幼鱼肝脏氧化应激的影响研究结果相一致。该试验中低氧胁迫4 h后黄条鰤肝脏中CAT活性较2 h时显著升高(P<0.05),表明机体为抵抗过多的自由基开始发挥作用。在低氧胁迫过程中,黄条鰤肌肉中T-SOD活性較胁迫前显著升高(P<0.05),这是由于低氧胁迫使机体产生氧化应激,机体通过提高T-SOD活性来消除机体内过多的自由基,减弱机体的氧化损伤。综上所述,黄条鰤在低溶解氧水平时,肝脏的抗氧化能力较低,可能是在低氧状态下鱼体代谢率降低,并通过降低相关抗氧化酶活性来保护肝脏,而此时肌肉却具有较高的抗氧化能力,以保证机体内自由基不会过度积累,这与王晓雯等[17]研究结果相一致。
总抗氧化能力是用来衡量机体抗氧化系统功能状况的综合性指标[18]。该试验中低氧胁迫后黄条鰤肝脏和肌肉中的总抗氧化能力均呈现出先降低后升高的趋势。这表明在应激状态下黄条鰤体内的抗氧化机制发挥作用,保护机体免受氧化损伤。
3.2 低氧胁迫对黄条鰤肝脏和肌肉中磷酸酶活性的影响
碱性磷酸酶广泛分布在鱼体肝脏、肠和鳃等组织中,参与钙、磷代谢,是非常重要的非特异性免疫酶之一,其活性是鱼类自身免疫系统的重要指标之一[19]。酸性磷酸酶广泛分布在机体全身的各种细胞内,是一种在酸性条件下催化磷酸单酯水解生成无机磷酸的水解酶,也是机体重要的非特异性免疫酶[20]。该试验中在低氧胁迫下黄条鰤肝脏中碱性磷酸酶和酸性磷酸酶活性均表现出先升高后降低的趋势,与胁迫前相比差异显著(P<0.05)。当水体中溶解氧含量较低时,鱼体作出应激反应,通过提高AKP和ACP的活性来加强自身的非特异性免疫力。同时,抗氧化酶将体内的自由基转换,以得到更多的氧气维持呼吸,而转化过程中产生的有毒、有害物质可以被AKP 降解,因而AKP和ACP的活性有所升高。马粒雅等[21]对中华乌塘鳢的研究结果与该试验结果相一致。这也与宋芹芹等[22]对凡纳滨对虾低氧胁迫下免疫酶活性的研究结果相一致。
4 结论
该研究分析了黄条鰤在低氧胁迫条件下短期内鱼体肝脏和肌肉中抗氧化酶和磷酸酶的活性变化。结果显示,黄条鰤在低氧胁迫下鱼体肝脏和肌肉中抗氧化酶和磷酸酶活性均发生显著变化,鱼体为保护肝脏,降低总超氧化物歧化酶活性,使得肝脏组织受到一定程度的氧化损伤,而肌肉中总超氧化物歧化酶活性在一定程度上有所提升。肝脏中酸性磷酸酶和碱性磷酸酶的活性变化反映出鱼体的非特异性免疫受到一定程度的影响,但可以通过自身调节来适应外界环境。该试验结果为鱼类低氧胁迫生理学研究提供了基础资料,也为黄条鰤养殖业的健康发展提供理论依据。
参考文献
[1] SUN J L,ZHAO L L,WU H,et al.Acute hypoxia changes the mode of glucose and lipid utilization in the liver of the largemouth bass(Micropterus salmoides)[J/OL].Science of the total environment,2020,713[2021-01-17].https://doi.org/10.1016/j.scitotenv.2019.135157.
[2] 胡国宏,孙广华,朱世成,等.低溶氧量对怀头鲇呼吸代谢耗氧率的影响[J].动物学杂志,2002,37(2):46-48.
[3] 穆景利,靳非,赵化德,等.水体低氧的早期暴露对青鳉(Oryzias latipes)后期的生长、性别比和繁殖能力的影响[J].生态毒理学报,2017,12(2):137-146.
[4] DU S N N,MAHALINGAM S,BOROWIEC B G,et al.Mitochondrial physiology and reactive oxygen species production are altered by hypoxia acclimation in killifish (Fundulus heteroclitus)[J].The journal of experimental biology,2016,219(Pt 8):1130-1138.
[5] THURSTON R V,PHILLIPS G R,RUSSO R C,et al.Increased toxicity of ammonia to rainbow trout(Salmo gairdneri)resulting from reduced concentrations of dissolved oxygen[J].Canadian journal of fisheries and aquatic sciences,1981,38(8):983-988.
[6] 王巧宁,颜天,周名江.近岸和河口低氧成因及其影响的研究进展[J].海洋环境科学,2012,31(5):775-778.
[7] 张倩,黄进强,权金强,等.急性低氧胁迫和复氧对鲫鱼氧化应激的影响[J].水产科学,2020,39(5):649-656.
[8] 王维政,曾泽乾,黄建盛,等.低氧胁迫对军曹鱼幼鱼抗氧化、免疫能力及能量代谢的影响[J].广东海洋大学学报,2020,40(5):12-18.
[9] 陈静怡,王晓雯,朱华,等.不同水温下低氧胁迫对西伯利亚鲟生理状态的影响[J].水产科技情报,2018,45(2):70-76.
[10] 常志成,温海深,张美昭,等.溶解氧水平对花鲈幼鱼氧化应激与能量利用的影响及生理机制[J].中国海洋大学学报(自然科学版),2018,48(7):20-28.
[11] 羅耀明,李多慧,高志鹰,等.黄条鰤养殖技术研究现状与展望[J].河北渔业,2017(10):51-55.
[12] 王波,孙丕喜,董振芳.黄尾鰤的生物学特性与养殖[J].渔业现代化,2005(3):18-20.
[13] 马振华,张殿昌.黄尾鰤繁育理论与养殖技术[M].北京:中国农业出版社,2014.
[14] 李晓美,鲍枳月,吴立新,等.还原型谷胱甘肽对大菱鲆生长及抗氧化能力的影响[J].水产科学,2019,38(3):289-295.
[15] 张克烽,张子平,陈芸,等.动物抗氧化系统中主要抗氧化酶基因的研究进展[J].动物学杂志,2007,42(2):153-160.
[16] 郭志雄,曾泽乾,黄建盛,等.急性低氧胁迫对大规格军曹鱼幼鱼肝脏氧化应激、能量利用及糖代谢的影响[J].广东海洋大学学报,2020,40(3):134-140.
[17] 王晓雯,朱华,胡红霞,等.低氧胁迫对西伯利亚鲟幼鱼生理状态的影响[J].水产科学,2016,35(5):459-465.
[18] MARTNEZ-LVAREZ R M,MORALES A E,SANZ A.Antioxidant defenses in fish:Biotic and abiotic factors[J].Reviews in fish biology and fisheries,2005,15(1/2):75-88.
[19] WAN X,BI J C,GAO X J,et al.Partial enteral nutrition preserves elements of gut barrier function,including innate immunity,intestinal alkaline phosphatase(IAP)level,and intestinal microbiota in mice[J].Nutrients,2015,7(8):6294-6312.
[20] 白玉婷,杨默言,刘新勇,等.非特异性酯酶及酸性和碱性磷酸酶在奥尼罗非鱼消化道的分布[J].动物学杂志,2020,55(3):387-392.
[21] 马粒雅,王闻,迟雯丹,等.溶解氧变化对中华乌塘鳢酶活的影响及其低氧耐受力研究[J].安徽农业科学,2020,48(3):91-94.
[22] 宋芹芹,李玉虎,周海龙.凡纳滨对虾应答低氧-复氧胁迫免疫相关酶活力的时空变化[J].热带生物学报,2015,6(4):353-358.

