基于耐消化肽的核桃主要过敏原Jug r 2的线性表位筛选
郝梦真, 李欣芮, 牟 瑶, 陈 锡, 车会莲
(中国农业大学食品科学与营养工程学院 食品质量与安全北京实验室 北京100083)
树坚果过敏是常见的食物过敏之一, 估计其全球流行率为0.05%至4.9%, 而且流行率还在增加[1]。 据美国国家自报登记处的记录,树坚果尤其是核桃, 是食物过敏导致致命或接近致命反应的主要原因[2]。 Jug r 2 是核桃中的主要过敏原[3],Jug r 2 为7S 球蛋白, 通过BLAST 搜索发现,其蛋白序列不仅与黑核桃中7S 球蛋白过敏原Jug n 2 相似,而且与其它植物来源的7S 球蛋白过敏原相似,例如花生Ara h 1 和大豆Gly m 5[4]。 7S 球蛋白由3 个亚基组成[5],与其它7S 球蛋白相似,一个成熟的Jug r 2 蛋白亚基是由约66 ku 前体蛋白在其第173 个氨基酸位点断裂而形成的, 其分子质量约为44 ku[3]。
食物过敏原线性表位是研究过敏原结构及其致敏性关系的重要方面。 食物过敏原的线性表位可分为T 细胞表位和B 细胞线性表位。 其中T 细胞仅能识别抗原呈递细胞(如树突状细胞)的主要组织相容性复合体分子中出现的抗原衍生肽[6]。由过敏原来源的肽激活2 型CD4+T 细胞是食物过敏反应中的关键步骤,该肽通常至少由13 个连续氨基酸组成[7];过敏原连续氨基酸序列形成的B 细胞线性表位可与特异性IgE 结合, 是食物过敏反应中肥大细胞或嗜碱性粒细胞释放过敏介质的关键触发点[6],该肽通常由8~15 个连续氨基酸组成[8]。目前, 免疫信息学方法是一种预测过敏原B 细胞线性表位的常见高效方法, 该方法利用过敏原的理化性质对抗原的线性表位进行预测, 例如蛋白质局部亲水性、表面可及性、可塑性和抗原性等,这极大程度降低了合成试验成本和时间, 并提示某些连续氨基酸序列具有与IgE 结合的可能[9]。
食物过敏是发生在在胃肠道的免疫反应[10],食物过敏原可通过多种屏障进入机体,例如皮肤、呼吸道、胃肠道,与其它屏障相比胃肠道对食物蛋白的消化作用会造成蛋白质结构的破坏, 从而影响其生物活性, 食物过敏原内在消化稳定性和致敏性之间似乎不存在确定的核心关系[11]。 某些食物过敏原对消化高度敏感, 其消化产物在到达肠道黏膜诱导免疫系统时仍保持足够的结构和大小,可以被抗原呈递细胞摄取[12],这依赖于耐消化肽重组成特定结构和肠道免疫系统对其识别及摄取的能力, 因此食物过敏原在胃肠道的消化情况以及消化产物是影响过敏原致敏潜能的关键因素[13]。 除此之外,在肠道中耐消化肽具有与肠道部位IgE 结合的活性, 从而可能引发过敏反应中的胃肠道症状。 最近的一项研究强调胃肠组织中局部IgE 反应的重要性, 证明了胃肠道组织是产生IgE+B 系细胞的重要募集场所[14]。 评估食物过敏原抗消化肽成为研究食物过敏原在肠道部位致敏性的潜在方法。有研究者[15]对花生过敏原Cupin 家族的Ara h 1 的胃肠道消化产物进行分析, 发现其消化短肽仍具有与特异性IgE 结合和致敏活性,而Ara h 1 与Cupin 家族的其它蛋白相似,极易在胃肠道内被分解, 因此推测食物蛋白的耐消化性并不是其具备免疫原性或免疫反应性的必要条件。目前,在评估食物过敏原的胃肠道保存能力时,大部分研究关注完整蛋白的消化稳定性,很少关注食物过敏原消化肽的稳定性、大小及组成。
本研究的目的是通过将核桃过敏原体外胃肠液模拟消化降解产物, 与已知的线性表位和通过生物信息学预测得到的线性表位进行比较, 并将其定位至模拟Jug r 2 三维结构上,以进一步认识Jug r 2 的结构特点, 旨在为评估核桃过敏原Jug r 2 免疫原性和免疫反应性,以及进一步研究导致食物过敏的过敏原分子结构条件提供试验参考。
1 材料与方法
1.1 材料与试剂
本文所用血清取自6 名对核桃过敏的患者,具有摄食核桃后产生系统性过敏反应的病史,或在医院进行皮肤点刺试验时对核桃产生阳性反应。 研究获得血清提供者的知情同意。
英国核桃购自天津蓟县。 BCA 蛋白定量试剂盒,上海碧云天生物技术有限公司;标准蛋白分子质量Marker,Thermo Fisher 公司; 牛血清白蛋白BAS、生物素标记的山羊抗人IgE 抗体、胃蛋白酶P7000、 胰蛋白酶P3292,Sigma 公司;HRP 标记链霉亲和素,Thermo Scientific 公司;HRP-TMB 显色试 剂 盒,Millipore 公 司;0.22 μm 硝酸纤维薄膜,Whatman 公司。
1.2 仪器与设备
电子天平,瑞安市英衡电器有限公司;多功能酶标仪,Thermo Scientific 公司;DYY-7C 型电泳仪,北京市六一仪器厂;Geno Sens 1850 凝胶成像分析系统、ChemiScope 3300 mini 化学发光成像系统, 上海勤翔科学仪器有限公司;JB-3 磁力搅拌器, 上海富磁新径仪器有限公司;TGL-16M 台式高速冷冻离心机,广州广一科学仪器有限公司;生化培养箱,宁波莱福科技有限公司;数显圆周摇床,Scilogex 公司; CC-K6 加热制冷型恒温水浴锅,德国Huber 公司;漩涡混合器,海门市其林贝尔仪器制造有限公司。
1.3 方法
1.3.1 核桃粗蛋白的浸提 按姜松松等[16]的方法提取核桃中的粗蛋白。将核桃剥壳,去除核桃外硬壳并去皮,打碎成细粉末。 称取10 g 所得核桃粉,加入100 mL 正己烷溶液, 于4 ℃磁力搅拌脱脂2 h,然后于4 ℃、8 000×g 离心30 min,弃上清,将所得沉淀再经过上述方法重复脱脂2 次, 于通风橱内将沉淀部分充分晾干,得到脱脂核桃粉末。将脱脂核桃粉于PBS 缓冲液(0.1 mol/L)按质量∶体积比1∶10 进行混合, 于4 ℃环境中使用磁力搅拌器搅拌12 h,然后于4 ℃、10 000×g 离心20 min,取上清,-80 ℃保存备用。
1.3.2 免疫印迹 按照Downs 等[17]的方法进行血清IgE 识别核桃过敏原的免疫印迹试验。 对蛋白粗提物进行SDS-PAGE 电泳后,在80 V 恒压下电转2 h,将蛋白条带印迹到硝酸纤维薄膜(NC)上。使用封闭液(5% BSA-TBST)室温封闭1 h 后,加入用稀释液(5% BSA-TBST)以1∶10 比例稀释的过敏患者混合血清作为一抗在4 ℃下孵育过夜。用TBST 洗涤6 次后,加入1∶8 000 稀释的生物素标记山羊抗人IgE 抗体作为二抗室温孵育1 h。 用TBST 洗涤6 次后,加入1∶500 稀释的HPR 标记链霉亲和素作为三抗孵育1 h。TBST 洗涤后,使用化学发光底物显色,成像系统拍照。
1.3.3 免疫信息学预测Jug r 2B 细胞线性表位使用免疫信息软件DNAStar Protean 系统和ABCpred 在线工具,预测Jug r 2 的线性表位。
在DNAStar Protean 系统中,以氨基酸序列的亲水性、柔韧性、可达性和抗原性4 种性质作为表位预测的参数。 亲水性、柔韧性、表面可及性和抗原性的预测分别按照Kyte 等[18]、Karplus 等[19]、Emini 等[20]和Jameson 等[21]的方法进行。基于以上的方法,用DNAStar 预测了具有合适的亲水性、高柔韧性、 表面可及性和高抗原性的肽段为线性表位。BPAP 系统和BepiPred 1.0 服务器是基于氨基酸的亲水性、柔韧性、接触性、转角和表面暴露等理化性质来预测线性表位的。
1.3.4 体外模拟胃液消化 模拟胃液和肠液由Toomer 等[22]所述制备,并进行了一些调整。模拟胃液: 在100 mL ddH2O 中溶解131.6 mg 胃蛋白酶和0.2 g NaCl,用HCl 调节pH 值至1.2,胃蛋白酶的活性≥2 000 U/mg。模拟肠液:在100 mL ddH2O中溶解1 g 胰蛋白酶和0.7 g KH2PO4,用NaOH 调整pH 值至7.5,胰蛋白酶的活性需要满足如下条件:在40 ℃、pH 7.5 时,60 min 内胰蛋白酶水解酪蛋白质量是胰蛋白酶质量的25 倍。 参照Guo 等[23]的方法进行体外胃肠消化试验。
1.3.5 Jug r 2 抗消化肽序列分析 利用纳米级的HPLC 系统Easy-nLC 1000 对Jug r 2 消化产物进行分析。流动相:0.1%甲酸水溶液(A)和0.1%甲酸乙腈溶液(B)。用95%的A 液平衡色谱柱。样品通过自动取样器加载到柱前C18 柱(3 mm,0.10 mm×20 mm),然后用C18 分析柱分离(1.9 mm,0.15 mm×120 mm),流速600 nL/min。 用毛细管高效液相色谱对样品进行分离, 用Q-Exactive 质谱仪对样品进行裂解。
使用PFind 2.6 软件对通过串联质谱分析得到的Jug r 2 消化产物序列进行鉴定,该过程数据库检索。 数据库检索参数如下:胃蛋白酶或胰酶;漏切位点:2;固定修饰:酰甲基化修饰(C);可变修饰:乙酰化(N)、谷氨酰胺修饰为焦谷酰酸(N 段)、氧化(M);前体质量偏差:±1.5 u;碎片质量偏差:±0.5 u;肽段可信度:高;肽段长度:>4;肽段FDR:≤0.01。
1.3.6 Jug r 2 的同源建模 在Protine Data Bank,使用BLAST 来搜索一个已知的蛋白质作为模板[24]。这个模板应该与Jug r 2 具有高度的序列同源性。 因此, 推测Car i 2 与Jug r 2 约有91.65%的一致性。 利用7S 球蛋白的SWISSMODEL 网站中的比对模式作为模板,建立了较为准确的三维模型[25]。 通过分子动力学模拟和能量最小化,得到了Jug r 2 的三维模型。 利用可视化软件RasMol 查看Jug r 2 预测B 细胞线性表位和抗消化肽段在三维结构中的位置。
2 结果与分析
2.1 核桃主要过敏原Jug r 2 的B 细胞线性表位的生物信息学预测
DNAStar Protean 系统是基于表面可及性、柔韧性和氨基酸亲水性对线性表位进行预测。 如图1 所示, 表面可及和柔韧区域出现频率增高说明这些区域在Jug r 2 中是柔软的且易拉伸的,容易暴露在蛋白质表面。 完整序列中的高抗原指数区域具有形成线性表位的高度倾向。如表1 所示,根据这些性质,使用DNAStar 软件分析最终得到Jug r 2 的8 个潜在B 细胞线性表位。
之后利用了ABCpred 在线工具对Jug r 2 的B 细胞线性表位进行预测,阈值设置为0.8,其结果如表1 所示。 两种工具所预测的B 细胞线性表位存在很多重叠的部分, 以两种工具预测的线性表位作为最终结果,不考虑存在争议的结果。如表1 所示,最终通过两种生物信息学预测得到8 条B细胞线性表位, 分别为AA186~199、AA226~230、AA257 ~263、AA284 ~289、AA373 ~382、AA389 ~398、AA408~414、AA472~487。 利用DNAStar 联合ABCpred 预测得到的Jug r 2 的8 条B 细胞线性表位在Jug r 2 模拟三维模型中的定位。如图2 所示,预测得到的8 条线性表位均位于Jug r 2 表面的β 折叠、转角和无规卷曲处,这些区域的可变程度更大,可能具有更强的IgE 结合活性。

表1 DNAStar 和ABCpred 两种免疫信息学工具预测的B 细胞线性表位Table 1 B cell linear epitopes predicted by two immunoinformatics tools of DNAStar and ABCpred
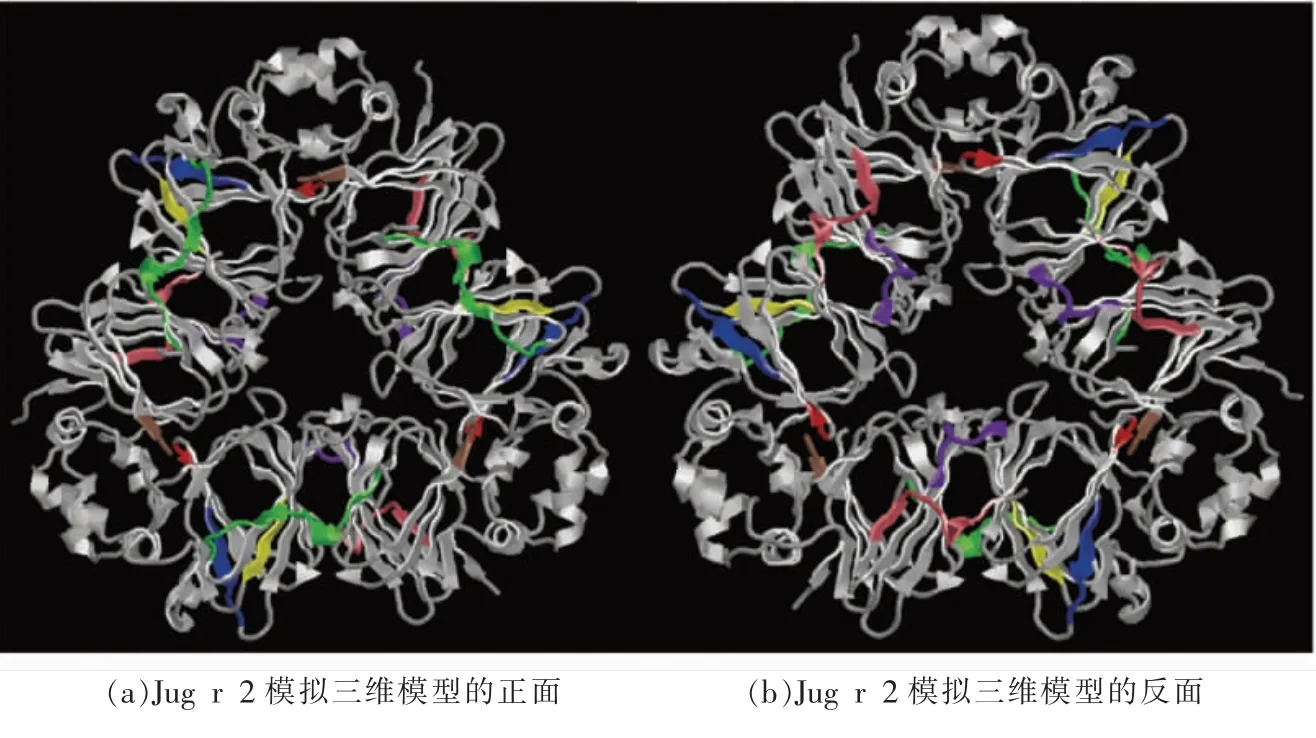
图2 两种免疫信息学预测得到的B 细胞线性表位在Jug r 2 模拟三维结构上的定位Fig.2 Location of B cells linear epitopes analyzed by two combined immunoinformatics tools in the tertiary structure of Jug r 2
2.2 核桃蛋白粗提物的SDS-PAGE 的电泳分析
核桃蛋白粗提物的SDS-PAGE 电泳结果如图3 所示。 核桃总蛋白在17 ku 和10 ku 处有明显的条带, 经灰度值分析分别占总蛋白含量的28%和26%,其中分子质量为17 ku 的蛋白质对应于核桃中另一主要过敏原Jug r 1。 分子质量为10 ku 左右的蛋白条带对应于7S 球蛋白Jug r 2 前体蛋白翻译后修饰所切除的6~9 ku 小亲水性肽段[3]。 该肽段经过质谱鉴定确实为Jug r 2 的产物。成熟的Jug r 2 单亚基分子质量位于44 ku 处, 占总蛋白含量的16%,此证明了本次核桃中过敏原Jug r 2提取成功。 提取的总蛋白经过BCA 试剂盒测定其质量浓度为20.66 mg/mL。
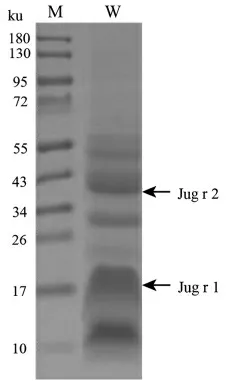
图3 核桃总蛋白电泳分析Fig.3 SDS-PAGE electrophoresis analysis of walnut proteins
2.3 核桃蛋白粗提物与核桃过敏患者血清池IgE结合情况
使用6 名核桃过敏患者血清建立血清池,通过免疫印迹试验检测其中与血清IgE 结合的主要的核桃过敏原。 如图4 所示,患者血清池与44 ku处的Jug r 2 有明显的结合,强度显著高于其它蛋白质。
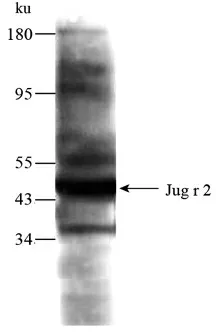
图4 核桃蛋白粗提物的免疫印迹分析Fig.4 Western blot analysis of walnut proteins crude extracts
2.4 核桃蛋白粗提物抗胃蛋白酶和胰蛋白酶消化肽段的质谱分析
将核桃蛋白粗提物经胃蛋白酶或胰蛋白酶消化60 min 后的产物进行HPLC-MS/MS 检测以确定属于过敏原Jug r 2 的抗消化肽段。核桃蛋白粗提物经过60 min 的胃蛋白酶消化后, 经HPLCMS/MS 检测共产生了4 953 个二级质谱。 根据Uniprot 数据库提供的核桃过敏原氨基酸序列构建检索数据库,使用pFind 软件搜索,鉴定出来源于Jug r 2 的4 条肽段 (如表2 所示), 覆盖其11%的氨基酸序列。 核桃蛋白粗提物经过60 min的胰蛋白酶消化后,经HPLC-MS/MS 检测共产生了6 493 个二级质谱,据Uniprot 数据库提供的核桃过敏原氨基酸序列构建检索数据库,使用pFind软件搜索,鉴定出来源于Jug r 2 的13 条肽段(如表3 所示),覆盖其46%的氨基酸序列。
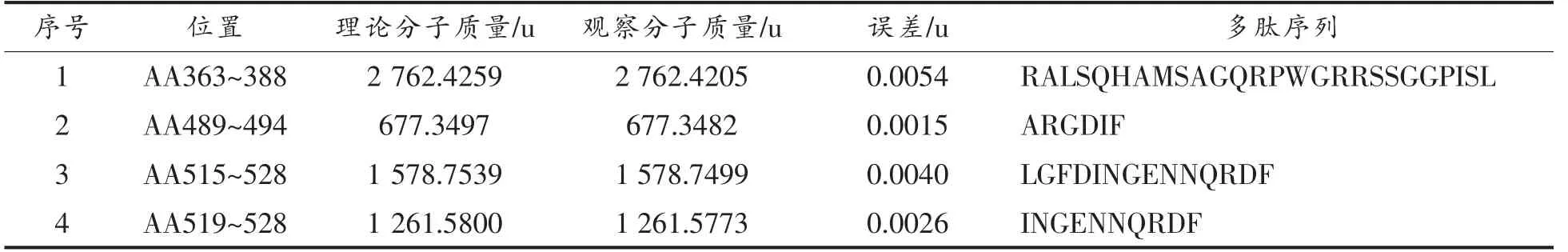
表2 胃蛋白酶消化质谱与Jug r 2 匹配的肽段Table 2 Peptide matched with Jug r 2 by pepsin digestion through mass spectrometry
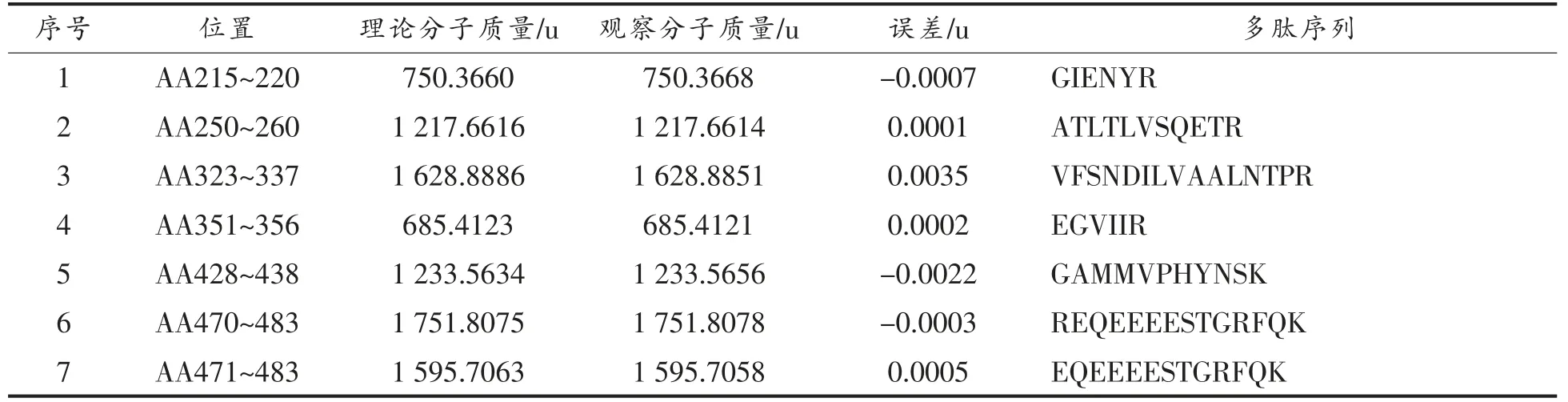
表3 胰蛋白酶消化质谱与Jug r 2 匹配的肽段Table 3 Peptide matched with Jug r 2 by trpsin digestion through mass spectrometry
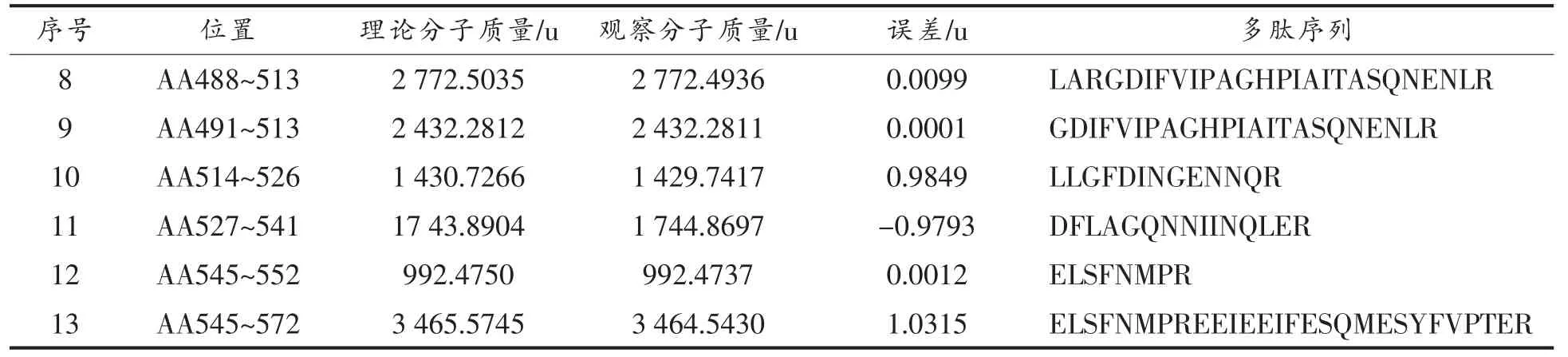
(续表3)
2.5 抗消化肽在Jug r 2 一级序列和三维结构上的分布情况
为了进一步观察这些抗消化肽在过敏原Jug r 2 一级序列上的分布情况,从NCBI 数据库中获取了Jug r 2 的序列。 如图5 所示,这些抗消化肽段主要分布于Jug r 2 的C 端区域, 覆盖了AA428~572 位点,约占74%的序列。 其中,经胃蛋白酶消化后,在AA515~528 处产生了两条重叠肽段 (3 号和4 号), 经胰蛋白酶消化后分别在AA470~483 (6 号和7 号)、AA488~513 (8 号和9号)和AA545~572(12 号和13 号)处产生重叠肽段,证明了这些区域具有较强的抗消化性。相比胃蛋白酶,Jug r 2 经过胰蛋白酶消化可获取更多的肽段, 这可以提高耐消化肽预测B 细胞线性表位的效率。 值得注意的是抗胃蛋白酶消化肽段与8~11 号抗胰蛋白酶消化肽段存在重合区域,进一步说明Jug r 2 经过连续的胃肠道主要消化酶的消化, 肽段AA494~513、AA515~526、AA519~528 可以得以保留。最终筛选得到11 条抗消化的非重叠肽段, 分别为AA215~220,AA250~260,AA323~337,AA351~356,AA363~388,AA428~438,AA470~483,AA488~513,AA514~526,AA527~541,AA545~572。11 条抗消化肽段在Jug r 2 模拟三维模型中的定位如图6 所示,11 条抗消化肽段中有2 条仅位于α 螺旋处,2 条同时存在α 螺旋和转角结构,3 条同时存在β 折叠和转角结构,2 条位于无规卷曲处。 相比预测得到的8 条B 细胞线性表位的定位特点,11 条抗消化肽段中出现了更多的α 螺旋结构, 尽管α 螺旋的结构可能会降低与IgE 结合能力[23],然而11 条抗消化肽段所处的α 螺旋均处于Jug r 2 表面, 并且部分消化肽段同时位于α螺旋和转角处, 即认为这些抗消化肽段可能位于α 螺旋的连接处。 按照Ktye 等[18]的原则,对11 条抗消化肽段在Jug r 2 中的疏水性分析如图7 所示, 本研究发现11 条抗消化肽段处于Jug r 2 亲水性区域的比例较高。李平等[26]对Cupin 家族的食物过敏原的B 细胞线性表位的特点进行总结,发现其B 细胞线性表位具有处于高度暴露于溶剂的区域;含有亲水性侧链;有一定的柔韧性的3 个特点。在本研究中所得到的11 条抗消化肽段均位于Jug r 2 的表面,亲水性良好,且这些肽段所处转角和无规卷曲结构具有可变性, 会提高其与IgE的结合活性。

图5 抗消化肽段在Jug r 2 氨基酸序列中的定位Fig.5 Positioning of anti-digestive peptides in Jug r 2 amino acid sequences
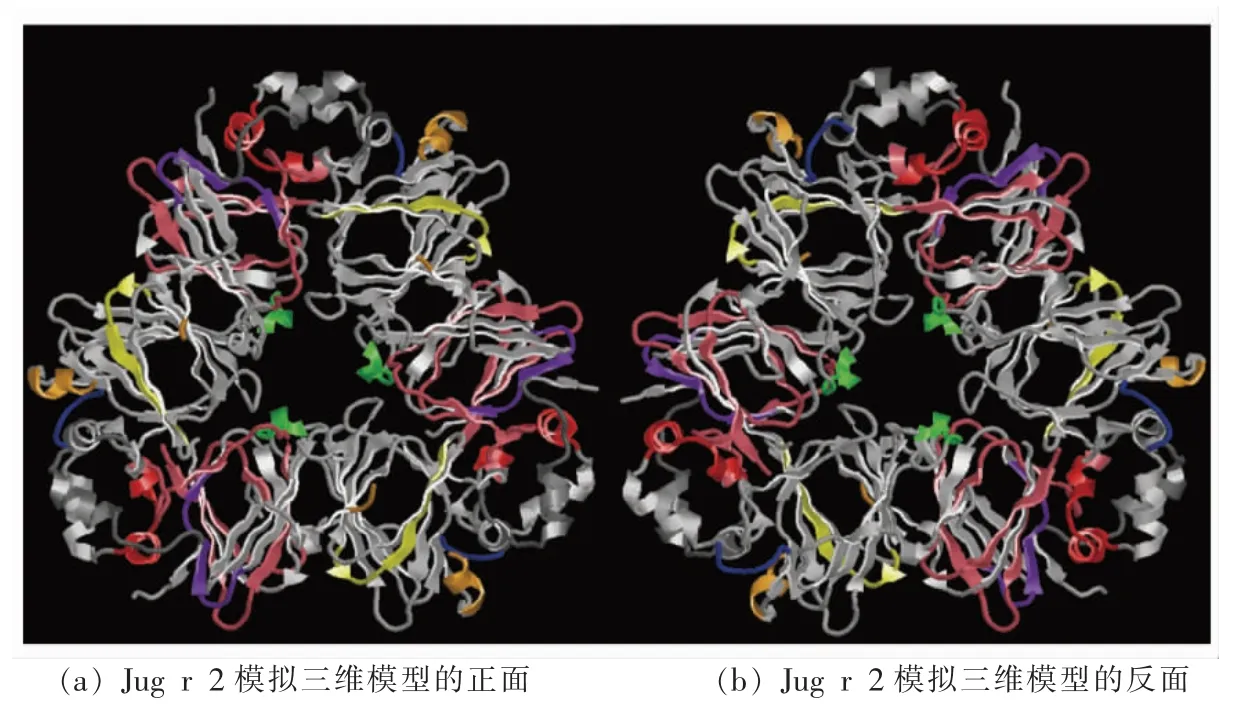
图6 11 条抗消化肽段在Jug r 2 模拟三维结构上的定位Fig.6 Location of 11 digestion-resistant peptides in the tertiary structure of Jug r 2
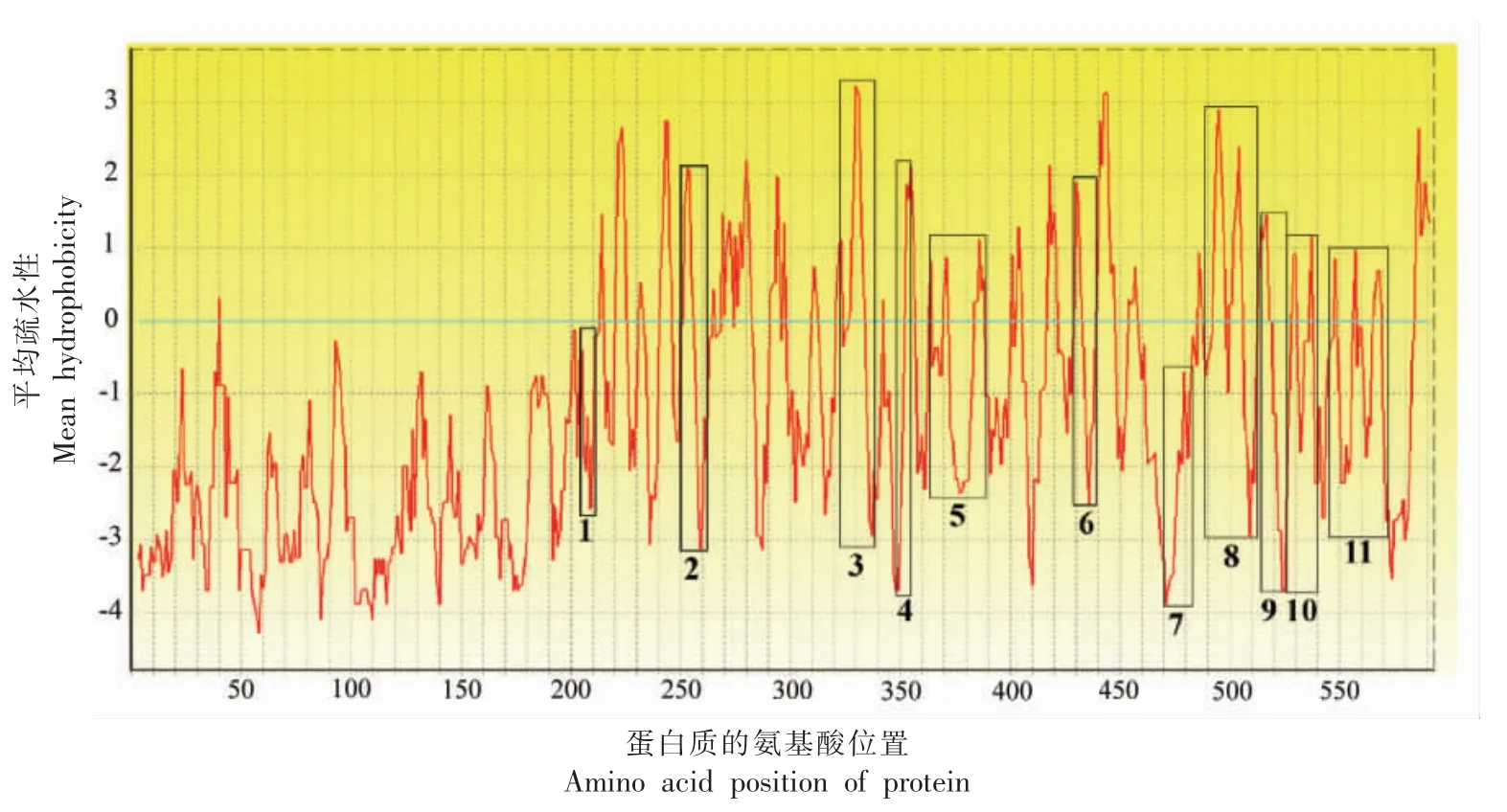
图7 11 条抗消化肽段的疏水分析Fig.7 Hydrophobicity analysis of 11 anti-digestible peptides
2.6 Jug r 2 抗消化肽段与Jug r 2 线性表位重合程度分析
胞 线 性 表 位[27],在AA250 ~260、AA363 ~388 和AA470~483 位置的抗消化肽均与预测的线性表位存在部分氨基酸序列的交叉, 说明B 细胞线性表位可能具有一定的抗消化性。 除此之外,在
如图8 所示,Jug r 2 的抗消化肽段在蛋白质全序列的AA545~572 位置附近含有已知的B 细AA215 ~220、AA250 ~260、AA323 ~337、AA363 ~388、AA428~438、AA470~483、AA545~572 位置的抗消化肽段与已知的T 细胞表位交叉,核桃Jug r 2 的T 细胞表位可能是诱导核桃过敏患者外周血T 细胞向Th2 中枢记忆表型分化的因素[28],Th2 细胞驱动IgE 类转换和过敏效应细胞的扩大是引发过敏反应的关键环节[29]。

图8 抗消化肽段和预测表位在Jug r 2 氨基酸序列中的定位Fig.8 Position of anti-digestive peptides and predicted epitopes in amino acid sequence of Jug r 2
食物过敏原进入机体的主要途径是消化道黏膜表面, 过敏原在消化道内所具有的特定分子特性与肠道驻留免疫细胞相互作用所必需的, 这些特定分子特性包括食物过敏原的消化特性[30]。 某些食物过敏原经过模拟胃肠道消化后形成的蛋白片段仍保持与IgE 结合活性,例如花生过敏原Ara h 1[15]、Ara h 3[31]和猕猴桃蛋白[32]。 在本研究中同样也发现了核桃主要过敏原Jug r 2 的抗胃蛋白酶和胰蛋白酶消化短肽, 与预测和实际得到的B细胞线性表位存在重叠,因此Jug r 2 抗消化肽段成为筛选B 细胞线性表位的方法。 除此之外,Jug r 的抗消化肽段与实际T 细胞表位存在重叠,这进一步指出胃肠道消化对核桃主要过敏原Jug r 2 消化后引起肠道黏膜免疫细胞反应的作用机制可能与抗消化肽段有关。
本研究中核桃蛋白所处的体外消化环境较为简单, 所采用的体外胃肠模拟消化并不能完全反映核桃蛋白在核桃整个食物基质中的消化行为,特别是由于肠道不同部位发挥作用的消化酶种类的不同[33],可能导致该研究结果具有一定的局限性。 除此之外,核桃主要过敏原Jug r 2 抗消化肽是否具有与IgE 结合能力仍需更多的核桃过敏患者血清来进一步验证。
3 结论
尽管固相肽合成法是研究Jug r 2 线性表位的金方法,但是由于合成成本高且盲目性大,因此目前寻找相关辅助方法以提高Jug r 2 线性表位的识别效率是重要的研究方向。 本研究发现了Jug r 2 抗消化肽段具有B 细胞线性表位所具备的亲水性和柔韧性的特点, 并且通过一级序列和三维定位分析发现了Jug r 2 抗消化肽段与预测和真实的B 细胞线性表位以及T 细胞线性表位重叠。基于Jug r 2 抗消化肽段的一级序列和三维定位的分析可能是预测Jug r 2 线性表位的有效策略,并且本研究也有助于研究核桃主要过敏原Jug r 2 在胃肠道致敏机制。

