赤芍总苷对肺癌大鼠肺组织的作用机制
辜正策 邓小婧 李璐池


摘要 目的:研究赤芍總苷对肺癌大鼠肺组织的作用机制。方法:将大鼠分为正常组、模型组和赤芍总苷组,观察3组大鼠体质量的变化情况,比较3组大鼠肺指数和肺组织形态变化,及大鼠肺组织中存活素(Survivin)、鼠类肉瘤病毒癌基因(KRAS)表达及mRNA的表达。结果:在同一时间点,3组大鼠的体质量比较差异无统计学意义(P<0.05)。对3组大鼠的体质量增长幅度比较,赤芍总苷组大鼠显著高于模型组,并且赤芍总苷组大鼠的末期体质量也显著重于模型组大鼠,差异有统计学意义(P<0.05)。与正常组大鼠肺指数比较,模型组显著升高(P<0.05),同时肺组织出现了明显的恶化;与模型组比较,赤芍总苷组大鼠的肺指数显著降低(P<0.05),并且肺组织得到了显著的改善(P<0.05)。3组大鼠的Survivin和Kras比较,模型组阳性表达显著增多,mRNA表达也显著高于正常组(P<0.05);赤芍总苷组大鼠的阳性表达和mRNA表达都显著低于模型组(P<0.05)。结论:赤芍总苷可有效抑制肺癌大鼠肺组织中Survivin和KRAS基因的表达,同时抑制微血管的生成。
关键词 赤芍总苷;肺癌;肺组织;肺指数;存活素;鼠类肉瘤病毒癌基因;微血管生成;阳性表达
Mechanism of Action of Total Glucosides of Paeony on Lung Tissue of Lung Cancer Rats
GU Zhengce,DENG Xiaojing,LI Luchi
(Department of Pathology,Meishan Hospital of Traditional Chinese Medicine,Meishan 620010,China)
Abstract Objective:To study the mechanism of total glucosides of paeony(TGP) on lung tissue of rats with lung cancer.Methods:The rats were divided into a normal group,a model group and a total paeony glycosides group.The body mass changes of the 3 groups were observed.The lung index and lung tissue morphology changes of the three groups were compared,and the survivin in the lung tissue of the rats was compared(Survivin),Kirsten rat sarcoma viral oncogene(KRAS) expression and mRNA expression.Results:There was no significant difference in the weight of the 3 groups at the same time(P<0.05).Compared with the three groups of rats,the weight gain of TGP group was significantly higher than that of model group,and the final weight of TGP group was also significantly heavier than that of model group(P<0.05).Compared with the normal group,the lung index of the model group increased significantly(P<0.05),and the lung tissue deteriorated significantly; compared with the model group,the lung index of the TGP group decreased significantly(P<0.05),and the lung tissue improved significantly(P<0.05).The positive expression of Survivin and KRAS in the model group was significantly increased in the three groups,and the mRNA expression in the group was significantly higher than that in the normal group(P<0.05); the positive expression and mRNA expression in the TGP group were significantly lower than that in the model group(P<0.05).Conclusion:TGP can effectively inhibit the expression of Survivin and KRAS genes in lung tissue of lung cancer rats,and inhibit the angiogenesis.
Keywords TGP; Lung cancer; Lung tissue; Lung index; Survivin; KRAS; Angiogenesis; Positive expression
中图分类号:R979.1;R734.2文献标识码:Adoi:10.3969/j.issn.1673-7202.2022.02.006
在所有的惡性肿瘤中肺癌最为常见,并且其死亡率比其他恶性肿瘤高,患者的预后情况比其他恶性肿瘤差,通常肺癌患者5年生存率较低[1]。肺癌通常分为2种类型:小细胞肺癌和非小细胞肺癌。非小细胞肺癌的发病率显著高于小细胞肺癌。在临床上通常采用手术治疗肺癌,但手术的时机非常重要,当患者被确诊为肺癌时基本都是肺癌的晚期,所以对肺癌晚期的患者来说药物治疗成为了最重要的手段[2]。芍药和川芍药干燥的根为赤芍,可有效抑制疼痛,同时还有清热凉血的功效。赤芍总苷既能降低癌细胞基因的表达,还能抑制耐药蛋白的合成,但其在肺癌中的具体作用目前尚无定论[3-4]。近年来新发现凋亡抑制蛋白Survivin在胚胎组织中大量地表达,但并未在人的终末分化组织中发现,并且其会重新地表达于各种肿瘤组织中[5]。Ras癌基因家族包括多种癌基因,其中鼠类肉瘤病毒癌基因(Kirsten Rat Sarcoma Viral Oncogene,KRAS)的突变介导着肿瘤的发生发展[6]。突变的KRAS会让Ras基因产物p21(rasP21)蛋白持续性地激活,对靶分子进行一定的刺激,从而使细胞持续增殖,发生恶化[7]。Ponz-Sarvise等[8]研究表明,KRAS点突变的非小细胞肺癌(NSCLC)患者预后不佳。这些研究提示KRAS的突变及表达对会引发癌细胞的持续增殖和迁移等,进而导致肿瘤的发生,可用于NSCLC的诊治以及预后评估。在肿瘤发生、发展和转移的过程中,微血管生长是最为关键的环节,其中微血管密度(MVD)是对恶性肿瘤发展和转移评估的关键指标[9-10]。本研究主要探讨赤芍总苷对肺癌大鼠肺组织Suivivin和KRAS的表达的影响,并探讨其对肺癌大鼠微血管生成的作用机制。
1 材料与方法
1.1 材料
1.1.1 动物
15周龄SD大鼠共30只,体质量220~250 g,均购买自新疆医科大学第一附属医院实验动物中心,许可证号:SCXK(新)2011-0004。将大鼠饲养在温度为35~40 ℃,湿度为50%~60%的动物房内统一饲养1周,普通饲料饲养,所有大鼠正常摄食饮水,对新的环境让大鼠进行适应。动物实验方法符合动物伦理学要求(伦理审批号:20120220005)。
1.1.2 药物 赤芍总苷(南京希元生物医药科技有限公司,批号:0736-20015)
1.1.3 试剂与仪器 Suivivin和KRAS试剂盒(武汉博士德生物公司,货号:ADxKR01);Trizol试剂盒厂家(浙江简石生物技术有限公司,货号:TR205-50);HE染色试剂盒(厦门艾德生物医药科技有限公司,货号:C0105S);石蜡切片机(QIAGEN公司,德国,型号:HY-1508);台式低温超速离心机(Sigma公司,美国,型号:TGL-18M);荧光显微镜(北京测维光电仪器厂,型号:LW600LT);脱水机(徕卡公司,德国,型号MWF77J型);-80 ℃低温冰箱(三洋公司,日本,型号:DW-86L728J)。
1.2 方法
1.2.1 动物分组和模型建立 将大鼠分为正常组、模型组与赤芍总苷组3组,每组10只。其中正常组大鼠不做任何处理;模型组为非小细胞肺癌大鼠模型;赤芍总苷组为非小细胞肺癌大鼠模型加赤芍总苷干预观察组。把模型组大鼠和赤芍总苷组大鼠制备肺癌模型,均采用左肺支气管内一次性灌注法,当发现肺内出现碘油时,即为肺癌模型制备成功。
1.2.2 给药方法 造模成功后,正常组和模型组大鼠均经背静脉注射等体积的生理盐水;赤芍总苷组大鼠经同样的位置注射240 mg/kg的赤芍总苷溶液。所有药物均在周一至周五对大鼠进行注射,连续注射16周。
1.2.3 收集指标 给药16周后,处死大鼠,取两侧肺组织,称量体质量,并置于-80 ℃的冰箱中保存待用。
1.2.4 大鼠体质量的测定 分别测量并比较给药后4周、12周和16周大鼠的体质量。
1.2.5 大鼠肺指数的测定 分别断头处死3组大鼠,取出大鼠的双侧肺组织,称取其总质量,计算大鼠的肺指数。
1.2.6 肺组织病理形态观察 取大鼠肺组织固定于甲醛溶液中,24 h后对大鼠的肺组织进行切片处理,保证切片的厚度为4 μm,脱蜡后进行HE染色并观察。
1.2.7 微血管密度(MVD)计算 首先用100倍光镜扫描整个切片,寻找高血管密度区,然后用400倍光镜对该区域进行观察,取5个清晰的视野,分别计算视野的微血管数量,微血管密度是微血管数的平均值。
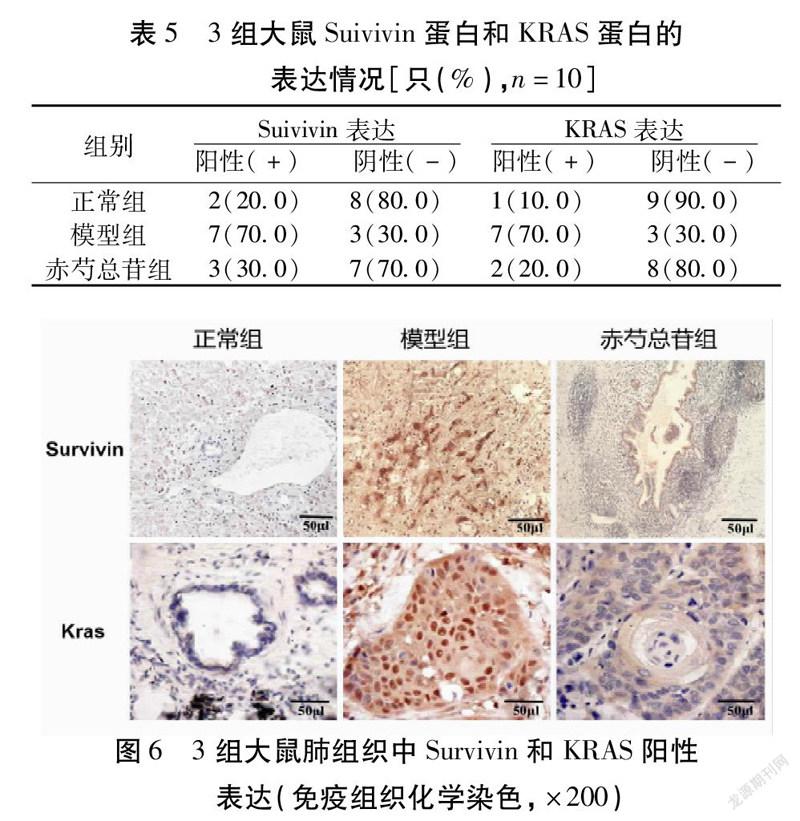
1.2.8 免疫组织化学(SP)检测Survivin和KRAS的表达 把正常组、模型组和赤芍总苷组大鼠的肺组织用甲醛钠溶液浸泡,染色步骤参照说明书。阳性判定:每组大鼠的阳性细胞数量和细胞的染色程度的评分相加。每张肺组织切片取10个清晰的视野用光镜进行观察。染色0分为无染色,染色1分为轻度,染色2分为深度。观察阳性细胞数,当小于10%时记为0分,得1分为阳性细胞在10%~25%区间,得2分为阳性细胞所占比在26%~50%区间,得3分为阳性细胞所占比在51%~75%区间,得4分为阳性细胞所占比在75%以上。把每组细胞的2个得分相加为判定最后阳性细胞的分数,当总得分小于2时为阴性,当得分大于等于3时为阳性。
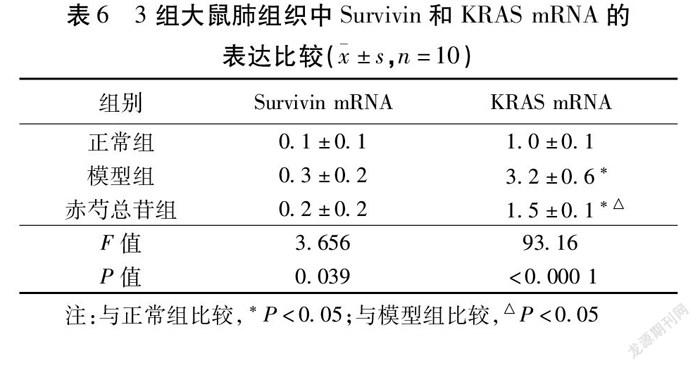
1.2.9 qRT-PCR检测肺组织Survivin和KRAS mRNA的表达 分别取出3组大鼠的肺组织,用Trizol进行裂解并提取总的DNA,所有的逆转录反应按照说明书进行,对所得的cDNA进行荧光实验。严格按照反应的条件进行扩增,变性3 min 94 ℃,变性10 s 95 ℃,退火7 min 72 ℃,一共35个循环。取平均值后得到Ct值,计算方法用2-△△Ct法。见表1。
1.3 统计学方法 采用SPSS 19.0统计软件对3组大鼠的体质量、肺指数、肺组织病理变化和MVD进行分析比较,并对3组大鼠的Survivin、KRAS和VEGF的表达进行检测,用t检验比较2组数据,用单因素分析法对3组数据进行分析,计算采用均数±标准差(±s)表示,以P<0.05为差异有统计学意义。
2 结果
2.1 3组大鼠的体质量比较 随着时间的增加,3组大鼠的体质量也逐渐地增长,但在初始体质量、给药4周、12周内,3组大鼠的体质量没有显著的变化(P>0.05)。见表2。给药16周后,模型组大鼠体质量显著低于正常组;赤芍总苷组大鼠体质量明显高于模型组(P<0.05)。见图1。
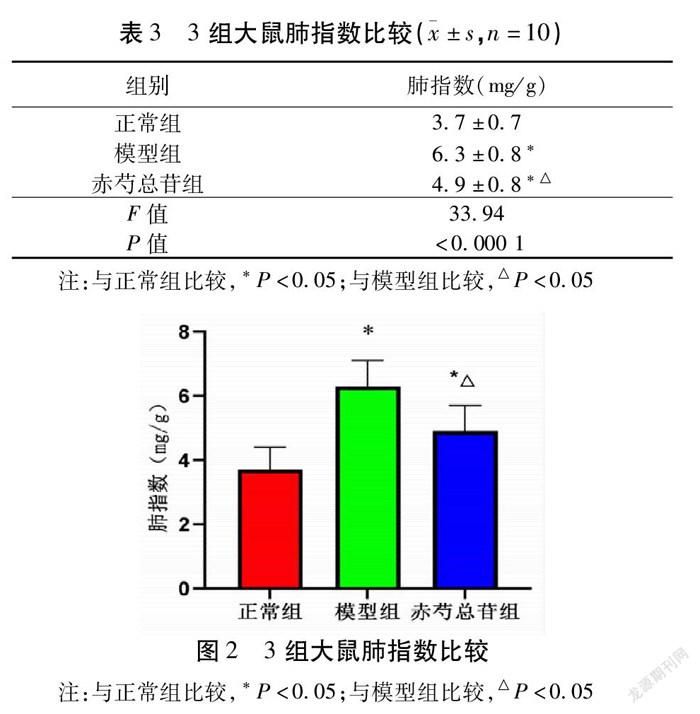
2.2 3组大鼠肺指数比较 与正常组大鼠的肺指数比较,模型组显著升高(P<0.05);与模型组比较,赤芍总苷组大鼠的肺指数显著降低(P<0.05)。见表3,图2。
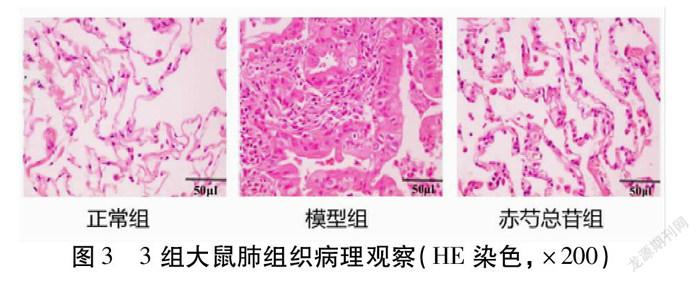
2.3 3组大鼠肺组织病理形态比较 模型组大鼠的肺组织较正常组肺组织体积明显变大,肺泡囊也顯著扩张,并且模型组的纤毛上皮细胞也损伤严重;干预后的赤芍总苷组大鼠肺组织明显好转。见图3。
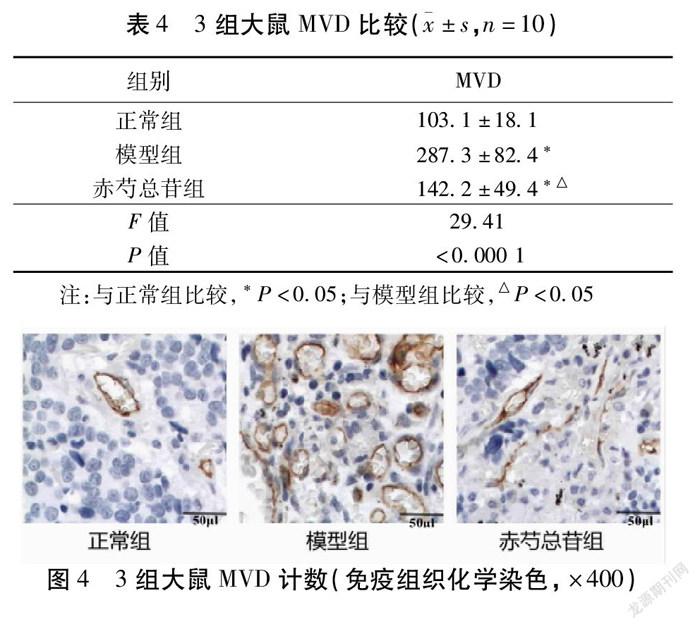
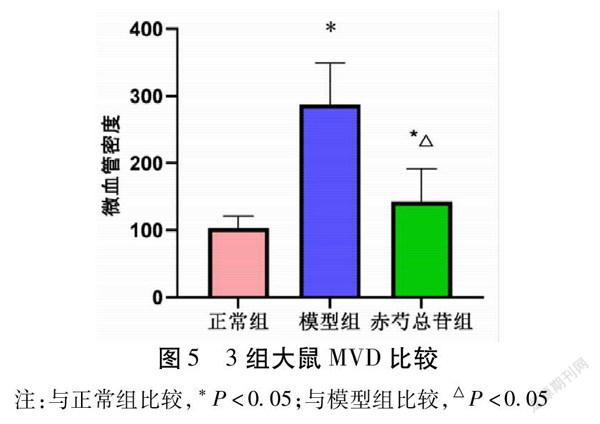
2.4 3组大鼠微血管密度(MVD)比较 模型组大鼠的MVD显著高于正常组(P<0.05);干预后的赤芍总苷组大鼠的MVD显著低于模型组(P<0.05)。见表4,图4~5。
2.5 免疫组织化学(SP)检测Survivin和KRAS表达的比较 模型组大鼠Survivin和KRAS阳性表达显著高于正常组,干预后的赤芍总苷组大鼠Survivin和KRAS阳性表达显著降低(P<0.05)。见表5,图6。
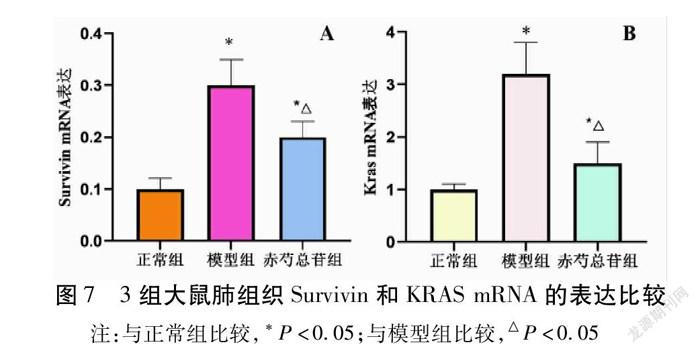
2.6 qRT-PCR检测肺组织Survivin和KRAS mRNA的表达 3组大鼠的Survivin和KRAS mRNA表达比较,模型组显著高于正常组(P<0.05);干预后的赤芍总苷组大鼠的Survivin和KRAS mRNA表达明显降低(P<0.05)。见表6,图7。
3 讨论
肺癌目前已经是全世界共同关注的健康问题,我国肺癌患者每年增加60万以上[11]。在恶性肿瘤中,肺癌的发病率和病死率都排在第一位,虽然手术是治疗肺癌的最佳方法,但患者被确诊时就已经错过了最佳的手术时机,多数患者采用放疗、化疗等方法,但治疗效果往往不理想,对社会和患者造成较大的经济负担。肺癌的发生发展,以及肺癌细胞的侵袭和转移是由多种基因、多个步骤共同完成的病理过程,在这个病理过程中会有大量的微血管生成[12]。细胞外微环境出现局部缺氧时,肿瘤血管生成会自动启动,使促血管生长因子表达;当肿瘤血管生成出现异常时,机体血管中生成因子和抑制因子的平衡就会被打破,即肿瘤组织中促血管生成因子占主导,减少血管生成抑制因子的表达,会诱发大量的血管生成,从而导致肿瘤细胞的侵袭和迁移[13-14]。当恢复血管生成平衡时,会促进肿瘤组织异常血管凋亡,使血管暂时恢复到基本正常状态。所以,有效阻断肿瘤血管的大量生成可为肺癌的诊治提供新的思路。
赤芍总苷为赤芍药中不同苷类的总称。赤芍总苷能有效的保护肝脏,还能抑制肿瘤的发生发展,保护神经系统和心脏不受损伤,对血栓、氧化和内毒素都有一定的抑制作用[15]。
近年来,对赤芍的研究随着中药化学的进展而不断的增多,由此发现赤芍总苷可有效抑制肿瘤生长。本研究发现,肺癌大鼠的体质量明显减少,赤芍总苷干预后肺癌大鼠的体质量明显增加,由此说明,赤芍总苷能有效抑制肿瘤因子导致的营养物质代谢紊乱,进而使体质量在平稳状态下增长。肺癌大鼠的肺指数出现明显异常,肺体积也明显增大,赤芍总苷干预后肺癌大鼠的肺指数明显降低,且肺组织明显改善。由此可见,赤芍总苷可有效地减轻肺脏的病变程度,保护肺脏的同时抑制癌症的发生发展。陈仪坤等通过对肿瘤的研究发现,赤芍总苷能有效的抑制肿瘤的发生和发展[16]。高晓会等[17]研究发现,赤芍总苷可抑制人肺癌细胞的增殖和迁移,主要的机制是对AKT通路的抑制,使MMP-2表达降低。
血管新生是指机体在正常生长发育过程中,或创伤修复和缺血缺氧条件下,在原有血管丛基础上经出芽或其他方式形成新血管的过程。血管的生成或通过肿瘤的发展进行诱导,并且肿瘤也会依赖新生的血管进行生长和转移[18]。癌细胞的增殖和癌的复发都受新生肿瘤血管影响,其也影响着癌细胞的侵袭和转移。目前衡量新血管生成的标准为微血管的密度,其可反映肿瘤血管的生成和肿瘤的生长和转移,同时还能反映治疗后肿瘤复发的情况[19]。肺癌大鼠的微血管密度出现异常升高,赤芍总苷干预后肺癌大鼠的微血管密度减少。可见,赤芍总苷可显著抑制微血管的密度,进而有效抑制肿瘤的发生。本研究发现Survivin和KRAS在肺癌大鼠的中阳性表达,赤芍总苷可抑制肺癌大鼠中Survivin和KRAS的阳性表达。有研究发现,在促肿瘤微血管成长因子中,Survivin是其中最主要的一员,介导肿瘤组织的表达和血管的生成,并且Survivin对三维血管的形成有重要的影响,对内皮细胞的生长和趋化有一定的刺激,同时能有效保护细胞的完整性,影响血管内皮细胞的成活和血管的生成。Ras是癌基因的一种,在恶性肿瘤基因突变中,Ras占据30%以上。KRAS是Ras的一种亚型,多发于胰腺癌、结直肠癌和肺癌中,由此可见KRAS突变肿瘤极具危害性。王海艳等[20]对结直肠癌患者研究证实,在直肠癌患者中KRAS的突变是频发性的,虽然体内的Nras基因和Braf基因的突变相对较弱,但也不能小觑。赤芍总苷组大鼠的Survivin和KRAS的阳性表达和mRNA表达均显著降低,可见赤芍总苷可明显抑制肺癌的发生,肺癌发生可能和抑制Survivin和KRAS的表达有关。赤芍总苷具有多种药理作用,可以诱导肿瘤细胞的凋亡,调节免疫系统,同时对血管的生成和肿瘤的增殖和转移均有一定的抑制作用。张立广等[21]研究发现,赤芍总苷可抑制肺癌大鼠中MRP、MDR1、P21及P53基因的表达。
综上所述,赤芍总苷可有效的抑制肺癌大鼠肺组织中Survivin和KRAS的表达,同时对微血管的生成也有显著的抑制作用。
参考文献
[1]Masciale V,Grisendi G,Banchelli F,et al.CD44+/EPCAM+cells detect a subpopulation of ALDH high cells in human non-small cell lung cancer:A chance for targeting cancer stem cells?[J].Oncotarget,2020,11(17):1545-1555.
[2]Yu R,Wang M,Wang M,et al.Melittin suppresses growth and induces apoptosis of non-small-cell lung cancer cells via down-regulation of TGF-β-mediated ERK signal pathway[J].Braz J Med Biol Res,2020,54(2):e9017.
[3]陳怡,朱颜俊,树瑜.TPG对HaCaT细胞增殖、凋亡、细胞周期及miR-320/RASA1表达的影响[J].分子诊断与治疗杂志,2020,12(9):1246-1250.
[4]谢兵兵,刘丽娟,卢宝全,等.赤芍总苷对局灶性脑梗死大鼠脑组织Notch信号通路的影响[J].西安交通大学学报:医学版,2019,40(5):830-833.
[5]王晓聪.Survivin基因与眼科相关疾病研究进展[J].中华实验眼科杂志,2020,38(8):721-725.
[6]Kumazaki M,Shimomura I,Kiyono T,et al.Cell-type specific tumorigenesis with Ras oncogenes in human lung epithelial cells[J].Biochem Biophys Res Commun,2020,525(2):483-490.
[7]Dalpa E,Gourvas V,Soulitzis N,et al.K-Ras,H-Ras,N-Ras and B-Raf mutation and expression analysis in Wilms tumors:association with tumor growth[J].Med Oncol,2017,34(1):6.
[8]Ponz-Sarvise M,Nguewa P A,Pajares M J,et al.Inhibitor of Differentiation-1 as a Novel Prognostic Factor in NSCLC Patients with Adenocarcinoma Histology and Its Potential Contribution to Therapy Resistance[J].Clin Cancer Res,2011,17(12):4155-4166.
[9]Yugawa K,Itoh S,Yoshizumi T,et al.Prognostic impact of tumor microvessels in intrahepatic cholangiocarcinoma:association with tumor-infiltrating lymphocytes[J].Mod Pathol,2021,34(4):798-807.
[10]张朝清,刘丽,吴定滨,等.VEGF及微血管密度在非小细胞肺癌中的表达及VEGF与临床病理特征的关系[J].海南医学,2017,28(14):2254-2256.
[11]王蔚,王旭,余苏云,等.人参皂苷Rg_3调节免疫检查点PD-L1抑制肺癌Lewis细胞增殖的作用及机制研究[J].中草药,2019.50(1):166-171.
[12]田志三.纵隔型肺癌CT及MRI的临床表现及诊断效果分析[J].影像研究与医学应用,2018,2(12):98-99.
[13]凌耿强,马东营,何瑞星,等.肿瘤细胞微环境对胶质瘤血管生成拟态形成的影响[J].中国医药生物技术,2017,12(2):134-138.
[14]刘妙华,周步高,栾思宇,等.片仔癀调控肿瘤细胞凋亡与增殖的途径[J].中成药,2021,43(1):159-162.
[15]袁蓉,施伟丽,信琪琪,等.川芎—赤芍药对研究进展[J].环球中医药,2019,12(5):808-811.
[16]马云飞,李光达,李琦玮,等.赤芍活性成分抗肿瘤作用机制研究进展[J].中国药房,2020,31(4):500-504.
[17]高晓会,张亚利,张治业,等.赤芍总苷抑制人肺癌A549细胞增殖、迁移与侵袭的作用机制研究[J].华西药学杂志,2019,34(3):243-248.
[18]卜晓敏,李立文,夏亮,等.与肿瘤血管生成相关microRNA的研究进展[J].山东医药,2020,60(1):98-100.
[19]付信飞,马青松,黎俊.双源CT灌注成像评估胃癌肿瘤血管生成及其与血清TFF3、VEGF表达的相关性研究[J].实用医院临床杂志,2019,16(5):216-219.
[20]王海艳,许春伟,吴永芳,等.结直肠癌患者肿瘤组织中KRAS和BRAF基因突变的分子病理检测分析[J].贵州医药,2015,39(11):961-963.
[21]张立广,王军,胡潺潺,等.赤芍总苷对肺癌模型大鼠抑癌相关基因表达的影响[J].中国药房,2016,27(16):2218-2221.
(2020-06-30收稿 本文编辑:杨燕)

