低磷与干旱胁迫下百脉根代谢组学分析
李亚娇, 马培杰, 龙忠富, 舒健虹, 陈 莹, 王小利
(贵州省农业科学院草业研究所, 贵州 贵阳 550006)
低磷和干旱胁迫影响植物的形态、生理和生物化学过程,降低其光合作用[1],同时其在植物细胞的伸长和分裂[2],能量代谢、细胞膜的合成等方面起着抑制作用[3]。低磷和干旱胁迫还会抑制植物对养分的吸收,抑制相关功能基因和结构基因的表达[4-6]。代谢物在植物的生长发育中起着重要的作用,非生物胁迫下,代谢产物参与细胞信号传导、能量储存、膜的形成以及整个植物物质的分配[7]。各种逆境胁迫会造成植物各种代谢酶活性抑制、底物短缺、对某些化合物的过度需求,影响植物正常物质代谢活性[8]。面对各种胁迫,植物会重新分配代谢物质反应流程,包括初级或次级代谢物质,以便于调节植物细胞和组织的生长发育进程、氧化还原稳定性、离子转运和酶活性,以维持植物生长发育过程中必要的物质代谢[9-10]。
随着高通量检测技术的快速发展,代谢组学已经渗透到多个领域。在植物研究中,代谢组学现在被认为是不同分子生物学研究中广泛使用的重要生物技术工具[11-12]。许多研究利用代谢组学探究植物在应对不同环境胁迫(包括干旱、盐、热、冷和光胁迫等)时的代谢物变化[13-14]。代谢物分析方法已经被广泛应用于植物对逆境胁迫的分子响应机制,并用来评估某一特定代谢物类或途径中的代谢物水平[15-16],包括用气相色谱-质谱(GC-MS)、液相色谱-质谱(LC-MS)、核磁共振(NMR)、高效液相色谱(HPLC)和毛细管电泳-质谱(CE-MS)等多种方法鉴定植物、动物和微生物在各种逆境胁迫下的代谢物反应机制[17-18]。代谢组学可以通过测量参与各种生化过程的代谢物来揭示这些复杂的机制[19]。为了应对非生物胁迫,植物可以调节其代谢网络,合成一系列代谢物,以帮助其修复损伤[20]。百脉根(Lotuscorniculatus)属多年生草本植物,具有改良土壤的功能,也是优良的蜜源和药用植物[21]。目前,关于百脉根在低磷和干旱胁迫下代谢物的变化的研究鲜有报道。本研究旨在利用液相色谱-质谱(LC-MS)技术,研究低磷和干旱胁迫下百脉根的代谢产物变化,以对进一步研究百脉根抵御低磷和干旱胁迫的机制提供基础。
1 材料与方法
1.1 材料、处理和取样
百脉根于贵州省草业研究所人工气候室内种植(光照16 h,黑暗8 h,生长温度25℃),先于11 cm×15 cm的花盆内撒播种植,2~3叶时移栽入蒸馏水配置的霍格兰营养液瓶中。空白对照(CK):pH为8.1±0.5的1/8-霍格兰营养液,添加10 mmol·L-1的NaHCO3,NH4H2PO4的浓度为0.25 mmol·L-1。低磷(LP):pH为8.1±0.5的1/8-霍格兰营养液,添加10 mmol·L-1的NaHCO3。20%干旱胁迫(PEG):pH为8.1±0.5的霍格兰营养液,添加10 mmol·L-1的NaHCO3,NH4H2PO4的浓度为0.25 mmol·L-1,添加200 g·L-1的聚乙二醇(Polyethyleneglycol,PEG-6000)。每瓶5株苗,每3天换1次营养液,培养1个月后收获,进行相关指标测定和样品采集。
1.2 代谢组样品处理和数据分析
本项目选取未处理的对照组(CK)、低磷(LP)和干旱胁迫(PEG)3组样本,每组6个样品,共计18个样品进行代谢物测定。代谢物提取流程:称取50 mg样本,加入1 000 μL含有内标(1 000∶2)的提取液(甲醇乙腈水体积比2∶2∶1,内标浓度 2 mg·L-1),涡旋混匀30 s;加入瓷珠,45 Hz研磨仪处理10 min,超声10 min(冰水浴);-20℃静置1 h;将样本在4℃下,12 000 r·min-1离心15 min;小心地取出500 μL上清液于EP管中;在真空浓缩器中干燥提取物;向干燥后的代谢物加入160 μL提取液(乙腈和水体积比1∶1)复溶;涡旋混匀30 s,冰水浴超声10 min;将样本在4℃下,12 000 r·min-1离心15 min;小心地取出120 μL上清液于2 mL进样瓶,每个样本各取10 μL混合成QC样本并上机检测。用于代谢组学分析的液-质联用系统由沃特世Acquity I-Class PLUS超高效液相串联沃特世Xevo G2-XS QTof高分辨质谱仪组成,所使用色谱柱为购自沃特世的Acquity UPLC HSS T3色谱柱(1.8 μm,2.1×100 mm)。使用MassLynx V4.2采集的原始数据通过Progenesis QI软件做峰提取、峰对齐等数据处理操作,基于Progenesis QI软件在线METLIN数据库及百迈客自建库进行鉴定,同时进行理论碎片识别,质量数偏差均在100 ppm以内[22]。
2 结果与分析
2.1 百脉根低磷和干旱胁迫下外观特征
百脉根经过低磷和干旱胁迫处理生长一个月与对照相比,百脉根地上部分长势明显变弱,茎变短、叶减少(图1A,图1B)。百脉根地下根系部分长势变弱,主根均变短,侧根大量减少(图1C,图1D)。

图1 百脉根在低磷和干旱胁迫下的外观特征Fig.1 Appearance characteristics of Lotus Corniculatus L. with low phosphorus and drought stress
2.2 质谱分析体系建立
样品的重复相关性评估至关重要,相关性分析可以评估组内样品之间的生物学重复。同时组内样品相对组间样品的相关系数越高,获得的差异代谢物越可靠。将斯皮尔曼等级相关系数r(Spearman Rank Correlation)作为生物学重复相关性的评估指标。r2越接近1,说明2个重复样品相关性越强。结果见图2A,2个处理组6个重复间的相关系数均在较好的范围内。聚类分析是对样品指标进行分类的一种多元统计分析方法[23],由图2C中得知,不同的处理间代谢物有上调也有下调。从图2B中可以看出,干旱和低磷胁迫处理组和对照组6个重复的数据点检测结果都很好地被分成3组,并分别集中在一起,说明在整个试验过程中系统误差较小,数据可重复性很好,可用于后续分析。干旱胁迫、低磷胁迫和对照百脉根叶片在PC1上有明显分离,PC1的贡献率为56.42%,而PC2贡献率则为22.31%,表明3组样品间的代谢调控不同。其次,从图2D可以看出3组样品的数据点在空间上可以明显区分,表明3组样品的代谢产物在种类、数量和浓度等方面存在差异。因此,对代谢产物的进一步分析,可揭示贵州天然豆科牧草百脉根耐旱耐贫瘠的调控机制。
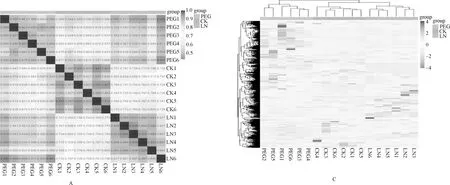
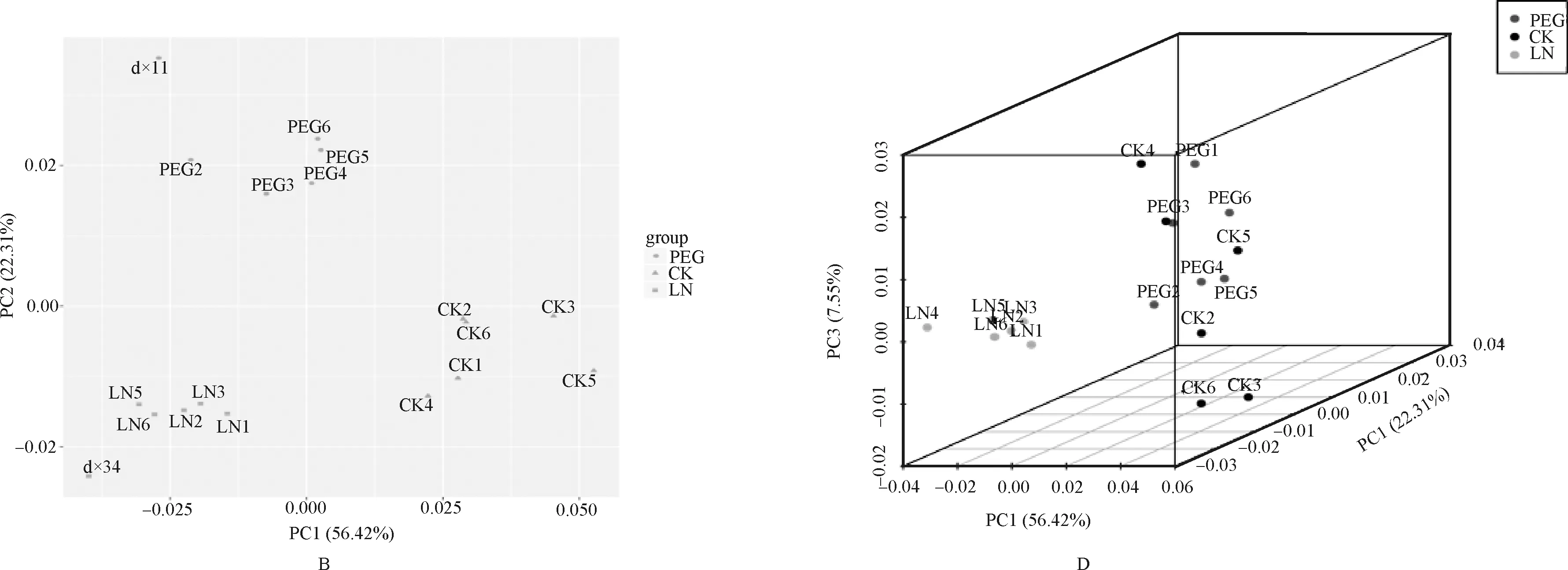
图2 全部样品质谱分析体系图Fig.2 Quality spectrum analysis system diagram of all samples注:A:样品间相关性图;B:代谢物质聚类图;C:所有样本的主成分分析PCA图;D:所有样本的主成分分析PCA-3D图Note:A:correlation diagram between samples;B:Cluster diagram of metabolites;C:PCA diagram of all samples;D:PCA-3D diagram of all samples
2.3 主成分分析
由图3A(干旱处理)和图3B(低磷处理)可知,干旱和低磷处理百脉根叶片相对于对照组CK在PC1上有明显分离,PC1的贡献率分别为66.67%和78.11%,而PC2贡献率则为13.38%和10.44%,其中百脉根代谢叶片响应干旱的第一主成分大于其响应低磷第一主成分的方差贡献率,说明低磷胁迫条件下百脉根的代谢表型较干旱变化更为剧烈。总体来看,对照组与百脉根两个胁迫处理组间的代谢表型差异明显,代谢调控不同。
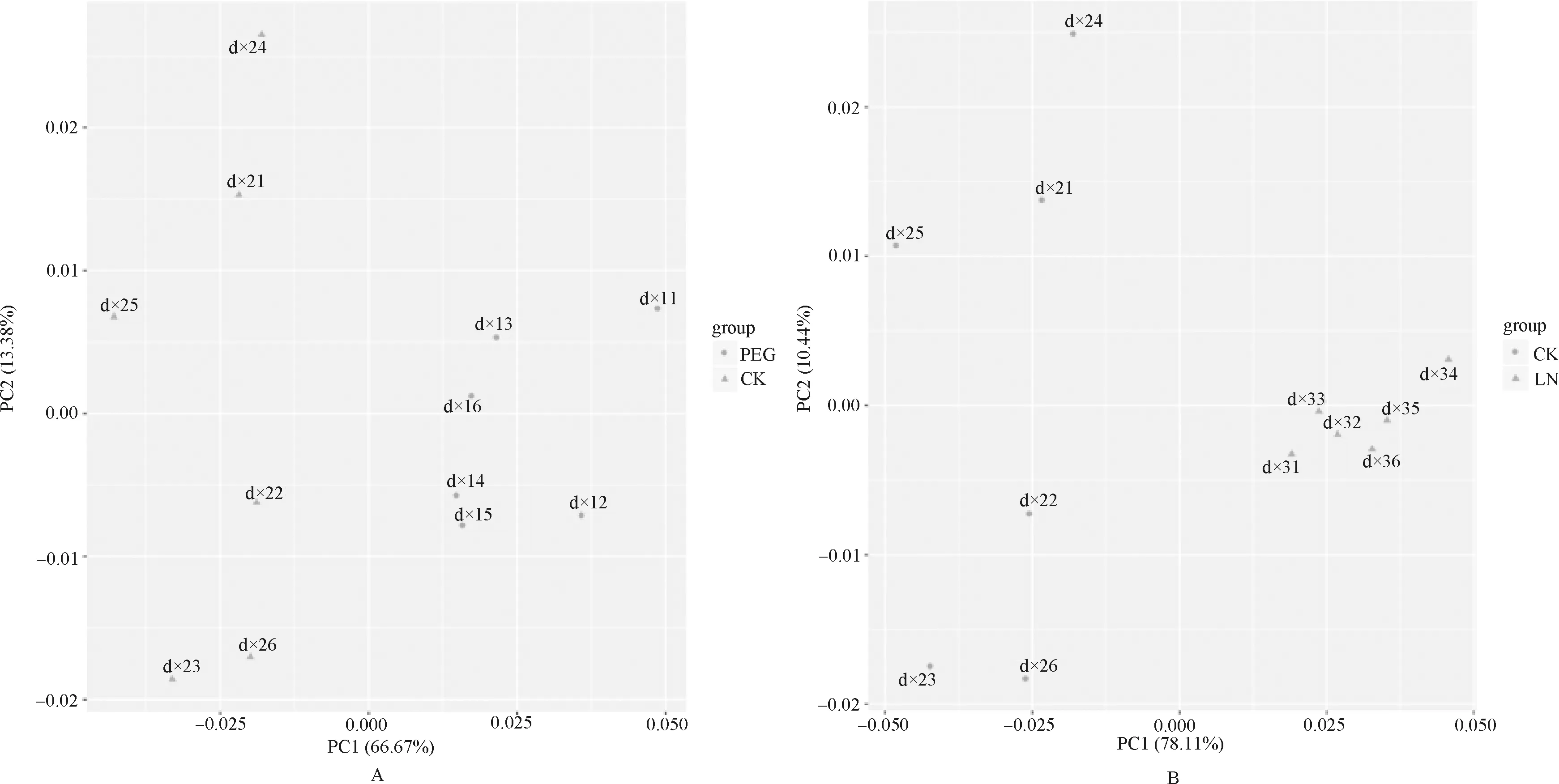
图3 百脉根胁迫处理主成成分分析Fig.3 PCA analysis of Lotus Corniculatus under stress
2.4 差异代谢物筛选
用t检验和正交偏最小二乘法判别方法的VIP值相结合的方法来筛选差异代谢物,筛选的标准为P<0.05和VIP值>1。各种差异代谢物数目统计如表1所列,从表中可看出,干旱胁迫的差异代谢物最多,为390种,而低磷胁迫理的差异代谢物则只有332种,说明代谢物质变化在干旱胁迫中更为复杂。两种胁迫处理中,差异代谢物主要以上调为主,其中干旱和低磷胁迫上调代谢物分别占80.51%和62.95%。韦恩图(图4)中显示,两组胁迫处理共同差异代谢物达151种,火山图(Volcano plot)是综合差异倍数分析和t检验的一种单变量分析方法。图中矩形所圈的点为变化倍数(Fold change),其大于2.0且P<0.05的代谢物,即单变量统计分析筛选的差异代谢物。从火山图中也可以清楚的对比出上调的差异代谢物和下调的差异代谢物(图5A,图5B)。
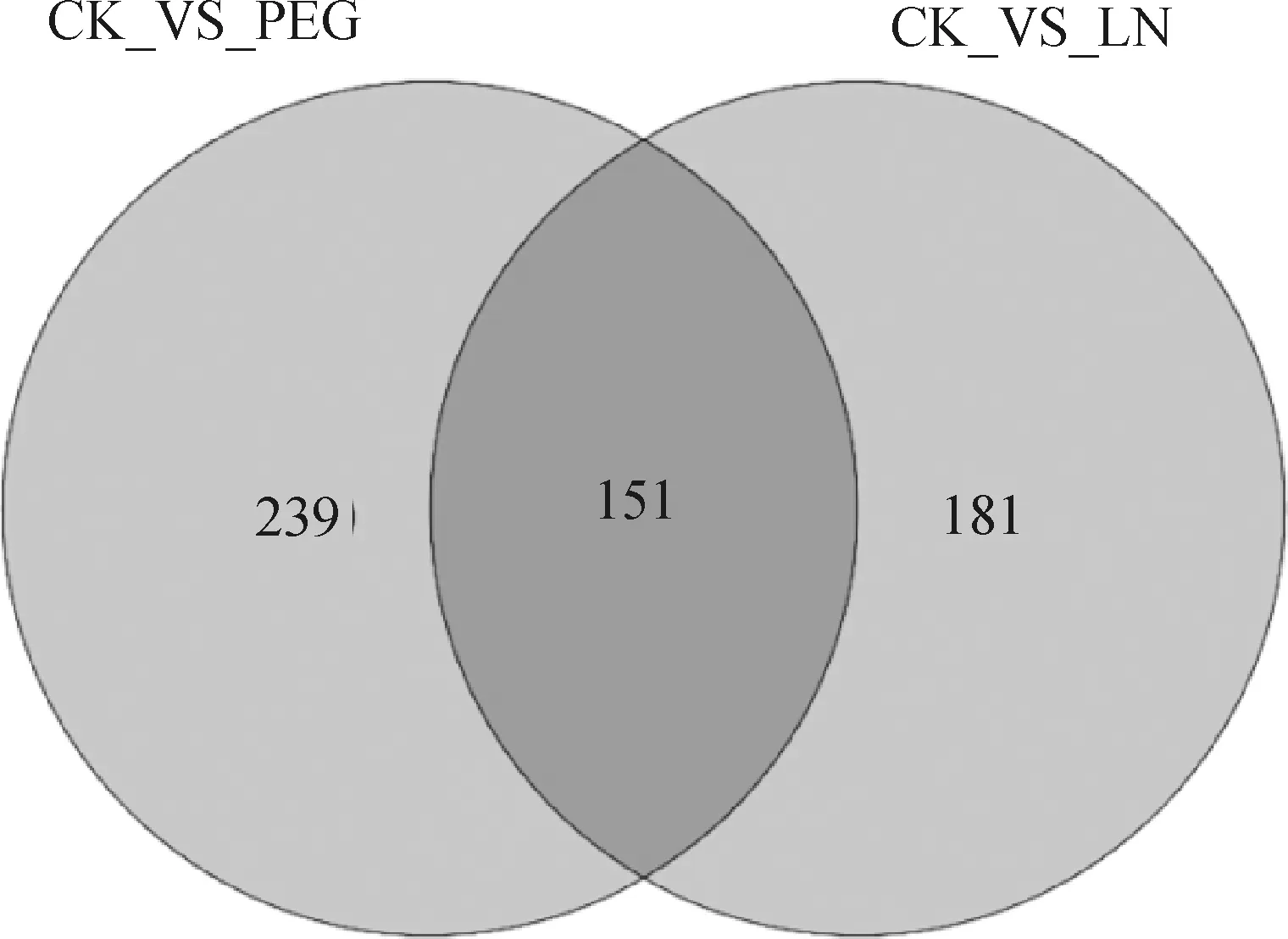
图4 差异代谢物数量韦恩图Fig.4 Wenn plot of differential metabolites

图5 差异代谢物火山图Fig.5 Volcanic map of differential metabolites注:火山图中每个点代表一个代谢物,横坐标代表该组对比各物质的倍数变化(取以2为底的对数),纵坐标表示t检验的P值(取以10为底的对数),散点大小代表OPLS-DA模型的VIP值,散点越大,VIP值越大,筛选得到的差异表达代谢物越可靠。图中灰色的点代表下调差异表达代谢物,黑色的点代表上调差异表达代谢物,比较浅色的点代表检测到但差异不显著的代谢物Note:Each dot of volcano represents a metabolite in the figure,the abscissa represents the group contrast ratio of each material change (with 2 logs base),the vertical represents the P-t test value (in the logarithm of 10 at the bottom),the size of scatter represents the VIP value of OPLS-DA model,the larger the scatter,the greater the VIP value,the differential expressed metabolites obtained by screening are more reliable. Grey dots in the figure represent downregulated and differentially expressed metabolites,black dots represent up-regulated and differentially expressed metabolites,and light dots represent detected but not significantly different metabolites

表1 差异代谢物统计Table 1 Differential metabolite statistics
2.5 差异代谢物定量分析
对所检测到的代谢物进行定性和定量分析后,可先比较在各分组中代谢物定量信息发生的差异倍数变化。根据VIP值选择差异代谢物上调显著前20个和下调显著前20个进行热图绘制(图6),低磷和干旱胁迫处理与对照相比代谢物上调显著共同有meta_225、meta_344和meta_574三个代谢物。低磷和干旱胁迫处理与对照相比,代谢物下调显著的有meta_493,meta_588,meta_627,meta_728,meta_819,meta_821,meta_900,meta_913和meta_960等9个代谢物。

图6 低磷和干旱胁迫下差异代谢物定量热图Fig. 6 Quantitative heat map of differential metabolites under low phosphorus and drought stress注:第一列为上调显著的前20个代谢物,第二列为下调显著的前20个代谢物Note:The first column showed the first 20 metabolites significantly up-regulated,and the second column showed the first 20 metabolites significantly down regulated
2.6 差异代谢物KEGG功能注释及富集分析
利用KEGG数据库对差异代谢物进行注释,将筛选出的差异代谢物映射到KEGG通路上,并将其在KEGG通路图上进行标记。分析结果显示,干旱胁迫差异物质共映射到70条代谢通路,主要聚类为脂肪酰基、羧酸及其衍生物、有机氧化合物、类黄酮、甘油磷脂、异黄酮、多聚异戊二烯醇脂质。富集程度最显著的途径为类固醇生物合成、二苯乙烯、二芳庚烷和姜酚的生物合成、脂肪酸生物合成、花生四烯酸代谢、泛素及其他萜类醌类生物合成、嘌呤代谢、二萜生物合成、氨基糖和核苷酸糖的代谢、生物素代谢、次生代谢物的生物合成(图7A,图7B)。低磷胁迫差异物质共映射到58条代谢通路。主要聚类为脂肪酰基、羧酸及其衍生物、有氧化合物、类黄酮、甘油磷脂、嘌呤核苷、肉桂酸及其衍生物。富集程度最显著的途径为苯乙烯、二芳庚烷和姜酚的生物合成、甘油磷脂新陈代谢、二萜生物合成、类苯基丙烷生物合成、嘧啶代谢(图7C,图7D)。

图7 各组差异代谢物HMDB分类图和气泡图Fig.7 HMDB classification diagram and bubble diagram of different metabolites in each group注:图7A中,1=脂肪酰基;2=羧酸及其衍生物;3=有机氧化合物;4=黄酮类化合物;5=甘油磷脂;6=异黄酮;7=异戊二烯脂类;8=嘌呤核苷酸;9=类固醇和类固醇衍生物;10=肉桂酸及其衍生物;11=苯丙酸;12=嘌呤核苷;13=嘧啶核苷;14=四吡咯及其衍生物;15=生物素及其衍生物;16=碳水化合物和碳水化合物结合物;17=香豆素及其衍生物;18=二嗪类;19=二氢呋喃;20=吲哚及其衍生物。图7B中,1=淀粉和蔗糖代谢;2=萜类骨架生物合成;3=异喹啉生物碱生物合成;4=嘌呤代谢;5=单萜生物合成;6=鞘脂代谢;7=嘧啶代谢;8=花生四烯酸代谢;9=泛醌和其他萜类-醌生物合成;10=生物素代谢;11=氨基糖和核苷酸糖代谢;12=二萜生物合成;13=脂肪酸生物合成;14=芪类、二芳基庚烷类和姜辣素生物合成;15=抗坏血酸和醛糖酸盐代谢;16=糖基磷脂酰肌醇(GPI)-锚定生物合成;17=内吞作用;18=自噬-动物;19=RNA转运;20=类固醇生物合成。图7C中,1=脂肪酰基;2=羧酸及其衍生物;3=有机氧化合物;4=黄酮类化合物;5=甘油磷脂;6=嘌呤核苷;7=肉桂酸及其衍生物;8=有机氮化合物;9=异戊二烯脂类;10=嘧啶核苷;11=四吡咯及其衍生物;12=5'-脱氧核糖核苷;13=苯和取代衍生物;14=香豆素及其衍生物;15=二氢呋喃;16=杂芳族化合物;17=吲哚及其衍生物;18=有机碳酸及其衍生物;19=酚类;20=苯丙酸。图7D中,1=嘌呤代谢;2=卟啉和叶绿素代谢;3=氰基氨基酸代谢;4=苯丙氨酸代谢;5=单萜生物合成;6=异喹啉生物碱生物合成;7=不饱和脂肪酸的生物合成;8=β-丙氨酸代谢;9=淀粉和蔗糖代谢;10=柠檬酸循环(TCA循环);11=嘧啶代谢;12=苯丙烷生物合成;13=甘油磷脂代谢;14=二萜生物合成;15=芪类、二芳基庚烷类和姜辣素生物合成;16=抗坏血酸和醛糖酸盐代谢;17=RNA转运;18=内吞作用;19=糖基磷脂酰肌醇(GPI)-锚定生物合成;20=自噬-动物Note:In figure 7A,1=fatty acyl group;2=carboxylic acid and its derivatives;3=organic oxygen compound;4=flavonoids;5=glycerophospholipids;6=isoflavones;7=isoprene lipids;8=purine nucleotides;9=steroids and steroid derivatives;10=cinnamic acid and its derivatives;11=phenyl propionic acid;12=purine nucleoside;13=pyrimidine nucleoside;14=tetrapyrrole and its derivatives;15=Biotin and its derivatives;16=Carbohydrate and carbohydrate conjugates;17=Coumarin and its derivatives;18=Diazines;19=Dihydrofuran;20=Indole and its derivatives. In Figure 7B,1=fatty acyl;2=carboxylic acid and its derivatives;3=organic oxygen compounds;4=flavonoids;5=glycerophospholipids;6=purine nucleosides;7=cinnamic acid and its derivatives;8=organic nitrogen compounds;9=isoprene lipids;10=pyrimidine nucleosides;11=tetrapyrroles and their derivatives;12=5'-deoxyribonucleosides;13=benzene and substituted derivatives;14=Coumarin and its derivatives;15=dihydrofuran;16=heteroaromatic compounds;17=indole and its derivatives;18=organic carbonic acid and its derivatives;19=phenols;20=phenyl propionic acid. In figure 7C,1=starch and sucrose metabolism;2=terpenoid skeleton biosynthesis;3=isoquinoline alkaloid biosynthesis;4=purine metabolism;5=monoterpene biosynthesis;6=sphingolipid metabolism;7=pyrimidine Metabolism;8=arachidonic acid metabolism;9=ubiquinone and other terpenoid-quinone biosynthesis;10=biotin metabolism;11=amino sugar and nucleotide sugar metabolism;12=diterpene biosynthesis;13=fatty acid Biosynthesis;14=Stilbene,diarylheptanes and gingerol biosynthesis;15=Ascorbic acid and aldonate metabolism;16=Glycosylphosphatidylinositol (GPI)-anchored biosynthesis;17=Endocytosis;18=autophagy-animal;19=RNA transfer;20=steroid biosynthesis. In figure 7D,1=purine metabolism;2=porphyrin and chlorophyll metabolism;3=cyanoamino acid metabolism;4=phenylalanine metabolism;5=monoterpene biosynthesis;6=isoquinoline alkaloid biosynthesis 7=Biosynthesis of unsaturated fatty acids;8=β-alanine metabolism;9=starch and sucrose metabolism;10=citric acid cycle (TCA cycle);11=pyrimidine metabolism;12=phenylpropane biosynthesis;13=Glycerol phospholipid metabolism;14=diterpene biosynthesis;15=stilbene,diarylheptanes and gingerol biosynthesis;16=ascorbic acid and aldonic acid metabolism;17=RNA transport;18=endocytosis;19=Glycosylphosphatidylinositol (GPI)-anchored biosynthesis;20=autophagy-animal
从表2中可知,干旱胁迫处理百脉根叶片的前19种差异显著的代谢产物中,14种代谢产物上调,其中7,12-二甲基苯[a]蒽5,6-氧化物(Dimethylbenz[a]anthracene 5,6-oxide)、1-水杨酸葡萄糖醛酸苷(1-Salicylate glucuronide)、2,3,23-三乙酰丝胶酸(2,3,23-Triacetylsericic acid)显著上调,小柱孢酮(Scytalone)、(E)-3-(2-羟基苯基)-2-丙烯醛显著下调。从表3中可知,低磷胁迫处理百脉根叶片的前19种差异显著的代谢产物中,12种代谢产物上调,其中丙二酸氢乙酯(Ethyl hydrogen malonate)、5′-O-(吡喃葡萄糖基)吡哆辛(5′-O-β-D-Glucosylpyridoxine)、D-α-葡萄庚糖(D-α-Glucoheptose)显著上调。塞兰宁(Salannin)、6-十五烷基水杨酸(6-pentadecyl Salicylic Acid)显著下调。

表2 干旱胁迫条件下百脉根叶片中主要差异代谢物Table 2 Main differential metabolites in the leaves of Lotus corniculatus under drought stress

表3 低磷胁迫条件下百脉根叶片中主要差异代谢物Table 3 Major difference metabolites in leaves of Lotus corniculatus under low phosphorus stress
3 讨论
植物对逆境胁迫最重要的响应是代谢的改变,即植物通过调节代谢网络以诱导产生一系列特殊代谢物,从而达到对生物、非生物胁迫的防御作用。代谢组学可以通过监测植物体系受到胁迫或刺激后代谢产物的变化来揭示胁迫环境下植物的应答机制,是植物抗逆研究的很好的途径[24]。本研究通过PCA和OPLS-DA分析、差异倍数柱图和差异代谢物火山图分析表明,贵州天然豆科牧草百脉根在干旱和低磷环境中均具有非常明显的代谢特征,推测基础代谢物组成作为植物生化反应的物质基础在应答两种胁迫方面具有重要意义。干旱胁迫下百脉根390条差异代谢物比低磷胁迫高出58条,表明百脉根在应答干旱胁迫中积累了更多的代谢物。Bailin[25]等的研究表明,正向和负向电离模式下分别有448个上调基因和918个下调基因以及325种和219种化合物分别响应短期和长期热胁迫而上调或下调。植物生长和防御的主要调节因子信号转导是植物应答非生物胁迫的重要过程[26]。甘油磷脂作为植物细胞对蛋白质的识别和信号传导的重要代谢物,是植物应对逆境胁迫应答机制之一,本试验干旱和低磷胁迫差异物质映射的代谢通路中,都注释到了甘油磷脂通路。酮体、萜类化合物有助于增强植物的抗旱性[27-28],两种胁迫处理百脉根注释到的通路中,酮体的合成和降解、萜类化合物代谢等挥发性物质都表现为上调。植物产生的挥发性物质,如烷烃类、烯烃类、醛类、酮类、萜烯类化合物影响植物的抗旱调节[29]。本实验干旱胁迫处理百脉根叶片中前19种差异显著的代谢产物中绝大多数都是此类物质。李小冬[30]等研究在干旱胁迫下高羊茅(Festucaarundinacea)叶片代谢组中鉴定出282种物质存在差异,其中脂代谢产物和芳香族化合物含量差别较大,与本实验干旱胁迫主要聚类为脂肪酰基、多聚异戊二烯醇脂质研究结果一致。植物需要使用专门的新陈代谢机制以免受环境压力这一观点需要通过解决以下问题来证明:专门的新陈代谢机制所能承受的压力是否直接归因于代谢产物,如类黄酮。前人在茶树研究中发现,酮类化合物具有清除活性氧的作用,增强植物对环境变化的适应性[31]。在拟南芥的研究中发现,类黄酮具有自由基清除活性,增强了拟南芥对非生物胁迫的耐受性[3,32],这与本研究的结果一致。
4 结论
在研究中,我们对低磷和干旱胁迫下的百脉根进行了代谢物分析。通过分析对照组、低磷胁迫组和干旱胁迫组之间的差异代谢物、差异代谢定量差异倍数、差异代谢物KEGG代谢通路和主要差异代谢物类型,发现百脉根在低磷和干旱胁迫下多种代谢物发生了变化,这些产物可能参与调控百脉根抵御低磷和干旱胁迫,为进一步研究百脉根抵御低磷和干旱胁迫的机制提供了基础。

