热胁迫对松江鲈免疫功能的影响
刘佳奇 刘玉峰 何忠伟 李猛超 殷蕊 孙桂清 宫春光

摘 要:在水温19~31 ℃,盐度32‰条件下,探究热胁迫对平均体质量为(1.56±0.81)g,平均体长为(5.53±0.81)cm的松江鲈(Trachidermus fasciatus)子二代幼鱼免疫功能的影响。结果显示:当热胁迫水温达到28 ℃时,松江鲈幼鱼体内总抗氧化能力、总超氧化物歧化酶及还原型谷胱甘肽的水平出现显著上升;但随着热胁迫水温升高以及养殖时间增加,机体内免疫活性酶无法有效清除体内产生的氧自由基,松江鲈幼鱼免疫酶活性和抗氧化功能会受到显著的抑制,导致松江鲈幼鱼免疫功能下降。同时,因体内存在大量氧自由基,使得机体内的脂质过氧化物水平和炎症因子基因表达量显著性上升,导致机体出现氧化损伤,对松江鲈幼鱼存活造成威胁。
关键词:松江鲈(Trachidermus fasciatus);热胁迫;免疫功能
松江鲈(Trachidermus fasciatus)隶属脊索动物门(Chordata),硬骨鱼纲(Osteichthyes),鲉形目(Scorpaeniformes),杜父鱼科(Cottidae),松江鲈鱼属(Trachidermus),为近海暖温性底层洄游鱼类[1],主要分布于我国渤海、黄海和东海,在日本以及朝鲜周边部分海域亦有分布[2]。因其营养价值高[3],肉质鲜美,而广受欢迎。
近年来,由于受到兴建水利设施致使松江鲈洄游受阻、水体污染及过度捕捞的影响,松江鲈自然种群数量急剧下降,人们开始尝试进行松江鲈食性、人工繁殖等方面的研究[4-6]。我国松江鲈自然分布地域的夏季水温往往会超过32 ℃,但热胁迫对松江鲈影响的研究却鲜有报道,基于此,本试验尝试探究热胁迫对松江鲈幼鱼相关免疫酶及炎症因子的影响,以为完善松江鲈繁育及人工养殖技术提供理论支持。
1 材料与方法
1.1 试验动物
试验用松江鲈幼鱼来自中国水产科学研究院北戴河中心实验站100日龄松江鲈子二代,平均体质量为(1.56±0.81)g,平均体长为(5.53±0.81)cm。
1.2 试验试剂
0.9%NaCl生理盐水,总抗氧化能力(T-AOC)检测试剂盒、总超氧化物歧化酶(SOD)测定试剂盒、还原型谷胱甘肽(GSH)测定试剂盒、脂质过氧化物(LPO)试剂盒、总蛋白(TP)测定试剂盒(以上活性酶测定试剂盒均购自南京建成生物工程有限公司),TRIZOL试剂(英潍捷基(上海)贸易有限公司),氯仿、异丙醇、DEPC 水、Loading buffer、DNA 分子标准量Marker(上海生工生物工程股份有限公司),无水乙醇(国药生物试剂有限公司),Nanodrop(赛默飞世尔科技(中国)有限公司),TB green、PrimerScript RT reagent KIT(TAKARA生物公司)。
1.3 试验方法
选取大小均等、体质健康的松江鲈幼鱼,其平均体质量为(1.56±0.81) g,平均体长为(5.53±0.81)cm。在水温为19 ℃、盐度为32‰的沙滤海水中暂养14 d,不间断充氧,正常投喂,每隔24 h使用等温海水进行换水,换水量为80%。暂养结束后选取健康幼鱼进行热胁迫试验,每组50尾松江鲈幼鱼,设置3个平行试验组,使用恒温加热棒进行温度控制,水温每日上升(1.0±0.2)℃;设计试验水温梯度为19、22、25、28 ℃和31 ℃;各试验组分别于试验开始的第0 d、第3 d、第6 d、第9 d以及第12 d进行躯干样品采集。样品采集后放入2.0 mL冻存管内于液氮中进行保存,样品全部采集完成后,进行组织样品的总抗氧化能力(T-AOC)、总超氧化物歧化酶(SOD)、还原型谷胱甘肽酶(GSH)、脂质过氧化物(LPO)及炎症因子(TFIL)基因表达量的检测。
1.4 数据处理
试验得出的数据结果以平均值(Mean)表示,采用 SPSS 17.0 和 Excel 2010进行处理。
2 结果与分析
2.1 热胁迫对松江鲈幼鱼总抗氧化能力的影响
如图1所示,在热胁迫过程中,19、22 ℃和25 ℃处理组在第0、3、6、9、12 d五个试验时间点松江鲈幼鱼的总抗氧化能力(T-AOC)水平变化均不存在显著性差异(P>0.05)。28 ℃处理组在热胁迫进行到第6 d时,T-AOC水平出现显著性上升(P<0.05)。31 ℃处理组在热胁迫第3 d T-AOC水平出现了显著上升(P<0.05),但随着热胁迫时间的延长与第0 d相比,在第9、12 d则出现显著性下降(P<0.05),松江鲈幼鱼T-AOC水平随着时间的增加出现先上升后下降趋势,并且在第12 d T-AOC水平达到整体最低水平。
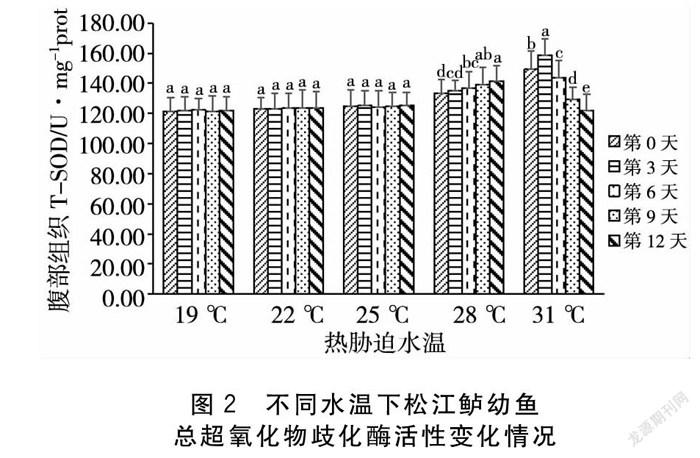
2.2 热胁迫对松江鲈幼鱼总超氧化物歧化酶活性的影响
如图2所示,在热胁迫过程中,19、22 ℃和25 ℃处理组在第0、3、6、9、12 d五个试验时间点松江鲈幼鱼的总超氧化物歧化酶(SOD)活性变化均不存在显著性差异(P>0.05)。在28 ℃处理组中,與第0 d相比,在热胁迫进行到第6 d时,SOD活性出现显著性上升(P<0.05)。31 ℃处理组在热胁迫第3 d SOD活性出现了显著上升(P<0.05),但随着热胁迫时间的延长在第6、9、12 d出现连续的显著性下降(P<0.05),松江鲈幼鱼SOD活性随着时间的增加出现先上升后下降趋势,并且在第12 d SOD活性达到整体最低水平。
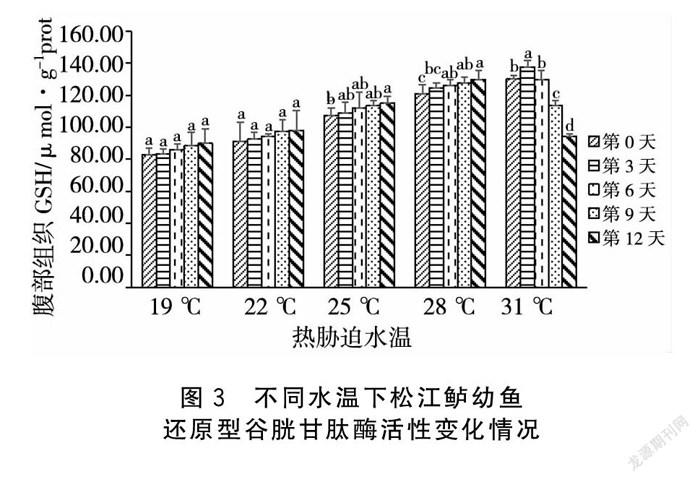
2.3 热胁迫对松江鲈幼鱼还原型谷胱甘肽酶活性的影响
如图3所示,在热胁迫过程中,19 ℃及22 ℃处理组在第0、3、6、9、12 d五个试验时间点松江鲈幼鱼的还原型谷胱甘肽酶(GSH)活性变化均不存在显著性差异(P>0.05)。在25 ℃处理组中,与第0 d相比,在热胁迫进行到第12 d时,GSH活性出现显著性上升(P<0.05)。在28 ℃处理组中,与第0 d相比,在热胁迫进行到第6 d时,GSH活性出现显著性上升(P<0.05)。31 ℃处理组在热胁迫第3 d GSH活性出现了显著上升(P<0.05),但随着热胁迫时间的延长在第6、9、12 d则出现连续的显著性下降(P<0.05)。
2.4 热胁迫对松江鲈幼鱼脂质过氧化物水平的影响
如图4所示,在热胁迫过程中,19、22 ℃和25 ℃三组处理组在第0、3、6、9、12 d五个试验时间点松江鲈幼鱼的脂质过氧化物(LPO)水平变化均不存在显著性差异(P>0.05)。在28 ℃处理组中,与第0 d相比,在热胁迫进行到第6 d时,LPO水平出现显著性上升(P<0.05),并在第9、12 d出现连续的显著性上升(P<0.05)。在31 ℃处理组中,除第6 d外,在热胁迫第3、9、12 d LPO水平均出现显著性上升(P<0.05)。
2.5 热胁迫对松江鲈幼鱼炎症因子基因表达量的影响
如图5所示,在热胁迫过程中,除22 ℃处理组的第3 、6、9 d松江鲈幼鱼的炎症因子(TFIL)基因表达量变化不存在显著性差异外(P>0.05),19 ℃及22 ℃处理组中其余各试验时间点之间均存在显著性差异(P<0.05)。在25 ℃处理組中,与第0 d相比,在热胁迫进行到第6 d时,TFIL基因表达量出现显著性上升(P<0.05),随之在第12 d出现显著性下降(P<0.05)。在28 ℃处理组中,在热胁迫分别进行到第6、9、12 d时,TFIL基因表达量均出现显著性下降(P<0.05)。在31 ℃处理组中,与第0 d相比,在热胁迫分别进行到第6、9、12 d时,TFIL基因表达量均出现显著性上升(P<0.05),但整体呈现先上升后下降的趋势。
3 讨论
在对水产动物进行人工养殖的过程中,水体温度是影响水产动物生长的关键环境因素之一[7]。当养殖水温处于适宜范围内时,随着养殖水温的升高,水产动物的饵料利用率和摄食率会相应提高[8]。但养殖水温过高,会刺激机体相关免疫活性酶水平上升,以应对热胁迫引发的应激反应[9],且随着热胁迫时间的延长及水温的升高,体内过多的氧自由基无法被相关免疫活性酶有效清除,会导致机体免疫功能下降并受到氧化损伤[10]。
在已有的研究中松江鲈苗种的适宜生长水温为10~20 ℃[11],张飞明等[12]认为松江鲈的理论存活水温为35 ℃以下;而在实际养殖过程中发现,松江鲈幼鱼在水温达到31 ℃时出现死亡,因此本试验设计了5个水温梯度,分别为19、22、25、28 ℃及31 ℃。在本试验中,当热胁迫水温达到28 ℃时,松江鲈幼鱼体内T-AOC、SOD及GSH的水平出现显著上升;但随着热胁迫水温升高以及热胁迫时间的延长,松江鲈机体内免疫活性酶无法有效清除体内产生的氧自由基,松江鲈幼鱼免疫酶活性和抗氧化功能会受到显著的抑制,导致其免疫功能下降,这一结果与姜旭阳等[13]探究急性高温胁迫对虹鳟和硬头鳟幼鱼抗氧化酶活性的影响研究结果相似。同时,因体内存在大量氧自由基,使得机体内的LPO水平和TFIL基因表达量显著性上升,导致机体出现氧化损伤,对松江鲈幼鱼存活造成威胁。本试验结果表明,松江鲈幼鱼的培育水温控制在28 ℃以下是比较适宜的。
参考文献:
[1] 薛镇宇.松江鲈鱼(四鳃鲈)[J].水产科技情报,1974(6):30-31.
[2] 邵炳绪,唐子英,孙帼英,等.松江鲈鱼繁殖习性的调查研究[J].水产学报,1980(1):81-86+125-126.
[3] 丁建英,黄晓琳,徐建荣,等.松江鲈肌肉营养成分测定及营养价值评价[J].安徽农业科学,2010,38(35): 20118-20120.
[4] 宋向军,王忠全,周全利,等.松江鲈鱼人工配合饲料投喂实验研究[J].海洋湖沼通报,2014(1):74-80.
[5] 夏苏东,尤宏争,李楠,等.养殖松江鲈鳗弧菌的分离鉴定及药敏试验[J].浙江海洋大学学报(自然科学版),2020,39(3):264-269.
[6] 赵一杰,张美昭,温海深.松江鲈鱼性腺发育组织学观察[J].海洋湖沼通报,2013(1):16-22.
[7] 任凤.环境温度在水产养殖中的作用[J].河南农业,2016(8):69.
[8] 宋超,庄平,章龙珍,等.不同温度对西伯利亚鲟幼鱼生长的影响[J].海洋渔业,2014,36(3):239-246.
[9] 王正健.复合植物源抗应激剂的研制及在中华鳖养殖上的应用研究[D].南京:南京农业大学,2010.
[10] 钟纯怡.水温与溶氧对杂交黄颡鱼受精与孵化及其初孵仔鱼生长与抗氧化性能的影响[D].南京:南京农业大学,2019.
[11] 姜景田.鸭绿江松江鲈人工繁育技术研究[J].渔业致富指南,2010(22):51-53.
[12] 张飞明,张友良,谢志强.松江鲈鱼养殖技术之五松江鲈鱼成鱼养殖技术[J].科学养鱼,2011(12):14-16.
[13] 姜旭阳,黄铭,杨小刚,等.急性高温胁迫对虹鳟和硬头鳟幼鱼抗氧化酶活性的影响[J].中国水产科学,2021,28(1):57-65.
(收稿日期:2021-12-26)
基金项目:国家海洋水产种质资源库;河北省特色水产现代种业科技创新团队(21326307D);河北省现代农业产业技术体系特色海产品创新团队(HBCT2018170206)。
作者简介:刘佳奇(1995-),男,硕士研究生,研究方向:渔业发展。E-mail:1094846521@qq.com。
通信作者:宫春光(1971-),男,副教授,研究方向:病害防控与健康养殖。E-mail:gongcg2005@163.com。

