梨F1代枝干轮纹病抗性分析
张艳杰,欧春青,王 斐,马 力,姜淑苓
(中国农业科学院 果树研究所/农业农村部园艺作物种质资源利用重点实验室,辽宁兴城 125100)
轮纹病是威胁中国梨树生产的重要病害之一,又称为粗皮病、瘤皮病等,主要危害梨树枝干和果实,也可危害叶片,每年造成的减产约25%,严重时烂果率高达80%[1]。目前鉴定的梨轮纹病病原菌仅为葡萄座腔菌(Botryosphaeriadothidea),该菌具有潜伏侵染特征,侵染枝干后以皮孔为中心隆起形成圆形或椭圆形的瘤状物,边缘龟裂,枝干受害严重时,病斑可密集连片,导致树势早衰,严重影响产量[2]。
培育抗性品种是防治轮纹病、有效降低轮纹病对产量影响的重要措施,由于梨树是多年生自交不亲和植物,遗传背景复杂,基因高度杂合,抗病性遗传规律研究较少,其轮纹病抗性遗传规律不明,抗性品种选育进展缓慢。在梨轮纹病抗性遗传规律方面,田间自然发病调查显示,不同梨系对枝干轮纹病的抗性不同,由强到弱的顺序为秋子梨→中国砂梨→白梨→日本砂梨→西洋梨[3];通过室内接种试验鉴定,不同梨系果实对轮纹病的抗性强弱顺序为:砂梨→白梨→秋子梨→种间杂交梨→西洋梨→新疆梨[4]。李晓刚等[5]通过对10个杂交组合827个单株的枝干轮纹病的田间调查和分析,认为梨对轮纹病的抗性是由多基因控制的数量性状,亲本均为感病品种时,后代感病单株比例高,亲本之一为抗病亲本,可提高抗病单株比例,抗病亲本作母本可获得更高比例的抗病后代。当前对梨树抗轮纹病的遗传规律仍没有统一定论,本研究拟通过田间自然发病调查法,评价7个杂交组合1652个F1代单株对枝干轮纹病的抗性,筛选抗病和感病种质材料,分析轮纹病抗性的遗传规律,旨在为梨树抗轮纹病相关基因的鉴定和基因定位奠定基础,为梨树抗轮纹病新品种选育提供依据。
1 材料与方法
1.1 试验材料
7个梨杂交组合(‘八月红×红香酥’‘苹果梨×八月红’‘苹果梨×红香酥’‘早酥×黄冠’‘锦丰×黄冠’‘锦丰×中梨1号’‘中矮1号×早酥’等)的F1代单株定植于中国农业科学院果树研究所(兴城)梨育种试验园,定植时间均在10 a以上,行株距为3 m × 1 m。离体抗病性鉴定的‘中梨1号’枝条由中国农业科学院郑州果树研究所国家园艺种质资源库提供,其余7个品种均由中国农业科学院果树研究所梨育种课题组保存。抗病性鉴定中接种用的葡萄座腔菌(B.dothidea)菌株为中国农业科学院果树研究所梨育种课题组分离保存的菌株,编号为LW1-1。
1.2 病原菌鉴定
采集中国农业科学院果树研究所(兴城)梨育种试验园的梨树枝干轮纹病病瘤,无菌水清洗干净,采用常规组织分离法,分离纯化病原菌。
具体方法如下:将病组织置于75%乙醇消毒30 s,无菌水清洗1次,再用75%乙醇消毒30 s,无菌水清洗3次,置于无菌滤纸晾干,剪取病健交界处组织块,置于PDA培养基,28 ℃恒温培养 5 d后,挑取组织块边缘菌落置于PDA培养基上继续培养5 d,挑取菌落边缘菌丝分离纯化,将纯化菌株接种于PDA培养基,28 ℃恒温培养7 d,挑取适量菌丝,采用Chelex-100法提取菌丝DNA[6]。
主要通过分子鉴定方法,对病原菌进行鉴定,采用真菌鉴定通用引物ITS1(5′-TCCGTAGGTGAACCTGCGG-3′)和ITS4(5′-TCCTCCGCTTATTGATATGC-3′)进行PCR扩增[6];PCR反应体系为25 μL,其中DNA模板溶液2 μL,10 ×Taq10 buffer(Mg2+plus) 2.5 μL,10 mmol/L dNTPs溶液0.5 μL,10 μmol/L的上下游引物各1 μL,Taq10 DNA聚合酶0.5 μL,ddH2O补足至25 μL;PCR程序为:94 ℃预变性5 min;94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸40 s,30个循环;72 ℃延伸10 min,4 ℃保存。
扩增产物采用1%琼脂糖凝胶电泳检测,产物片段单一、纯度高则送北京三博远志生物技术有限责任公司进行测序。将测序结果上传于NCBI进行BLASTn比对,根据片段同源性大小,获得ITS分子鉴定结果。
1.3 梨品种抗病性鉴定
采用离体枝条创伤接种法,鉴定各杂交组合亲本,包括‘苹果梨’‘八月红’‘红香酥’‘早酥’‘黄冠’‘锦丰’‘中梨1号’和‘中矮1号’等8个品种的枝干轮纹病抗性,参考翟立峰[7]的方法并稍加改动,具体方法如下:选取梨当年生休眠枝条,剪成150 mm左右的枝段,枝段两端以石蜡封口,75%酒精表面消毒后,用解剖刀在枝条中间切开直径约5 mm的创伤孔口,接种经活化培养的供试菌株菌丝块,以空白PDA 培养基为对照,每处理5次重复,之后用封口膜缠裹保湿,置于25 ℃湿润条件下培养,14 d后观察并记录其发病情况。根据病斑直径占枝段比例进行抗病性分级,分级标准为:0级,高抗,无病斑;1级,抗病,有病班,但病斑直径占枝段的10%以下;2级,感病,病斑直径占枝段的10%及以上,20%以下;3级,中感,病斑直径占枝段的20%及以上,60%以下;4级,高感,病斑直径占枝段的60%及以上。
1.4 F1代枝干轮纹病抗性调查
2017-2020年,每年进行7个杂交组合 1 652株杂种F1代的枝干轮纹病田间调查,根据病斑面积记录单株发病程度,分级标准参考苹果枝干轮纹病[8],具体为:0级,高抗,树体无轮纹病瘤;1级,抗病,树体分布有零星散生的轮纹病瘤;2级,感病,主干、骨干枝轮纹病瘤较为密集或有少量连片的轮纹病斑;3级,中感,主干、骨干枝上有较多连片的轮纹病斑,主干病斑面积达20%以上;4级,高感,主干、骨干枝上有大量连片的轮纹病斑,主干病斑面积达60%以上。
1.5 数据处理
从NCBI中下载包含模式菌株在内的葡萄座腔菌属真菌的ITS序列,以毛色二孢属(Lasiodiplodia)真菌为外群,采用MEGA6软件,以邻接法(Neighbor-joining, NJ)构建基于ITS序列的系统发育树,自举法(Bootstrap)进行1 000次重复检验。
将数据输入Excel软件,进行数据统计分析及图表制作,并计算杂交F1代的抗感分离比、变异系数(CV)、遗传传递力(Ta)、优势率(H)等[6]。
抗感分离比 = 抗性植株(0级+1级)数量/感病植株(2级+3级+4级)数量∶1,变异系数(CV)= 标准差/F×100%;遗传传递力(Ta)=F/MP×100%;优势率(H)=(F-MP)/[0.5(P1+P2)]×100%;超低亲率(LL)= 低于低病级亲本的F1代数量/F1代总数量×100%。其中,F为F1代病级的平均值,MP为中亲值,P1为母本病级,P2为父本病级。
2 结果与分析
2.1 梨树枝干轮纹病病原菌的鉴定
经分离获得3株梨枝干轮纹病的病原菌,编号分别为LW1-1、LW1-2和LW1-3,在PDA培养基上培养,菌落初为白色,培养7 d后,菌落表面逐渐变为灰黑色蓬松绒毛状,背面呈灰黑色(图1);经测序,获得546 bp序列, BLASTn比对分析,与砂梨上分离的轮纹病菌Botryosphaeriadothidea(GenBank: MG595271)同源性达100%,通过构建基于ITS序列的系统发育树可知,3个菌株均与Botryosphaeriadothidea(GenBank: MG595271、AY236949、KF766151)聚在同一分支(图2)。根据分子鉴定结果,将梨树枝干轮纹病的病原菌定为葡萄座腔菌科(Botryosphaeriaceae)葡萄座腔菌属(Botryosphaeria)的葡萄座腔菌(B.dothidea)。

图1 梨树枝干轮纹病病原菌Fig.1 Pathogen of pear ring rot
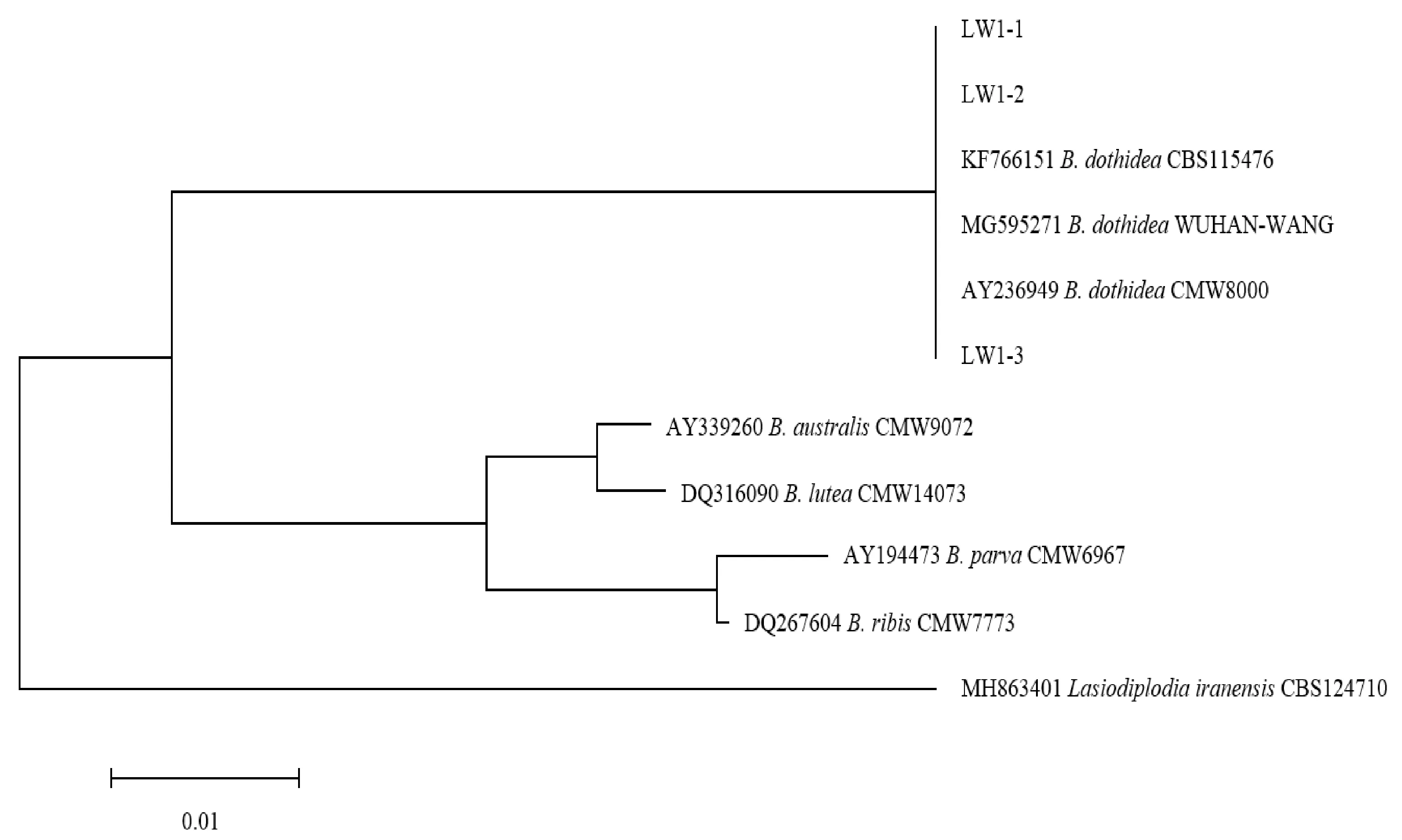
图2 基于ITS序列构建的梨树枝干轮纹病病原菌及相关真菌的系统发育树Fig.2 Phylogenetic tree based on ITS sequences of pathogen of pear ring rot and related fungi
2.2 F1代枝干轮纹病的发病情况
2017年的田间调查结果显示,1 652个F1代单株的枝干轮纹病发病率为21.07%,各杂交组合后代发病率为7.16%~40.15%,其中发病率最高的组合为‘苹果梨×八月红’,其次为‘八月红×红香酥’,发病率为33.54%;实生后代感病植株最多的组合为‘苹果梨×八月红’,感病植株达到41株,但是实生后代感病植株比例最高的组合为‘八月红×红香酥’,感病植株比例为 10.22%;发病率最低的组合为‘锦丰×黄冠’,其感病植株比例也最低,仅为0.57%(表1)。

表1 7个梨杂交组合F1代轮纹病不同等级植株数量和比例(2017年)Table 1 Number and proportion of different disease severities in F1 generation of seven pear cross combinations in 2017
2018-2020年,F1代的枝干轮纹病发病率分别为21.97%、22.52%和23.31%,虽逐年增加,但是与2017年相比,仅增加37株患病植株,其中1级增加33株,2级增加3株,3级增加1株,各级别病情基本维持稳定(表2)。
至2020年,7个杂交组合F1代单株发病率为8.31%~42.89%,其中‘苹果梨×八月红’组合F1代发病率最高,其次为‘八月红×红香酥’,F1代发病率为37.20%;感病单株最多的组合为‘苹果梨×八月红’,感病植株达到44株,F1代感病单株比例最高的组合为仍为‘八月红×红香酥’,感病比例为15.86%;发病率最低的组合为‘锦丰×黄冠’,其感病比例也最低,仅为 0.57%。各组合F1代抗病比例均在80%以上,‘锦丰×黄冠’组合F1代抗病比例达到99.03%(表2)。

表2 7个梨杂交组合后代轮纹病不同等级植株数量和比例(2020年)Table 2 Number and proportion of different disease severities in F1 generation of seven pear cross combinations in 2020
2.3 梨轮纹病抗性的遗传分析
通过室内离体接种鉴定,8个亲本品种中‘苹果梨’‘早酥’‘黄冠’‘中梨1号’和‘中矮1号’均表现抗病,病害级别为1级,而‘八月红’‘红香酥’和‘锦丰’表现感病,其中‘八月红’和‘锦丰’的病害级别为3级,‘红香酥’的病害级别达到4级(表3)。

表3 8个梨品种的轮纹病抗性Table 3 Resistanse of eight pear cultivars to ring rot
根据病级分级标准,0级(高抗)和1级(抗病)均为对枝干轮纹病表现抗病的植株,而2级(感病)、3级(中感)和4级(高感)均为对枝干轮纹病表现感病的植株,7个杂交组合F1代的抗感分离比在5.31∶1~173.5∶1,其中不同抗性亲本杂交,F1代抗感分离比在8.11∶1~173.5∶1。各杂交组合中抗感分离比最高的是‘锦丰×黄冠’,为173.5∶1,其亲本抗性类型为“感病×抗病”,同样‘锦丰’作为感病母本,与抗病父本‘中梨1号’杂交后,其F1代群体的抗感分离比也较高,为61.4∶1。两个抗病亲本‘早酥’与‘黄冠’杂交,其F1代抗感分离比为44.6∶1,‘早酥’作为父本,与抗病的‘中矮1号’杂交,其抗感分离比则为32.0∶1。以抗病的‘苹果梨’为母本,分别以感病的‘八月红’和‘红香酥’为父本,F1代群体的抗感分离比分别为8.11∶1和12.2∶1。以感病亲本‘八月红’为母本,以感病亲本‘红香酥’为父本,F1代抗感分离比最低,为5.31∶1(表4)。
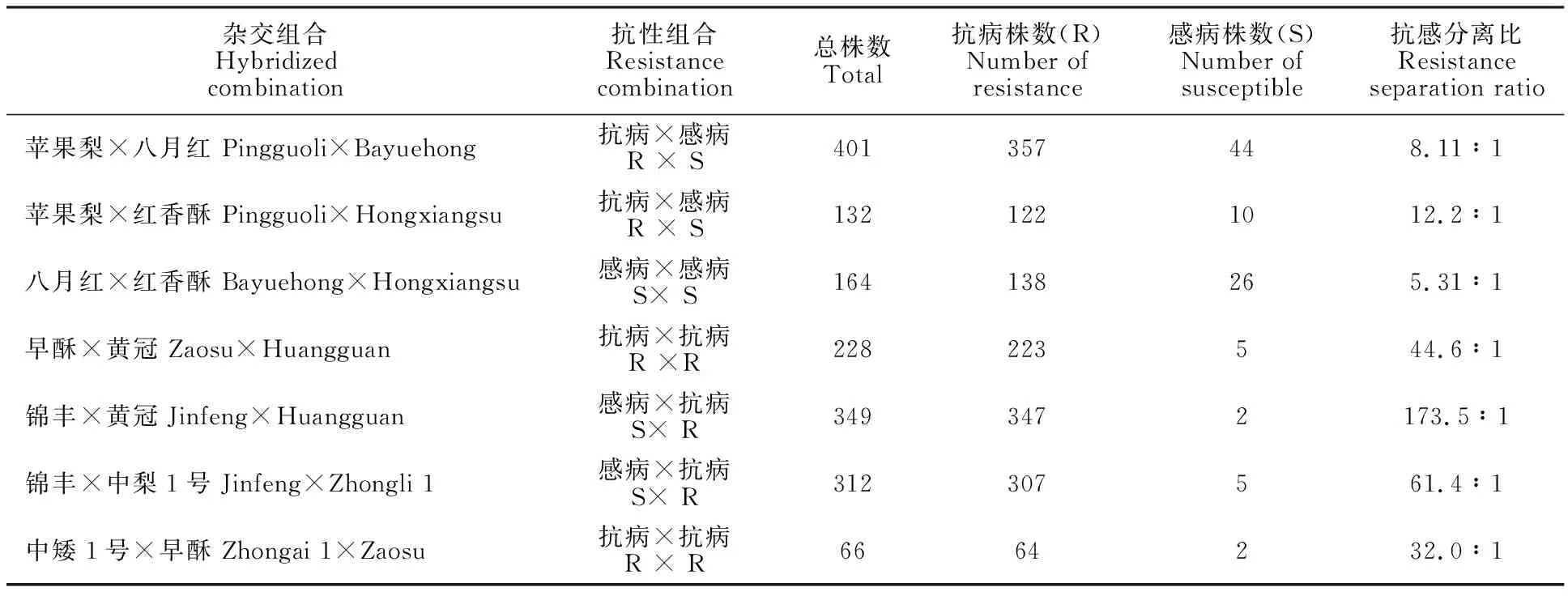
表4 7个杂交组合后代的抗感分离比Table 4 Resistance separation ratio of seven hybrid combinations
以上结果表明,梨树杂交后代对枝干轮纹病的抗性是复杂的多基因控制的数量性状;以抗病品种为母本,当父本为抗病品种时,抗感比较高,当父本为感病品种时,抗感比较低;同样以感病品种为母本,当父本为抗病品种时,抗感比也较高,当父本为感病品种时,抗感比较低;即无论母本为抗病品种还是感病品种,当父本为抗病品种时,F1代的抗感比较高,而当父本为感病品种时,抗感比较低,表明父本的抗性对杂交后代影响较大。
通过遗传倾向分析,7个杂交组合F1代的变异系数均较大,大于或等于145.00%,甚至达到 333.33%,说明F1代中枝干轮纹病抗性分离极其广泛,F1代均值均低于中亲值,超低亲率大于或等于57.11%,甚至达到92.07%,表现出低低亲遗传倾向,即F1代更趋向于抗枝干轮纹病的遗传 (表5)。
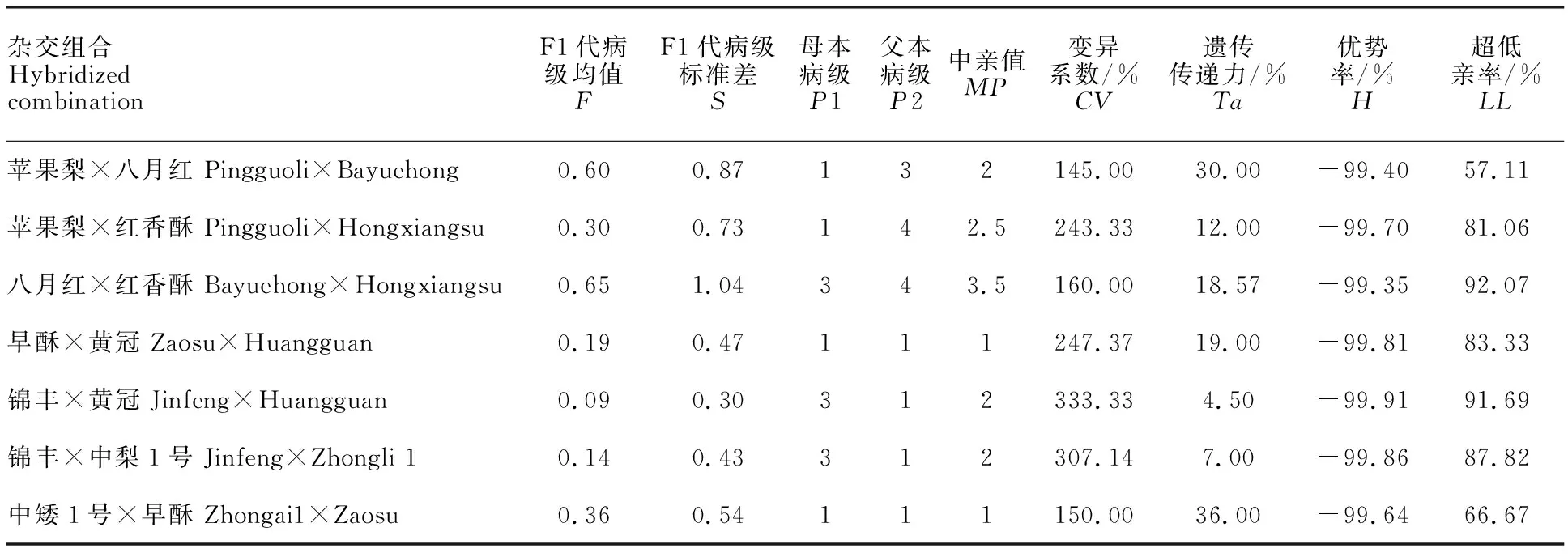
表5 7个杂交组合后代的遗传倾向Table 5 Genetic tendency of resistance of seven hybrid combinationsto ring rot
3 讨论与结论
3.1 梨与苹果枝干轮纹病病原菌的差异
本研究鉴定的梨树枝干轮纹病病原菌为葡萄座腔菌(B.dothidea),与吕刚[2]、汪来宝等[9]的鉴定结果相同。梨枝干轮纹病与苹果枝干轮纹病症状相似,前期认为二者病原菌相同,均为葡萄座腔菌(B.dothidea)[10],但是Xu等[11]采用形态学和多基因系统发育分析研究认为:苹果枝干轮纹病菌有2个种,葡萄座腔菌(B.dothidea)和粗皮葡萄座腔菌(B.kuwatsukai),其中葡萄座腔菌在枝干上引起的病瘤直径较小,一般小于1 mm,而粗皮葡萄座腔菌引起的病瘤直径较大,并造成粗皮,他们还发现离体接种梨枝条时,葡萄座腔菌不产生病瘤,而粗皮葡萄座腔菌则能产生病瘤。本研究并未采用多基因系统发育分析进行菌株的鉴定,采集的样本病瘤有大有小,但是通过真菌ITS通用分子鉴定方法,将采集分离的菌株鉴定为葡萄座腔菌,且在梨品种抗病性离体鉴定中发现,葡萄座腔菌可以致病。
3.2 梨树对枝干轮纹病的抗性为多基因控制的数量性状
亲本及其F1代的抗病性分析是挖掘轮纹病抗性基因的基础,本研究对8个亲本品种进行离体抗病性鉴定,发现‘苹果梨’‘早酥’‘黄冠’‘中梨1号’和‘中矮1号’均表现抗病,而‘八月红’‘红香酥’和‘锦丰’表现感病,鉴定结果与李树玲等[3]、李晓刚等[5]、姜淑苓[12]、魏树伟等[13]的鉴定结果基本一致。可以其为依据进行F1代抗病性的遗传分析。
通过对F1代进行田间自然发病调查和遗传分析,发现F1代性状分离十分广泛,抗感比在 5.31∶1~173.5∶1,表明梨树对轮纹病的抗性表现为多基因控制的数量性状,这与李晓刚等[5]、朱红艳等[14]的研究结果相似,然而是否存在主效基因,是否为多个微效基因控制,仍不清楚。另外,李晓刚等[5]分析发现以抗病品种作母本较其作父本可获得更高比例的抗病单株,而本研究结果却发现无论母本为抗病品种还是感病品种,父本为抗病品种可获得更高比例的抗病单株,本研究中各杂交组合的F1代中抗病单株比例均高于80%,与李晓刚等[5]的研究结果不同,这可能与不同的抗性分级标准有关,本研究认为发病级别为1级仍为抗病单株,而李晓刚等[5]则认为只有0级为抗病单株。
本研究表明:梨树对轮纹病的抗性表现为多基因控制的数量性状,因此,在抗病基因和抗病分子标记的挖掘中可运用构建遗传连锁图谱、QTL定位和BSA分析等方法。例如在苹果上,刘志[15]调查表明苹果枝干和果实轮纹病的抗性由核主效基因控制,与细胞质无明显相关;崔镁沙等[16]运用SSR图谱和苹果基因组信息,获得29个与苹果果实轮纹病抗病性相关的QTL位点。由于本研究中,F1代单株的抗性数据是采用病害等级进行记录和分析的,在遗传连锁图谱构建、QTL分析等方面存在缺陷,未来应该记录每一个单株的病斑面积或者病斑面积的占比,从而进行较为精确地遗传连锁图谱的构建和QTL分析,较为精确地定位抗性基因或抗性相关分子标记,另外,本研究只进行了枝干轮纹病的调查和鉴定,对果实轮纹病和叶片轮纹病未做调查和鉴定,其发病情况和抗性遗传规律是否如此,还需要在以后的研究中继续探索。
通过遗传分析,本研究结果显示:梨树对枝干轮纹病的抗性是多基因控制的数量性状,F1代中枝干轮纹病抗性分离极其广泛,但是更倾向于抗枝干轮纹病的遗传方向,尽管如此,当双亲为感病品种时,后代感病单株比例更高,抗病品种作为父本,后代抗病单株比例更高,即父本的抗性对F1代的影响较大。本研究结果为进一步构建梨轮纹病抗性遗传连锁图谱、开展梨轮纹病抗性基因的QTL定位、挖掘和分离抗性基因提供了依据,为分子辅助梨抗病育种奠定了基础,对优质、抗轮纹病梨新品种的选育具有一定意义。

