改良柱前荧光胺衍生化-高效液相色谱法测定猪肉中11 种磺胺类药物残留
王晓茵 宋翠平 孙晓亮 李木子 曹旭敏 秦立得 王淑婷 隋金钰 王玉东 赵思俊

摘 要:建立改良的磺胺类药物与荧光胺反应的衍生化方法,并应用于猪肉中11 种磺胺类药物的高效液相色谱-荧光法测定。选用0.1 mol/L KH2PO4溶液(pH 3.0)0.8 mL、0.3 mg/mL荧光胺溶液0.2 mL与磺胺类药物发生衍生化反应,4 ℃避光反应40 min,得到磺胺-荧光胺衍生产物。该衍生化方法稳定、可靠,衍生化产物在4 ℃条件下12 h内维持良好的稳定性。猪肉样品经0.1 mol/L KH2PO4溶液提取,HLB固相萃取柱净化,经该方法衍生化后进行高效液相色谱测定。结果表明:11 种磺胺类药物在1~200 μg/L质量浓度范围内表现出良好的线性关系(R2≥0.999 4);方法的定量限为0.8~1.6 μg/kg;在2、50、100 μg/kg 3 个加标水平下,11 种磺胺类药物的加标回收率为62.0%~108.0%,日内、日间相对标准偏差分别为2.0%~8.8%和1.8%~8.6%。
关键词:磺胺;荧光胺;衍生化;猪肉;高效液相色谱-荧光法
Determination of 11 Sulfonamide Residues in Pork by Modified Fluorescamine Precolumn Derivatization-High Performance Liquid Chromatography with Fluorescence Detection
WANG Xiaoyin, SONG Cuiping, SUN Xiaoliang, LI Muzi, CAO Xumin, QIN Lide, WANG Shuting, SUI Jinyu, WANG Yudong, ZHAO Sijun*
(China Animal Health and Epidemiology Center, Qingdao 266032, China)
Abstract: An analytical method using high performance liquid chromatography (HPLC) with fluorescence detection after modified precolumn derivatization with fluorescamine was established for the determination of 11 sulfonamide residues in pork. The optimized reaction conditions were as follows: 0.8 mL of phosphate buffer (0.1 mol/L, pH 3.0) and 0.2 mL of fluorescamine solution (0.3 mg/mL) were mixed, vortexed, and kept in darkness at 4 ℃ for 40 min. The derivatization method was stable and reliable and the resulting product was stable for 12 h at 4 ℃. The sample was extracted with
0.1 mol/L phosphate buffer solution, purified by an HLB solid phase extraction column, and then derived by this method, before being analyzed by HPLC. The calibration curves for the 11 sulfonamides showed a good linear relationship in the concentration range between 1 and 200 μg/L with a correlation coefficient higher than 0.999 4. The limit of quantification for the analytes was 0.8–1.6 μg/kg. At spiked concentrations of 2, 50 and 100 μg/kg, the developed method showed excellent recoveries ranging from 62.0% to 108.0% with intra- and inter-relative standard deviations (RSDs) of 2.0% to 8.8% and 1.8% to 8.6%, respectively.
Keywords: sulfonamides; fluorescamine; derivatization; pork; high performance liquid chromatography-fluorescence detection
DOI:10.7506/rlyj1001-8123-20210810-198
中圖分类号:TS251.1 文献标志码:A 文章编号:1001-8123(2022)02-0033-06
引文格式:
王晓茵, 宋翠平, 孙晓亮, 等. 改良柱前荧光胺衍生化-高效液相色谱法测定猪肉中11 种磺胺类药物残留[J]. 肉类研究, 2022, 36(2): 33-38. DOI:10.7506/rlyj1001-8123-20210810-198. http://www.rlyj.net.cn
WANG Xiaoyin, SONG Cuiping, SUN Xiaoliang, et al. Determination of 11 sulfonamide residues in pork by modified fluorescamine precolumn derivatization-high performance liquid chromatography with fluorescence detection[J]. Meat Research, 2022, 36(2): 33-38. DOI:10.7506/rlyj1001-8123-20210810-198. http://www.rlyj.net.cn
磺胺类药物是一类以对氨基苯磺酰胺为基本母核结构的合成抗菌药物,具有广谱抗菌性,而且价格低廉,作为预防、治疗细菌感染性疾病的药物被广泛应用于畜禽养殖过程中[1-3]。然而,由于在畜禽养殖过程中存在不合理使用甚至滥用药物的情况,极易导致其在畜禽产品中的残留,对人类健康产生极大的威胁和危害[4-6],为此,我国规定动物组织中磺胺类药物总最大残留限量为100 μg/kg[7]。
国内外学者对磺胺类药物残留的检测方法开展了广泛研究,包括液相色谱技术[8-11]、液相色谱-质谱联用技术[12-15]、免疫学分析法[16-18]和毛细管电泳法[19-20]等,其中,液相色谱和液相色谱-质谱联用技术以其高分辨率和高灵敏度被普遍应用。液相色谱-质谱联用技术能够同時分析多种物质,方法的准确性和灵敏度高,但仪器设备价格昂贵,且对操作人员要求较高。而采用高效液相色谱-紫外检测器进行检测时,由于大多数磺胺类药物的最佳紫外吸收波长为270~280 nm,但是该波长范围选择性较低,而且动物组织中的蛋白(最大吸收波长为280 nm左右)及其他共萃取物极易对分析过程产生干扰,容易造成误判现象。
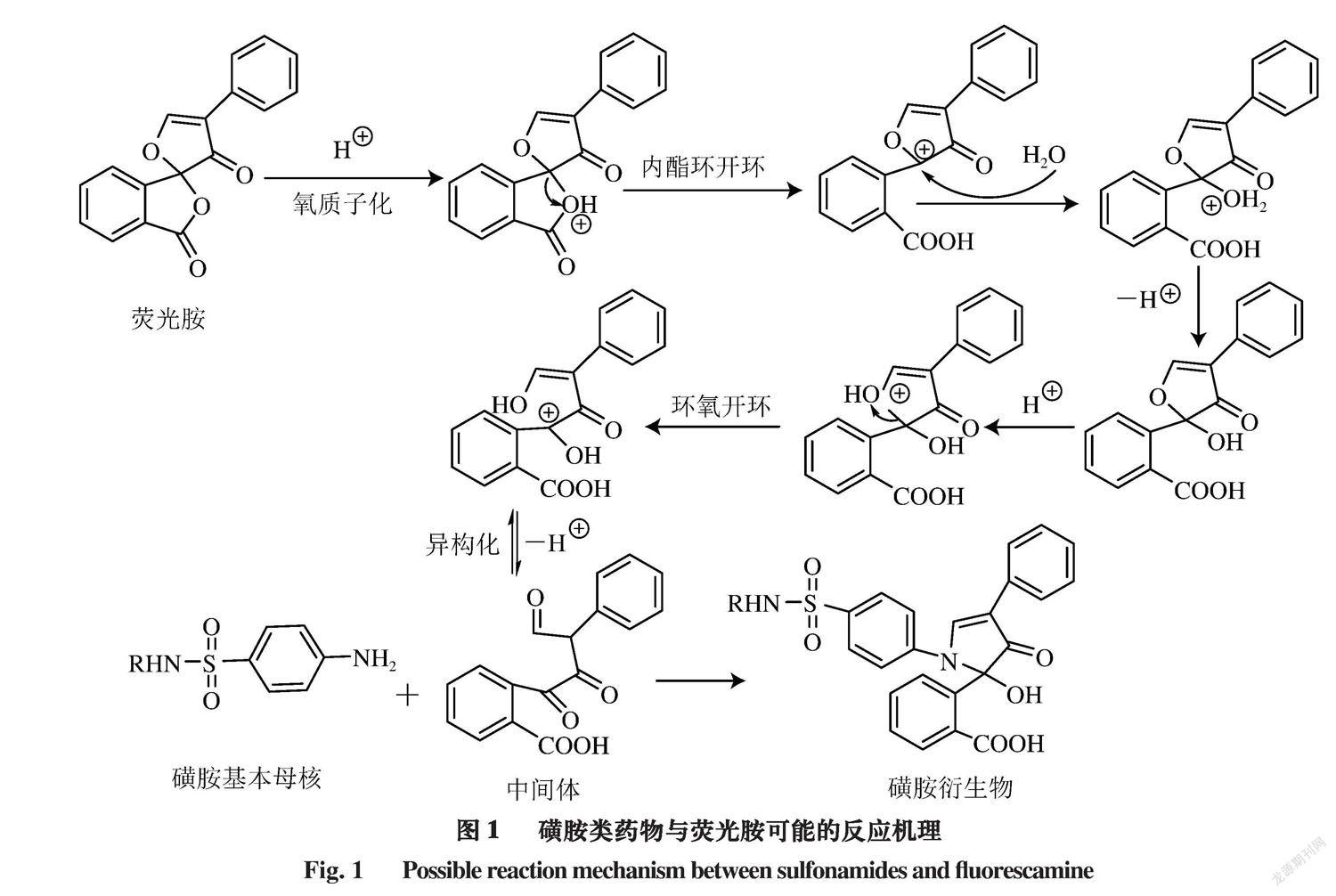
磺胺类药物分子中磺酰胺的对位氨基(伯胺)活泼性高,可与衍生试剂荧光胺进行反应,生成具有荧光特性的磺胺衍生物[21],而非伯胺类化合物不发生类似反应。通常,在酸性条件下,荧光胺中的氧原子被质子化后,带有正电荷,向相邻环的碳原子吸引电子,削弱了C-O键,内酯环开环,使碳原子带有部分正电荷,溶液中的水进攻碳正离子,然后失去氢离子,得到环氧化合物继续质子化、异构化,得到中间体羰基化合物;然后磺胺中活泼的伯氨基与中间体化合物的羰基发生缩合反应,成环,最终得到磺胺衍生物(图1)。
荧光胺与磺胺类药物发生衍生化反应,产物具有很高的荧光强度,利用荧光检测器测定,可有效降低其他组分的干扰,提高检测的灵敏度和可靠性[22-24]。但由于该衍生化产物性质不稳定,会随着时间延长逐渐分解,需要在短时间内完成测定,否则容易影响定量的准确性,这对批量检测样品工作带来极大不便。鉴于荧光衍生产物易分解,导致定量不准确、批量检测工作不方便等原因,针对目前磺胺类药物多残留检测的实际需要,本研究根据磺胺类药物与荧光胺可能发生的反应机理,对影响衍生化反应的各个因素系统地进行选择、优化,确定维持衍生化反应产物稳定性的方法。对猪肉样品的磺胺-荧光胺衍生产物经高效液相色谱法测定,大大提高了方法的准确度和实用性。
1 材料与方法
1.1 材料与试剂
50 份猪肉样品,均随机购自青岛市各农贸市场。
荧光胺(纯度≥99%) 美国Sigma公司;乙腈(色谱纯) 德国Merck公司;甲酸(色谱纯) 上海安谱实验科技股份有限公司;KH2PO4(分析纯) 国药集团化学试剂有限公司。
磺胺类药物标准品:磺胺二甲异嘧啶(sulfisomidine,SM2,纯度94.0%)、磺胺嘧啶(sulfadiazine,SD,纯度99.1%)、磺胺二甲嘧啶(sulfamethazine,SM2,纯度99.4%)、磺胺间甲氧嘧啶(sulfamonomethoxine,SMM,纯度98.0%)、磺胺甲噻二唑(sulfamethizole,STZ,纯度99.3%)、磺胺对甲氧嘧啶(sulfamethoxydiazine,SMD,纯度98.0%)、磺胺邻二甲氧嘧啶(sulfadoxine,SDO,纯度99.1%)、磺胺甲恶唑(sulfamethoxazole,SMZ,纯度99.5%)、磺胺间二甲氧嘧啶(sulfadimethoxine,SDM,纯度99.4%) 德国Dr. Ehrenstorfer公司;磺胺甲氧吡嗪(sulfamethoxypyrazine,SMPZ,纯度98%) 加拿大TRC公司;磺胺曲沙唑(sulfatroxazole,STX,纯度99.8%) 澳大利亚国家计量研究院。
1.2 仪器与设备
e2695高效液相色谱仪(配备Waters 2475荧光检测器) 美国Waters公司;Centrifuge 5804 R台式高速冷冻离心机 德国Eppendorf公司;MilliQ超纯水仪 美国Millipore公司;N-EVAP 112氮吹仪 美国Organomation公司;Oasis HLB固相萃取柱(60 mg,3 mL) 美国Waters公司。
1.3 方法
1.3.1 溶液配制
磺胺类药物标准储备液(100 μg/mL):精密称取各磺胺类药物标准品2.5 mg,分别置于25 mL棕色容量瓶中,甲醇溶解定容至刻度,-20 ℃保存。磺胺类药物混合标准工作液(1.0 μg/mL):准确量取各标准储备液100 μL于10 mL棕色容量瓶中,混匀,并用甲醇稀释定容至刻度。磺胺类药物混合标准工作液(0.1 μg/mL):准确量取1.0 μg/mL的混合标准工作液1 mL于10 mL棕色容量瓶中,混匀,并用甲醇稀释定容至刻度。-20 ℃保存。
提取溶液(0.1 mol/L KH2PO4):取KH2PO4 6.80 g,用超纯水溶解并定容至500 mL。
衍生溶液(0.1 mol/L KH2PO4,pH 3.0):取KH2PO4 0.68 g,超纯水溶解,并用0.1 mol/L H3PO4溶液调节pH值至3.0,最后用超纯水定容至50 mL。
衍生试剂(0.3 mg/mL荧光胺):精确称取荧光胺7.50 mg,丙酮溶解并定容至25 mL。
1.3.2 样品前处理
取猪肉样品,经匀浆制备成肉糜状,准确称取(5.00±0.01) g于50 mL具塞离心管中,加入提取液10 mL,多管涡旋仪涡旋5 min,8 000 r/min离心8 min后倒出上清液;重复提取1 次,合并上清液,混匀;取5 mL合并后的上清液,加入经3 mL甲醇、3 mL水活化的HLB固相萃取柱,分别用3 mL水和3 mL体积分数20%甲醇水溶液淋洗,真空抽干后用3 mL甲醇洗脱,45 ℃水浴氮气吹干,待用。
1.3.3 衍生化反应
经前处理后的样品,加入0.1 mol/L KH2PO4(pH 3.0)溶液0.8 mL涡旋溶解,再加入0.3 mg/mL荧光胺溶液0.2 mL,混合均匀后,4 ℃条件下反应40 min,待测。
1.3.4 色谱条件
色谱柱:Waters Symmetry C18柱(4.6 mm×250 mm,5 μm);柱温25 ℃;流速1.0 mL/min;进样量10 μL;检测波长:激发波长405 nm,发射波长495 nm;流动相:A为体积分数0.2%甲酸水溶液,B为乙腈;梯度洗脱程序如下:0~3.0 min,流动相A体积分数66%;3.0~15 min,流动相A体积分数线性变化至60%;15~30 min,流动相A体积分数保持60%;30~33 min,流动相A体积分数线性变化至66%;33~35 min,流动相A体积分数保持66%。
1.4 数据处理
折线图采用Graphpad Prism 5软件绘制;色谱图采用Waters Empower 2工作站进行数据采集和处理,自动计算拟合线性回归曲线。
2 结果与分析
2.1 衍生化反应条件优化
磺胺类药物中含有芳香伯氨基,在酸性溶液中加入一定浓度的荧光胺衍生试剂,11 种磺胺类药物都显示出良好的反应活性,室温下反应40 min衍生产物峰面积最大,并基本稳定,但是,随着时间的延长,衍生产物会发生降解,24 h后基本衰减完全,严重影响准确定量。为了更好地应用于日常检测工作,本研究根据衍生化反应可能发生的反应机理,对该衍生化反应条件加以优化。主要从衍生溶液pH值、衍生反应时间、荧光胺质量浓度等方面进行研究,以期得到最优反应条件。
2.1.1 衍生溶液pH值对峰面积的影响
根据磺胺与荧光胺的反应机理,衍生溶液的pH值对衍生化反应的影响至关重要,分别对不同pH值條件下(pH 3.0、7.0、10.0)衍生化产物峰面积进行比较。在碱性条件下(pH 10.0),衍生化产物几乎没有响应;在中性条件下(pH 7.0)响应很微弱,而在酸性条件下(pH 3.0)响应明显增强。
为进一步确认最佳溶液pH值,在pH 2.0~7.0做加密测试,由图2可知,在pH 2.0~5.0范围内均可获得较强的荧光强度,而且低pH值条件可降低荧光产物的衰减速率,因此,选择pH 3.0的KH2PO4缓冲溶液。
2.1.2 衍生反应时间对峰面积的影响
比较衍生化反应0~100 min产物的峰面积,由图2可知:反应时间0~40 min时,随着时间延长,峰面积增大;40~80 min峰面积趋于稳定,80 min后衍生产物峰面积开始下降,因此,选择40 min作为衍生化反应时间。
2.1.3 荧光胺质量浓度对峰面积的影响
不同质量浓度荧光胺溶液(0.1、0.2、0.3、0.4、0.5 mg/mL)对衍生反应有影响。由图2可知,随着荧光胺质量浓度的升高,衍生化产物峰面积逐渐增大,当荧光胺质量浓度达到0.3 mg/mL时,峰面积达到最大并趋于稳定,因此,选用0.3 mg/mL荧光胺溶液。
2.1.4 衍生产物的反应条件对峰面积的影响
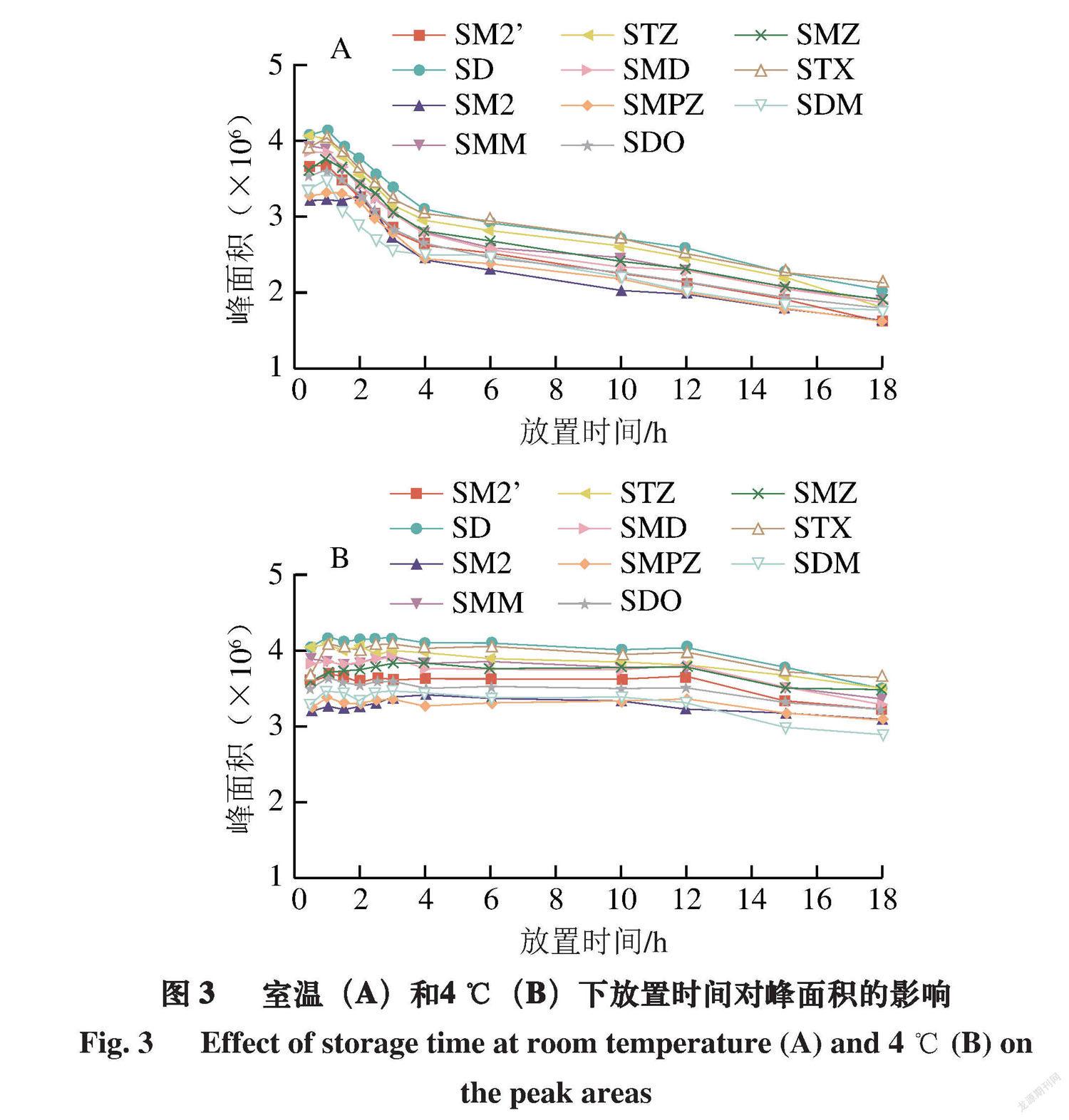
磺胺-荧光胺衍生产物稳定性差,室温下长时间放置衍生产物会逐渐衰减,对准确定量造成影响。为此,衍生化后的样品分别在室温和4 ℃下避光保存,分别于0.5、1.0、1.5、2.0、2.5、3.0、4.0、6.0、10.0、12.0、15.0、18.0 h测定。室温条件下,衍生产物在80 min内稳定,随后开始降解(图2和图3);而在4 ℃条件下,衍生产物在12 h内维持稳定,未出现显著衰减情况(图3)。因此,本方法采用低温条件进行反应和检测,可实现批量样品的筛查分析。
11 种磺胺类药物具有相似的化学结构,且SMM与SMD、SDO与SDM互为同分异构体,增加了液相色谱分离的难度。考察XBridge Shield RP 18(4.6 mm×250 mm,5 μm)、Symmetry C18(4.6 mm×250 mm,5 μm)、Symmetry C18(4.6 mm×150 mm,5 μm)3 种色谱柱对目标化合物的分离效果。结果表明,3 种色谱柱均能有效保留11 种化合物,但XBridge Shield RP 18和Symmetry C18(4.6 mm×150 mm,5 μm)分离效果不好,色谱峰得不到完全分离。而Symmetry C18色谱柱(4.6 mm×250 mm,5 μm)在35 min内可有效分离11 种磺胺类药物。图4为该色谱柱条件下空白猪肉样品和空白猪肉添加11 种磺胺类药物后的色谱图。
2.3 方法學评价
2.3.1 标准曲线、相关系数、检出限和定量限
配制不同质量浓度(1、5、10、20、50、100、200 μg/L)的11 种磺胺类药物混合标准溶液,按照1.3.3节方法衍生化后,经高效液相色谱-荧光检测器检测,以各药物峰面积(y)为纵坐标,标准溶液质量浓度(x,μg/L)为横坐标,进行线性回归。
由表1可知,11 种磺胺类药物在1~200 μg/L质量浓度范围内呈现良好的线性关系(R2≥0.999 4)。分别以3 倍和10 倍信噪比对应的质量浓度,计算本方法测定猪肉样品中磺胺类药物的检出限和定量限,其中SM2、SD、SM2、SMM、STZ和SMD的检出限为0.3 μg/kg,定量限为0.8 μg/kg,SMPZ、SDX、SMZ和STX的检出限为0.4 μg/kg,定量限为1.2 μg/kg,SDM的检出限为0.5 μg/kg,定量限为1.6 μg/kg。
2.3.2 准确度、精密度和灵敏度
在空白猪肉中添加11 种磺胺类药物混合标准工作液,加标量分别为2、50、100 μg/kg,进行加标回收实验,考察方法的加标回收率、日内和日间相对标准偏差(relative standard deviation,RSD)。由表2可知,11 种磺胺类药物的平均加标回收率为62.0%~108.0%,日内RSD为2.0%~8.8%,日间RSD为1.8%~8.6%。
2.4 方法比较
本研究比较了高效液相色谱-紫外法、柱前和柱后衍生高效液相色谱-荧光法测定猪肉中磺胺类药物残留量的方法,其中,高效液相色谱-紫外法选择性低,杂峰干扰明显,信号峰弱;柱后衍生法是在线衍生,从进样器吸取样品到检测器检测到信号,磺胺类药物不能在短时间内完全反应,荧光响应值明显低于柱前衍生法。磺胺与荧光胺反应得到的衍生化产物稳定性差,有文献报道要在1 h内完成测定[25-26],否则会影响定量的准确性;而在本研究中,4 ℃条件下衍生化产物维持12 h不发生衰减。综上,在本研究条件下,方法的定量限低(0.8~1.6 μg/kg)、杂质干扰程度低、信号峰响应高、重现性好,提高了方法的准确性和批量操作的可靠性。
2.5 方法应用
使用GB/T 20759—2006《畜禽肉中十六种磺胺类药物残留量的测定 液相色谱-串联质谱法》和本方法对青岛市各农贸市场随机抽取的50 份猪肉样品中磺胺类药物残留进行测定,结果表明,有1 份样品SM2为阳性,2 种方法测定得到样品中SM2的残留量分别为190、192 μg/kg,无明显差异,表明本方法准确、可靠,可用于基层猪肉样品中磺胺类药物残留的检测。
3 结 论
根据磺胺类药物与荧光胺可能发生的反应机理,对衍生化反应条件进行系统优化,建立荧光胺柱前衍生-高效液相色谱检测猪肉中11 种磺胺类药物残留的分析方法。该方法灵敏度高、重复性好而且对仪器设备要求不高,操作快速简便,可用于畜产品质量安全监测,如批量样品中磺胺类药物残留的筛查和确证工作,为基层一线的实际检测提供可靠的技术支持。
参考文献:
[1] 靳红果, 张瑞, 王颖, 等. 我国猪肉中磺胺类药物的残留特征分析[J]. 肉类研究, 2017, 31(10): 31-35. DOI:10.7506/rlyj1001-8123-201710006.
[2] 王玉可, 欧亚红, 张莉蕴, 等. 动物源性食品和环境中磺胺类药物及其代谢物检测的样品前处理技术研究进展[J]. 中国畜牧兽医, 2019, 46(10): 3032-3041. DOI:10.16431/j.cnki.1671-7236.2019.10.025.
[3] WANG Jie, HU Qiuhui, LI Peng, et al. Comparison of the three different lipid removal cleanup techniques prior to the analysis of sulfonamide drug residues in porcine tissues[J]. Food Science and Nutrition, 2019, 7: 3006-3016. DOI:10.1002/fsn3.1158.
[4] LYE L L, BONG C W, LEE C W, et al. Anthropogenic impacts on sulfonamide residues and sulfonamide resistant bacteria and genes in Larut and Sangga Besar River, Perak[J]. Science of the Total Environment, 2019, 688: 1335-1347. DOI:10.1016/j.scitotenv.2019.06.304.
[5] PETRARCA M H, BRAGA P A C, REYES F G R, et al. Hydrophilic interaction liquid chromatography coupled to quadrupole time-of-flight mass spectrometry as a potential combination for the determination of sulfonamide residues in complex infant formula matrices[J]. Journal of Chromatography A, 2020, 1633: 461606. DOI:10.1016/j.chroma.2020.461606.
[6] HOFF R. Analysis of sulfonamide residues in bovine liver by liquid chromatography-tandem mass spectrometry without chemical extraction or clean-up procedures[J]. Analytical Biochemistry, 2020, 611: 114011. DOI:10.1016/j.ab.2020.114011.
[7] 中华人民共和国农业农村部, 中华人民共和国国家卫生健康委员会, 国家市场监督管理总局. 食品安全国家标准 食品中兽药最大残留限量: GB 31650—2019[S]. 北京: 中国标准出版社, 2019.
[8] 余佩瑶, 陈传胜, 刘寒冰, 等. 固相萃取-高效液相色谱法同时测定鸡粪中四环素类、喹诺酮类和磺胺类抗生素[J]. 色谱, 2019, 37(5): 518-524. DOI:10.3724/SP.J.1123.2017.11006.
[9] KARAGERGOU E, MANOUSI N, SAMANIDOU V, et al. Fabric phase sorptive extraction for the fast isolation of sulfonamides residues from raw milk followed by high performance liquid chromatography with ultraviolet detection[J]. Food Chemistry, 2016, 196: 428-436. DOI:10.1016/j.foodchem.2015.09.060.
[10] HUI Wenli, LI Qiuhui, MA Huiya, et al. Rapid screening for 15 sulfonamide residues in foods of animal origin by high-performance liquid chromatography-UV method[J]. Journal of Chromatographic Science, 2018, 56(7): 636-643. DOI:10.1039/chromsci/bmy037.
[11] BERNAL J, NOZAL M J, JIM?NEZ J J, et al. A new and simple method to determine trace levels of sulfonamides in honey by high performance liquid chromatography with fluorescence detection[J]. Journal of Chromatography A, 2009, 1216: 7275-7280. DOI:10.1016/j.chroma.2009.05.046.
[12] 董丹, 邵兵, 吳永宁, 等. 液相色谱-电喷雾串联四极杆质谱法测定鸡肉中17 种磺胺类药物的残留[J]. 色谱, 2005, 23(4): 404-407. DOI:10.3321/j.issn:1000-8713.2005.04.017.
[13] 马强, 王超, 王星, 等. 超高效液相色谱-串联质谱法同时测定化妆品中的22 种磺胺类药物[J]. 分析化学, 2008, 36(12): 1683-1689. DOI:10.3321/j.issn:0253-3820.2008.12.016.
[14] TETZNER N F, MANIERO M G, RODRIGUES-SILVA C, et al. On-line solid phase extraction-ultra high performance liquid chromatography-tandem mass spectrometry as a powerful technique for the determination of sulfonamide residues in soils[J]. Journal of Chromatography A, 2016, 1452: 89-97. DOI:10.1016/j.chroma.2016.05.034.
[15] 张燕, 赵海霞, 田甜, 等. UPLC-MS/MS法测定蜂蜜中磺胺类抗生素残留[J]. 质谱学报, 2020, 41(5): 480-489. DOI:10.7538/zpxb.2019.0069.
[16] CHEN Min, WEN Kai, TAO Xiaoqi, et al. A novel multiplexed fluorescence polarisation immunoassay based on a recombiant bi-specific single-chain diabody for simultaneous detection of fluoroquinolones and sulfonamides in milk[J]. Food Addtives and Contaminants: Part A, 2014, 31(12): 1959-1967. DOI:10.1080/19440049.2014.976279.
[17] 杜玉玲, 常迪, 吴国英, 等. 磺胺母核单克隆抗体的制备及其免疫学特性研究[J]. 中国食品学报, 2013, 13(12): 139-145. DOI:10.16429/j.1009-7848.2013.12.010.
[18] 王玲, 管笛, 周欣, 等. 磁性化学发光酶免疫法检测猪头中的磺胺類药物[J]. 河北农业大学学报, 2017, 40(3): 100-105. DOI:10.13320/j.cnki.jauh.2017.0065.
[19] DAI Tingting, DUAN Jie, LI Xinghua, et al. Determination of sulfonamide residues in food by capillary zone electrophoresis with on-line chemiluminescence detection based on an Ag(Ⅲ) complex[J]. International Journal of Molecular Sciences, 2017, 18: 1286. DOI:10.3390/ijms18061286.
[20] CHENG Y J, HUANG S H, SINGCO B, et al. Analyses of sulfonamide antibiotics in meat samples by on-line concentration capillary electrochromatography-mass spectrometry[J]. Journal of Chromatography A, 2011, 1218(42): 7640-7647. DOI:10.1016/j.chroma.2011.06.027.
[21] 林德娟, 李隆弟. 荧光胺与芳伯胺衍生反应的介质效应[J]. 光谱学与光谱分析, 1997, 3(17): 10-15.
[22] ARROYO-MANZAANRES N, G?MIZ-GRACIA L, GARC?A-CAMPA?A A M. Alternative sample treatments for the determination of sulfonamides in milk by HPLC with fluorescence detection[J]. Food Chemistry, 2014, 143: 459-464. DOI:10.1016/j.foodchem.2013.08.008.
[23] 黄冬梅, 黄宣运, 顾润润, 等. 柱后衍生高效液相色谱法测定虾中14 种磺胺类药物残留量[J]. 色谱, 2014, 32(8): 874-879. DOI:10.3724/SP.J.1123.2014.04009.
[24] 刘菁华, 孙振中, 黄雪玲, 等. 高效液相色谱法-柱后衍生法检测养殖水体及沉积物中11 种磺胺药物残留[J]. 色谱, 2015, 33(4): 434-440. DOI:10.3724/SP.J.1123.2014.12022.
[25] 苏敏, 李世雨, 许宝香, 等. 荧光胺衍生化液相色谱法检测动物肝脏中10 种磺胺残留方法探讨[J]. 现代仪器, 2008(2): 21-23.
[26] 吴翠琴, 陈迪云, 陈永亨, 等. 荧光胺衍生液相色谱法测定猪肝中10 种磺胺[J]. 分析试验室, 2018, 37(12): 1370-1374. DOI:10.13595/j.cnki.issn1000-0720.2018.0260.
收稿日期:2021-08-10
基金项目:青岛市科技惠民专项(18-6-107-NSH)
第一作者简介:王晓茵(1989—)(ORCID: 0000-0001-8457-4121),女,助理研究员,硕士,研究方向为动物源性食品安全检测及风险评估。E-mail: 550584620@qq.com
通信作者简介:赵思俊(1979—)(ORCID: 0000-0002-8690-7193),男,副研究员,博士,研究方向为动物源性食品安全检测及风险评估。E-mail: zhsjun@126.com

