橙皮苷改善ApoE-/-小鼠动脉粥样硬化的作用机制研究*
范慧婕,赖逸贵,蒋雪峰,王强,李孔正,傅应昌,张为
1.阳江市人民医院,广东 阳江 529500; 2.南方医科大学,广东 广州 510515
《中国心血管病报告 2018》和《中国心血管健康与疾病报告2020概要》指出,我国心血管病死亡率位居首位,占全民死亡率40%以上,给我国经济带来沉重负担,防治心血管疾病刻不容缓[1-2]。动脉粥样硬化(atherosclerotic,AS)是诱发心血管疾病的主要病理生理基础,有效控制AS的发生发展是降低心血管意外发生的关键所在[3]。
AS是一种由于脂质代谢紊乱和免疫失衡引起的慢性炎症疾病。炎症学说是AS最早的发病机制之一,在AS斑块尚未形成的前期,炎症状态就已经出现[4]。研究认为,与AS发生发展关系较为密切的炎症细胞是巨噬细胞,巨噬细胞受到不同刺激时可极化成不同的亚型,而不同的亚型发挥不同的生物学作用,介导AS的发展进程[5]。巨噬细胞分为M1和M2两种,其极化失衡可影响AS的发展进程[6]。巨噬细胞具有可塑性,其极化指的是巨噬细胞在体内外微环境影响下表现出的极端异质性,M1 型巨噬细胞又称为经典激活的巨噬细胞,可由脂多糖 (lipopolysaccharide,LPS)及干扰素等炎症因子刺激而成,主要有促炎作用;M2型巨噬细胞又称为替代激活的巨噬细胞,可由白细胞介素-4(interleukin-4,IL-4)等细胞因子刺激而成,具有抗感染作用[7]。目前,巨噬细胞极化亦是防治AS药物研究的侧重点,调控巨噬细胞极化是防治AS的有效策略之一[8]。
橙皮苷又名陈皮苷、橘皮苷,广泛存在于陈皮、枳实等中药中。研究表明,橙皮苷具有抗氧化、抗肿瘤、降血压、抗炎等药理作用[9-12],但橙皮苷对AS中巨噬细胞极化的作用机制未有深入报道。本研究主要探讨橙皮苷对巨噬细胞的作用。
1 材料
1.1 动物与细胞雄性ApoE-/-小鼠购买自广东省医学实验动物中心,5周龄,60只,体质量 20~22 g;Raw 264.7巨噬细胞购买自中国科学院上海细胞库。
1.2 药物与试剂橙皮苷(成都曼思特生物科技有限公司,货号:A0032);辛伐他汀(美国默沙东公司,批号:18032502);LPS(上海源叶生物科技有限公司,货号:S11060);胎牛血清、RPMI 1640培养液、青链霉素溶液、体积分数0.25%含有EDTA的胰酶(美国Thermo Fisher生物科技有限公司,货号:10100147、A4192301、10378016、2520072);三酰甘油(triglycerides,TG)、总胆固醇(cholesterol,TC)、低密度脂蛋白(lowdensity lipoprotein cholesterol,LDL-C)、高密度脂蛋白(high-density lipoprotein cholesterol,HDL-C)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、重组人精氨酸酶1(arginase-1,ARG1) 、白细胞介素-6(interleukin-6,IL-6)、IL-10试剂盒(南京建成生物工程研究所,货号:A110-1-1、A111-1-1、A113-1-1、A112-1-1、J052-1、H321-1、H009-1、H007-1-1);P-AMPK,AMPK,PPAR-γ,P-P65,P65,GAPDH(美国CST公司,货号:4186S、12063S、2435T、3039S、8242T、5174T)。
1.3 仪器CO2培养箱(美国Thermo公司,型号:3111);离心机(湖南湘仪离心机有限公司,型号:TG16WS);电泳仪(美国Bio-Rad公司,型号:powerpac HC);酶标仪(美国MP公司,型号:ID5)。
2 方法
2.1 动物分组及给药将雄性ApoE-/-小鼠适应性饲养1周后随机分6组,即空白组、模型组、阳性对照组、橙皮苷低剂量组、橙皮苷中剂量组、橙皮苷高剂量组,每组10只。空白组用普通饲料喂养,其余组用高脂饲料(21%脂肪,0.5%胆固醇)喂养16周复制AS模型;阳性对照组于第9周开始在高脂饲料基础上给予辛伐他汀(5 mg·kg-1)灌胃;橙皮苷组于第9周开始在高脂饲料基础上给予橙皮苷低剂量(100 mg·kg-1)、中剂量(200 mg·kg-1)、高剂量(400 mg·kg-1)灌胃。
2.2 观察指标
2.2.1 血脂检测末次给药24 h后,各组小鼠眼球采血,收集血清,按照试剂盒说明书操作检测各组小鼠血清TC、TG、LDL-C、HDL-C含量。
2.2.2 小鼠主动脉根部油红O染色小鼠处死后制备主动脉根部的冰冻切片(厚度10~15 μm)浸泡于甲醇-钙固定液中固定。固定后的切片经水洗,放于体积分数60%异丙醇中,再置于油红O染色液中染色10 min。于体积分数60%异丙醇溶液中稍分化,水洗。置于明矾苏木素液中复染细胞核30~60 s,流水冲洗稍风干,甘油明胶封固,显微镜下观察各组小鼠主动脉血管壁脂质沉积情况,用Image J软件分析小鼠主动脉瓣斑块面积。
2.2.3 小鼠血清TNF-α、IL-6、Arg-1、IL-10检测采用ELISA法检测小鼠血清进行TNF-α、IL-6、Arg-1、IL-10水平。
2.3 分子对接从RCSB PDB数据库 (RCSB PDB,https://www.rcsb.org) 下载AMPK的晶体结构,使用PyMOL软件(2.1.0版本)分离原配体和靶蛋白,用ADT对靶蛋白进行去水、加氢等处理;从PubChem数据库 (Pubchem,https://pubchem.ncbi.nlm.nih.gov/)下载橙皮苷SDF构象,用ADT进行加氢、计算电荷等处理,运用Autodock对接功能,计算受体和配体不同构象的最低结合能,并对不同构象的最低结合能进行排序,运用PyMOL分析和观察活性化合物与靶蛋白的对接结果。
2.4 细胞培养将Raw 264.7细胞以每孔3×105接种于12孔细胞培养板中,模型组加入含 100 pg·L-1LPS的RPMI 1640培养液,空白组加普通RPMI 1640培养液,37 ℃、5%CO2条件下培养48 h。橙皮苷组在模型组基础上加入橙皮苷:橙皮苷低、中、高浓度组分别给予橙皮苷 5 μmol·L-1、10 μmol·L-1、20 μmol·L-1。
2.5 Western Blot法检测细胞相关蛋白表达细胞分组和培养方法同上,提取细胞总蛋白,BCA法检测蛋白浓度,然后进行蛋白变性,配胶(4%浓缩胶,10%分离胶)、上样(每孔上样量为15 μg)、电泳、转膜、封闭、孵育一抗、二抗,最后曝光,以GAPDH为内参,用Image J软件对蛋白条带的灰度值进行分析。
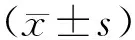
3 结果
3.1 各组小鼠TG、TC、HDL-C及LDL-C水平比较模型组小鼠血清TG、TC、LDL-C水平高于空白组,HDL-C水平低于空白组,差异具有统计学意义(P<0.01),提示模型建立成功。与模型组比较,橙皮苷中剂量组、高剂量组及阳性对照组小鼠血清TG、TC和LDL-C水平降低,HDL-C水平升高,差异具有统计学意义(P<0.05),见表1。
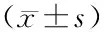
表1 各组小鼠血清中TG、TC、HDL-C及LDL-C水平比较
3.2 各组小鼠主动脉斑块比较与空白组比较,模型组小鼠主动脉瓣血管中发现大量的脂质积累,胶原纤维含量减少,斑块趋于不稳定;与模型组比较,橙皮苷高剂量组和阳性对照组能抑制小鼠血管中脂质的累积,显著减少主动脉内膜增厚,显著减少脂质区域,但阳性对照组优于橙皮苷高剂量组。见图1。与模型组比较,空白组、阳性对照组及橙皮苷高剂量组油红O染色斑块面积减小,见图2。
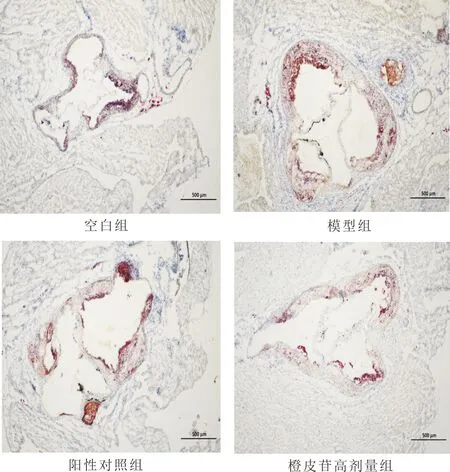
图1 各组小鼠主动脉斑块形成(比例尺:500 μm)
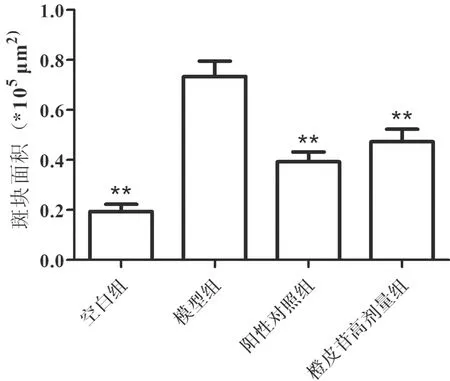
注:与模型组比较,**P<0.01
3.3 各组小鼠TNF-α、 IL-6、Arg-1、IL-10水平比较与模型组比较,空白组、橙皮苷低剂量组、橙皮苷中剂量组、橙皮苷高剂量组TNF-α、 IL-6水平降低,Arg-1、IL-10水平升高,差异具有统计学意义(P<0.01),见图3。
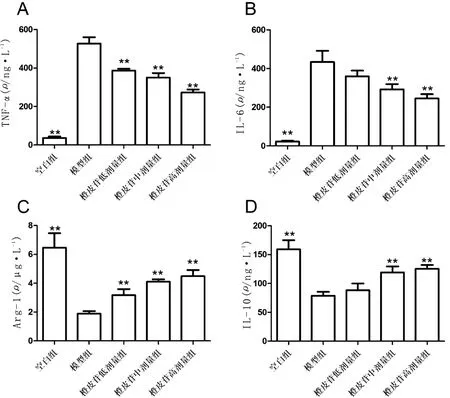
注:A:血清TNF-α含量;B:血清IL-6含量;C:Arg-1含量;D:血清IL-10含量;与模型组比较,**P<0.01
3.4 橙皮苷与AMPK的结合能力的预测使用分子对接程序 AutoDock vina 对橙皮苷与AMPK的结合能力预测,结果提示橙皮苷可以与AMPK的 ILE-46、GLN-109、ASN-111、ASN-110 等残基形成氢键而结合,结合力为-10.158 kcal·mol-1,表明橙皮苷与AMPK有较好的结合能力。橙皮苷与AMPK结合构象见图4。
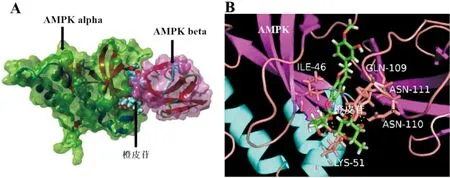
注:A.橙皮苷与AMPK结合的外部示意图;B.橙皮苷与AMPK残基结合的示意图
3.5 橙皮苷对AMPK信号通路相关蛋白表达的影响橙皮苷使LPS诱导的Raw 264.7巨噬细胞p-AMPK、PPAR-γ蛋白表达显著上调,p-P65/P65水平显著降低,差异具有统计学意义(P<0.01),见图5。
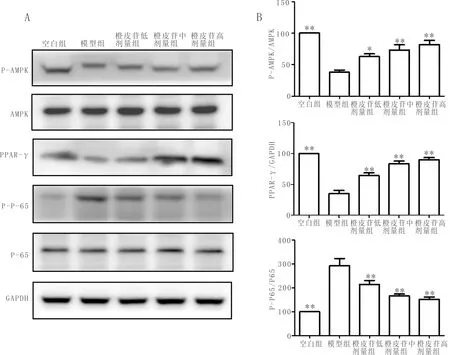
注:A:Raw 264.7细胞的P-AMPK,AMPK,PPAR-γ,P-P65,P65,GAPDH的蛋白表达条带;B:Raw 264.7细胞的p-AMPK,AMPK,PPAR-γ,P-P65,P65,GAPDH的蛋白表达相对值;与模型组比较,*P<0.05,**P<0.01
4 讨论
心血管急性事件一直是心血管疾病防治的重点与难点,AS是其重要的病理生理基础,也是其发病的重要原因之一。研究表明,AS的斑块脂质及其氧化衍生物的暴露可刺激巨噬细胞极化,M1型巨噬细胞极化促进AS的发生发展,而M2性巨噬细胞极化可有效保护AS的发生发展[8]。因此,寻找调控巨噬细胞M2极化的药物是目前研究抗AS的热点之一,而中药是这方面药物的重要来源。既往研究报道,丹参酮IIA、红景天苷、人参皂苷Rb1等可通过调控巨噬细胞极化防止AS斑块的形成[13-15],巨噬细胞极化是防治AS药物的研究热点。研究指出,橙皮苷可有效抑制AS斑块的形成[12],调节多种心血管危险因素包括血脂异常、血糖异常、血压异常等[11],但其对AS巨噬细胞极化的调控作用尚未见有报道。
LPS是研究AS巨噬细胞极化细胞模型的常用诱导剂,可代表AS发生发展过程的慢性炎症改变,ox-LDL常用于造模模拟体内高脂环境[16]。本研究中小鼠造模时长16周,周期较长,主要研究小鼠在高脂影响下的血管慢性炎症性改变,从而导致主动脉斑块的形成,故相应的细胞实验采用的是LPS刺激巨噬细胞的体外模型模拟体内实验的炎症变化。
本实验采用高脂饲料喂养构建ApoE-/-小鼠AS体内模型和LPS诱导的Raw 264.7巨噬细胞极化构建体外模型,通过血清学、病理学、分子对接和Western Blot等方法,发现橙皮苷可有效改善高脂饮食诱导的小鼠AS斑块形成,降低血脂水平,减少M1巨噬细胞极化细胞因子TNF-α、 IL-6释放,上调M2巨噬细胞极化细胞因子Arg-1、IL-10 水平,降低P-P65的表达,上调P-AMPK/PPAR-γ的表达。
核因子-κB P65(nuclear factor-κB)是一个重要的转录因子,参与调控AS炎症反应相关的细胞因子、黏附分子表达。NF-κB P65信号通路的活化贯穿于AS血管内皮损伤到斑块形成的各个环节[17]。此外,P65可促进巨噬细胞M1极化,增加TNF-α、IL-6的释放[18]。AMPK即腺苷酸活化蛋白激酶,是一种细胞能量感受器,是调节机体合成代谢和分解代谢的主要蛋白激酶,影响蛋白质、脂肪、糖类的代谢途径,容易受到缺血缺氧、氧化损伤等病理因素的影响,对心血管起到保护作用[19-20]。PPAR-γ即过氧化物酶体增殖物激活受体,是AMPK下游调控糖脂代谢和炎症的重要转录因子,研究发现,PPAR-γ可调控脂质代谢,巨噬细胞逆转运胆固醇、抗炎及保护血管内皮细胞等作用[19-21]。AMPK的活化可以上调 PPAR-γ 的表达。此外,研究报道激活AMPK/PPAR-γ 可促进M2巨噬细胞极化,发挥抗AS的炎症作用,同时可通过抑制NF-κB(P65)活化,抑制M1巨噬细胞极化,从而发挥保护AS的作用[22]。
综上所述,橙皮苷可能通过激活AMPK/PPAR-γ通路,抑制NF-κB(P65)活化,调节巨噬细胞极化,抑制M1极化细胞因子的释放,促进M2极化细胞因子表达,抑制高脂饮食诱导的ApoE-/-小鼠AS发生发展。本研究结果发掘了AS治疗的新靶点,阐明橙皮苷防治AS的内在机制,为AS的治疗和后续研究确定新的靶点和思路,但其对AS巨噬细胞极化的具体调控机制仍需进一步探讨。

