花生分离蛋白酶解物对鸡肉肌原纤维蛋白流变性的影响
许时慧,陈金玉*,关文强*,张颖璐,张坤生,耿亚鑫,胡方洋,邓金香,宋健臣
(1.天津商业大学生物技术与食品科学学院,天津市食品生物技术重点实验室,天津 300134;2.天津二商迎宾肉类食品有限公司,天津 300385)
近年来鸡肉产能增加,市场供应充足,而且价格低廉[1],其中鸡胸肉又以高蛋白、高营养及低胆固醇等特点著称,深受消费者喜爱。在鸡胸肉中起主要作用的蛋白质是肌原纤维蛋白(myofibrillar protein,MP),MP约占肉中蛋白的55%[2],对肉的质地、脂肪、香气及色泽有很重要的影响[3],肌原纤维蛋白的流变性及凝胶性质是影响肉质的重要原因,是影响加工性能的一个重要指标[4-6],也是决定肉制品品质的关键因素。
利用植物蛋白来改善肌原纤维蛋白的功能性质,从而丰富肉制品种类并提高其品质是当前的热点。如常用的大豆分离蛋白不但能增强产品质构及持水性[7]、节约生产成本还可促进环境友好发展。花生分离蛋白(peanut protein isolate,PPI)也是常用的优质蛋白。我国的花生种植面积广、产量高[8],是重要的经济作物。花生含有多种生物活性[9],能用作稳定剂改善食品感官[10],将其添加到碎肉、块肉和仿肉等肉制品中可以充当营养强化剂、抗氧化剂等,能弥补加工过程营养损失[11]。但是天然的PPI凝胶成形能力较弱,对MP的加工性质、组织结构没有明显的促进作用[12],而将PPI酶解,会得到由蛋白质、小分子肽、氨基酸、糖和脂肪等物质组成的酶解产物[13],这一过程会使花生蛋白分子结构展开、内部疏水基团暴露,花生蛋白分子间疏水相互作用增强,能促进其形成凝胶[14-15]。本试验拟将PPI酶解物与MP相结合,探究PPI酶解物与MP的相互作用,以期为二者的加工利用提供理论依据。
1 材料与方法
1.1 材料与试剂
鸡胸肉(冷藏):市售;花生分离蛋白:上海源叶生物科技有限公司;NaH2PO4(分析纯)、NaCl(分析纯)、乙二胺四乙酸[(ethylene diamine tetraacetic acid,EDTA),分析纯]、无水乙醇(分析纯):天津市赢达希化学试剂厂;碱性蛋白酶(200 U/g)、木瓜蛋白酶(2 000 U/g)、中性蛋白酶(4 800 U/g):丹麦诺维信有限公司;1,1-二苯基-2-三硝基苯肼[(2,2-diphenyl-1-picrylhydrazyl,DPPH),分析纯]、牛血清蛋白(bovine serum albumin,BSA):美国Sigma公司;盐酸(分析纯):天津市风船化学试剂科技有限公司;MgCl2(分析纯):天津市天大化工实验厂;三聚磷酸钠(分析纯):天津市光复精细化工研究所。
1.2 试验仪器
SMSTA TA.XT plus质构仪:英国Stable MicroSystems公司;Physica MCR301高级旋转流变仪:奥地利安东帕公司;HW-S24型电热恒温水浴锅:上海一恒科学仪器有限公司;FA2004A电子天平、FD-5N型真空冷冻干燥机:日本EYELA公司;H1650-W台式高速离心机、H185台式高速冷冻离心机:长沙湘仪离心机仪器有限公司;IKA T10高速组织匀浆机:德国IKA公司;KQ-250B型超声波清洗机:昆山市超声仪器有限公司;EL20型pH计:梅特勒-托利多仪器有限公司。
1.3 试验方法
1.3.1 花生分离蛋白酶解物的制备方法
取一定量的花生分离蛋白,加入适量去离子水,配制3组蛋白质量浓度5%的花生蛋白液,分别加入底物浓度3%的碱性蛋白酶、中性蛋白酶及木瓜蛋白酶,于各自的最适酶解条件下酶解3 h[13],使用1 mol/L NaOH溶液和1 mol/L HCl溶液维持体系pH值稳定,待反应结束后,用沸水加热10 min灭酶,冷却至室温25℃左右,以4 000 r/min离心20 min,弃沉淀收集上清液即为酶解液,进行真空冷冻干燥,最终得到酶解产物粉末。
1.3.2 酶解液的超滤分离
按1.3.1的方法制得花生蛋白酶解液,通过UF超滤膜(截留分子量为3 kDa)进行超滤,在25℃下以4 500 r/min离心30 min,收集下层滤液(截留分子量<3 kDa),确定酶解物的分子量。
1.3.3 提取MP
MP的提取参考胡方洋等[16]和Chen等[17]的方法,将鸡胸肉及提取液(0.002 mol/L MgCl2、0.1 mol/L NaCl、0.001 mol/L EDTA、0.1 mol/L Na2HPO4pH=7)从 4℃冰箱取出,洗净切成肉糜状,用4倍体积的MP提取液[0.002 mol/L MgCl2、0.1 mol/L NaCl、0.001 mol/L EDTA、0.1 mol/L Na2HPO4(pH=7)]高速匀浆(8 000 r/min),充分混匀,在4℃、4 500 r/min条件下离心20 min,取沉淀,重复离心3次,再向所得沉淀中加入4倍体积的0.1 mol/L NaCl溶液,与上述相同的离心条件下重复离心3次,弃上清液,最后沉淀即为MP(4℃冷藏,需7 d内用完)。
1.3.4 PPI酶解物与MP共混体系的制备
将1.3.1得到的酶解产物冻干粉以不同的添加量与MP进行复配,添加量分别为0%、2%、4%、6%、8%、10%,用0.1 mol/L NaCl制备成20 mg/mL的蛋白溶液,利用匀浆机中速搅拌30 s,控制温度不超过室温25℃,测定其流变学特性。
1.3.5 共混凝胶的制备
分别将1.3.1制得的碱性蛋白酶、中性蛋白酶及木瓜蛋白酶酶解物的冻干粉以 0%、2%、4%、6%、8%、10%的比例与MP混合,用0.1 mol/L NaCl制备成40 mg/mL[18]的蛋白溶液,放入水浴锅从20℃开始升温,升温至75℃,保持10 min,加热结束后用碎冰快速冷却,放入4℃冰箱12 h后取出备用。
1.3.6 流变学的测定
1.3.6.1 剪切稀化的测定
分别取不同比例的适量样品(按1.3.4制备的PPI碱性蛋白酶酶解物、中性蛋白酶酶解物及木瓜蛋白酶酶解物与MP共混体系)置于流变仪的测定平台上,选用PP 50(直径为25 mm)的锥板模具,恒定温度24℃,测定样品的表观黏度(η)在剪切速率(γ)从0.01 s-1~300 s-1递增过程中的变化。
1.3.6.2 动态温度剪切扫描
参考Chen等[19]的方法将制备好不同组分与比例的样品取3 mL置于流变仪测定平台上,选用P/0.5的探头,板间距1 mm,振幅1 Pa,频率固定为1 Hz,温度从20℃升至90℃,再从90℃降至20℃,记录温度变化过程中储能模量G′、损耗模量G″的变化,绘制曲线。
1.3.7 质构性质的测定
将1.3.5制备的共混凝胶置于质构仪测试台面进行测定,测定参数:探头P/0.5、测前速度1.0 mm/s、测试速度1.0 mm/s、测后速度1.0 mm/s、触发力为5 g、压缩比40%,测试中的最大力即为破断强度,对应的压缩距离为凹陷深度,凝胶强度等于二者的乘积[20],测定一次重新换一个测量位置,每个样测3次,每组3个平行。
1.4 数据处理
采用Excel 2007、Origin 8.5对试验数据进行处理分析及绘图。每个试验平行3次。
2 结果与讨论
2.1 酶解物成分分析
酶解物成分分析结果见表1。
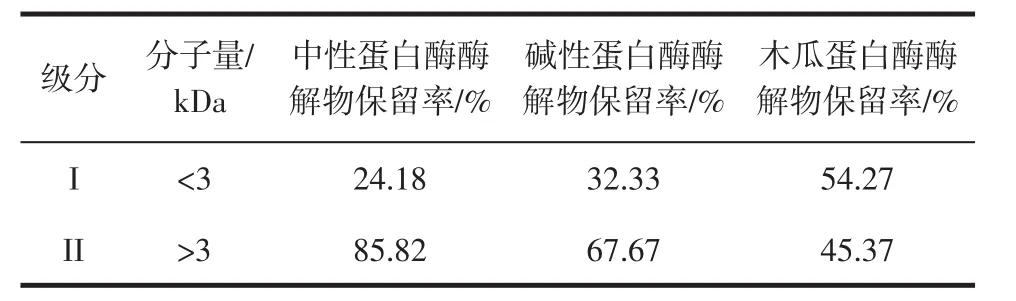
表1 PPI酶解物成分组成Table 1 Composition of PPI hydrolysate
采用超滤离心管对制备的PPI酶解物进行膜超滤分离,得到了2种分子量组成的抗氧化肽。由表1可知,中性蛋白酶酶解物的级分I占24.18%,级分II占85.82%;碱性蛋白酶酶解物的级分I占32.33%,级分II占67.67%,级分II比级分I占比多;木瓜蛋白酶酶解物的级分I占54.27%,级分II占45.37%。
2.2 不同酶解物对MP功能的影响
2.2.1 对流变学性质的影响
2.2.1.1 剪切稀化现象
混合体系的表观黏度剪切速率的变化见图1。

图1 不同的花生蛋白酶解物与肌原纤维蛋白共混体系的剪切稀化现象Fig.1 Shear thinning of different peanut protein hydrolysates and myofibrillar protein blends
由图1可知,随着剪切速率在0~300 s-1逐渐增加,表观黏度先快速降低而后趋于平缓,添加PPI及其不同酶解物与MP组成的溶液均随剪切速率的增大而降低,存在剪切稀化现象,属于非牛顿流体[21]。而添加PPI酶解物后,共混溶液的表观黏度均增大。原因可能是因为共混体系间的分子间作用力增强,紧密连接,阻碍了其流动速度,对混合液施加剪切力后,破坏了MP分子与改性酶解物小分子之间的缠绕,分子间氢键断裂,作用力越大破坏效果越明显,从而表现出表观黏度减小;当未施加剪切力时,中性蛋白酶解PPI/MP共混体系的表观黏度增大梯度较明显,当剪切力增大到一定值后,共混体系间的分子无法重新取向,此时表观黏度维持在一个稳定范围[22],趋近于一个常数。
还可看出,在没有剪切速率的影响下,添加了PPI或其酶解物的表观黏度均明显高于未添加,而且随着酶解PPI的添加量的增加,呈现先增大后减小的特点,其中在添加量为4%时最大,而直接加入PPI会降低体系的黏度,说明PPI酶解物在一定添加量下能增加混合体系的黏度,这可能与PPI酶解后性质改变有关。如抗氧化作用的增加可能会使MP的分子形态更加紧致,而酶解后蛋白分解成氨基酸与MP分子作用范围更加全面,使共混体系不易流动变形;表观黏度会随着添加量的增加而减弱之后平缓,这可能是因为蛋白之间的结合作用已经被完全破坏,不会再出现新的变化。
2.2.1.2 温度扫描分析
混合体系的储能模量随温度的变化见图2。
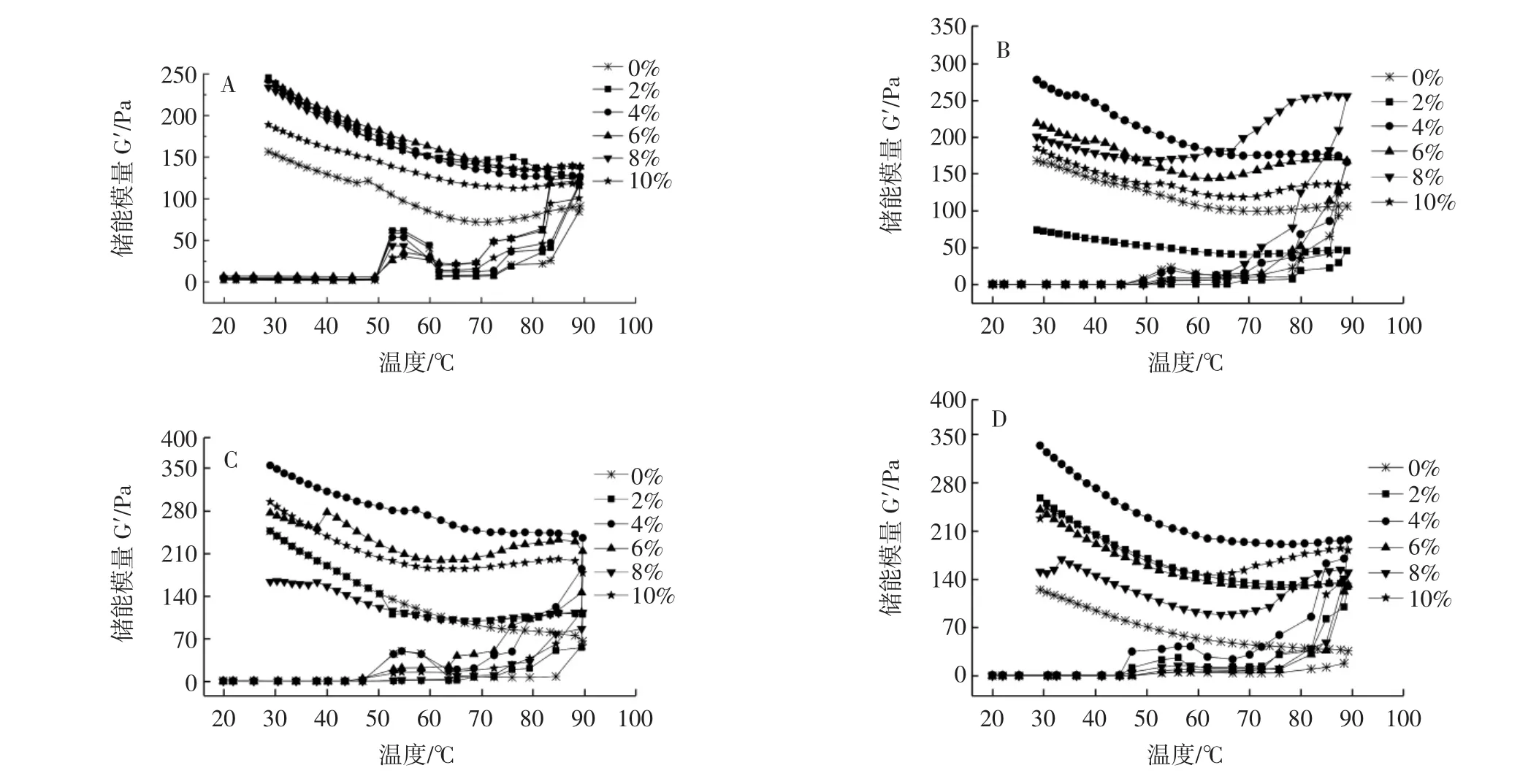
图2 不同的花生蛋白酶解物与肌原纤维蛋白共混体系的储能模量Fig.2 Storage modulus of the blend system of different peanut proteolysis products and myofibril protein
G′的变化用于检测食品的凝胶化[23]。G′表示凝胶结构中由弹性变形量变化而引起的能量变化[24]。由图2可知,测定温度变化范围是20℃~90℃~20℃,G′在45℃~55℃时开始缓慢增加,凝胶网络开始初步形成,部分肌球蛋白的头部开始变性并交联形成松散的网状结构[25];当温度高于55℃后,G′开始下降,肌球蛋白尾部开始变性,尾部超螺旋结构解旋会破坏前期形成的网状结构[26];当温度在63℃~90℃之间,G′开始重新上升,由于共价二硫键和疏水相互作用而形成永久性不可逆交联的肌球蛋白丝[27],当温度下降时,凝胶网络结构增强,G′急剧上升,可能是酶解物与MP会通过非共价相互作用单独重新分配和形成凝胶。
其中在50℃~60℃之间,添加PPI酶解物的MP溶液的G′先增大后减小,可能是肌球蛋白尾部的变性被抑制,之前的网状凝胶结构不会轻易被破坏;在降温阶段,PPI酶解物/MP共混体系相较PPI/MP共混体系的G′均有明显增大,表明PPI酶解产物对MP的结构有促进作用,提高G′的作用优于PPI,在添加量为4%时增强效果最大。
混合体系的损耗模量随温度的变化见图3。

图3 不同的花生蛋白酶解物与肌原纤维蛋白共混体系的损耗模量Fig.3 Loss modulus of the blend system of different peanut proteolysis products and myofibril protein
G″表示加热过程中黏性的变化,表示物质受到外力作用时的变形程度[28],可以反映MP结构的折叠和聚集[24]。图2和图3中G′和G″的变化趋势相似,添加花生分离蛋白和酶解后的PPI均改变了MP原本的结构特点,酶解后的PPI改变作用更加明显,原因可能是PPI酶解后产生的活性多肽改变了MP的氧化能力,影响其G″的变化。在升温阶段50℃~60℃出现一次最大值,然后快速下降,继续加热,G″缓慢上升。在降温阶段,随着温度的降低G″急剧增加,在相同的温度下,PPI及其酶解物在添加量为4%时增幅最大,与G′的变化重合。在碱性蛋白酶解PPI与MP共混体系中,酶解物添加量为10%的情况下,对MP的G″的作用最小;在木瓜蛋白酶解PPI与MP共混体系与中性蛋白酶解PPI与MP共混体中,酶解物添加量从2%~4%G″逐渐增加,超过4%之后,随着添加量的增加而逐渐降低,但3种酶解物均增加了MP分子的G″。
2.2.2 PPI酶解物对凝胶强度的影响
混合体系的凝胶强度随PPI及其酶解物添加量的变化见图4。
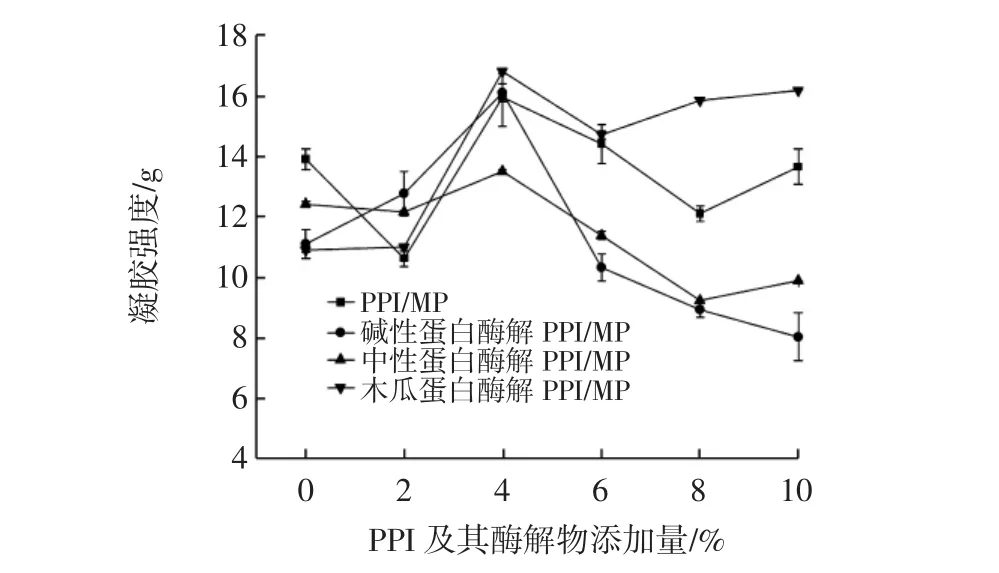
图4 不同的花生蛋白酶解物与肌原纤维蛋白共混体系的蛋白凝胶强度Fig.4 Protein gel strength of blends of different peanut protein hydrolysates and myofibrillar proteins
蛋白的凝胶是因外界条件变化导致蛋白产生不同程度的变性开始伸展,然后蛋白质与蛋白质、蛋白质与溶剂之间相互作用,最后蛋白质之间相互聚集,形成致密的三维网状结构分离蛋白及其酶解物与MP共混凝胶随PPI及其酶解物添加量变化的变化趋势。添加2%的PPI酶解物对MP凝胶强度的影响不大,而同样的添加量下未酶解的PPI会降低MP的凝胶强度;当添加量升至4%时,共混蛋白凝胶强度明显增加,其中PPI/MP凝胶强度增加3.80%~14.84%;碱性酶解PPI/MP凝胶强度增加15.03%~45.09%;中性酶解PPI/MP凝胶强度增加了9.70%,木瓜蛋白酶解PPI/MP凝胶强度增加了54.13%,而后又随添加量的增加而减小,这可能是酶解导致PPI变性,球状结构展开,埋藏在蛋白质内部的活性基团暴露[12],增强PPI与MP之间的分子相互作用,表明PPI酶解物在4%的添加量下,形成的混合蛋白结构较为紧致,形成的凝胶也比较牢固,从而增强MP的凝胶[29]。图4反映了花生强度,其中木瓜蛋白酶酶解物与碱性蛋白酶酶解物增加MP的凝胶强度的作用较为明显。当添加量超过4%后,可能因为两种蛋白质的自身相互作用增强,MP分子形成凝胶网络结构时的阻力增大[30-32],导致蛋白凝胶强度下降,当PPI及其酶解物超过一定量与MP作用会阻碍或破坏MP原有的蛋白结构,不利于其形成致密的凝胶结构。
2.2.3 不同酶解物对凝胶质构的影响
混合体系的弹性、黏结性和回复性随PPI酶解物添加量的变化见图5。

图5 不同的花生蛋白酶解物与肌原纤维蛋白共混体系的蛋白凝胶质构Fig.5 Protein gel structure of blends of different peanut protein hydrolysates and myofibrillar proteins
凝胶质构是蛋白质在食品加工过程的一个重要的属性,对食品品质有重要影响,其中弹性、黏结性及回复性等性质的改变反映了蛋白的变性情况。由图5可知,随着各蛋白酶所得酶解物添加量逐渐增加,蛋白的弹性、黏结性及回复性均呈现不同的变化。在碱性蛋白酶解PPI/MP共混体系中,弹性最大增加了4.55%,黏结性增加,回复性变化不大;在中性蛋白酶解PPI/MP共混体系中,在PPI酶解物添加量为4%时,弹性最大增加了27.45%;在木瓜蛋白酶解PPI/MP共混体系中,混合蛋白的凝胶弹性增加了21.86%,添加量在4%时最大,回复性和黏结性均有所增加,由此可推测,在肉类制品中添加经酶处理改性的PPI能增强食品的弹性,改善食品品质。
3 结论
MP与PPI及其酶解物复配后,在4%的添加量下,PPI酶解物对 MP 的 G′、G″、表观黏度、凝胶强度、弹性、回复性及黏结性等均有促进作用,其中,PPI中性蛋白酶酶解物对MP的流变学性质的改善作用优于碱性蛋白酶酶解物、木瓜蛋白酶酶解物及PPI,主要体现在对G′及凝胶弹性的影响上;3种PPI酶解物均能增强MP的凝胶强度(增幅在9.7%~54.13%)及质构特性,与流变学变化相一致。说明PPI经过酶解后能有效改善MP的蛋白特性,为后续的研究奠定了基础,对实际生产加工具有重要的实际意义。

