链霉菌SG17 代谢产物对玉米黄曲霉的抑制作用及其稳定性分析
宋根娣, 王佳伟, 周 斌, 孙新媱, 周 阳, 黄珍珍
(洛阳理工学院 环境工程与化学学院,河南 洛阳471023)
玉米是全球重要的谷类作物,也是我国大宗粮食之一。 据联合国粮农组织统计资料表明,我国玉米种植面积和总产量位居世界第二, 仅2017 年我国玉米总产量达2.6 亿吨, 居三大粮食作物之首[1]。玉米因其具有高蛋白质、高脂肪含量的特点,广泛应用于食品、饲料等行业。 我国每年用作饲料加工的玉米占总产量的60%左右,并呈现逐年上升的趋势,玉米总消费量的80%~90%均与人和动物有关,因此玉米的品质安全直接影响人们的健康[2]。
与其他谷物相比,玉米胚部的占比大,吸湿性强,易受黄曲霉的侵染,特别是转入贮存后,腐生型的黄曲霉菌极易侵染玉米籽粒并迅速生长产生毒素[3]。 高秀芬等对我国不同地区玉米的黄曲霉污染情况进行调查发现,在吉林、河南、湖北、四川、广东、广西采集的279 份玉米样品中,黄曲霉毒素阳性率为 75.63%,毒素平均为 44.04 μg/kg[4]。 及华等对河北省贮存玉米样品进行分析,结果显示河北中南部的低平原区,玉米黄曲霉污染率达100%,检出黄曲霉毒素 B1最高为 61.5 μg/kg[5]。 全球每年因黄曲霉污染而废弃的粮食占农作物产量的0.5%。 因此,黄曲霉污染已经成为现代农业特别是玉米加工行业急需解决的问题之一。
目前,防治黄曲霉菌的方法主要有两种:一是通过抑制孢子萌发和菌丝生长,从源头上控制黄曲霉污染,进而减少毒素产生;二是对已经感染的农作物进行脱毒或毒素降解处理[6]。 针对毒素的处理在实际操作过程中存在成本较高、 具有较强刺激、毒副作用大、易残留、降解周期长等缺点,影响玉米的品质和适口性,不符合目前玉米加工行业对绿色健康的要求[7]。 因此,从源头上防控玉米霉变,进而减少黄曲霉毒素危害具有非常重要的研究意义。 源头防治主要是通过筛选能够抑制黄曲霉生长的微生物及其次生代谢产物或提取植物天然成分进行防治。 其中天然植物来源的防霉抑菌剂虽然也具有绿色、安全、无残留的特点,但是其生产成本高,稳定性差,直接制约了其在生产中的应用[8]。 因此,筛选能够显著抑制黄曲霉菌生长的拮抗菌,以其发酵液制备抑菌剂,具有更加广阔的应用前景[9-10]。
作者从畜禽养殖场动物粪便堆积区的土壤中分离获得一株能够显著抑制黄曲霉生长的菌株,暂命名为SG17。通过形态学检测、培养特征分析、生理生化分析及16S rRNA 序列对比进行初步鉴定,并对其抑菌广谱性、发酵液抑菌粗提物的活性及稳定性进行了分析测定, 进一步以霉变玉米作为对象,探究该抑菌粗提物对玉米黄曲霉的抑制效果,为开发新型生物防霉剂提供资源。
1 材料与方法
1.1 材料与试剂
SG17 菌株由作者所在实验室从洛阳本地畜禽养殖场粪便堆积地土壤中分离获得; 玉米黄曲霉(Aspergillus flavus)、 黑 斑 病 菌 (Alternaria brassicae)、炭疽病菌(Colletotrichum)、辣椒疫霉病菌(Phytophthora capsici)保存于洛阳理工学院微生物实验室。
PDA 培养基:马铃薯 200 g、葡萄糖 20 g、琼脂18 g、蒸馏水 1 L;自然 pH。
高氏一号培养基:可溶性淀粉20 g、琼脂20 g、KNO31 g、K2HPO40.5 g、MgSO4·7H2O 0.5 g、NaCl 0.5 g、FeSO4·7H2O 0.01g;pH 7.4~7.6。
伊莫松培养基:葡萄糖10 g、酵母膏10 g、牛肉膏 4 g、蛋白胨 4 g、NaCl 2.5 g、蒸馏水 1 L;自然pH。
酵母葡萄糖培养基:酵母膏10 g、蛋白胨20 g、葡萄糖20 g、琼脂粉18 g、蒸馏水1 L;自然pH。
细菌DNA 快速提取试剂盒、PCR 扩增试剂、染色液制备试剂:天根生化科技(北京)有限公司产品;凝胶回收试剂盒:北京全式金生物工程有限公司产品;其他试剂均为分析纯:国药集团化学试剂有限公司产品。
1.2 仪器与设备
SPX 型智能生化培养箱、Olympus 光学显微镜:美国 Bio-Rad 公司产品;PTC-200 型 PCR 仪: 美国MJ Research 公司产品; 全自动凝胶成像分析系统:美国Bio-Rad 公司产品;HZQ-F160 全温振荡培养箱:华美生化仪器(江苏)公司产品;台式高速冷冻离心机:德国Heraeus 公司产品。
1.3 研究方法
1.3.1 菌株的形态特征分析 将活化后的SG17 接种于PDA 培养基上培养6 d,挑取部分单菌落置于载玻片,加入无菌水涂匀,干燥,固定后用结晶紫混合染液染色30~60 s,水洗,干燥后用显微镜观察形态特征。
1.3.2 菌株培养特征及生理生化鉴定 参照链霉菌鉴定手册[11],28 ℃恒温培养,在7~14 d 中进行观察并记录特征。
1.3.3 菌株分子鉴定及系统发育分析 采用DNA快速提取试剂盒进行菌体DNA 的提取。 16S rRNA的扩增采用通用引物进行,27F:5′-AGAGTITGATC CTGGCTCAG-3′,1492R:5′-GGTTACCTTGTTACGA CTT-3′, 扩增片段约 1.6 kb,PCR 产物进行琼脂糖(1 g/dL)凝胶电泳。 目的片段切胶回收后,送至上海生工测序。 目的序列在GenBank 数据库中进行BLAST 比对, 选择同源性相近的种属序列, 利用MEGA6.0 软件计算遗传距离,用邻近法构建系统发育树。
1.3.4 SG17 抗菌谱的测定 采用对峙法在PDA 固体培养基两侧分别接种SG17 及已经活化培养5 d的病原菌 (直径约6 mm 的圆形菌饼), 以不接种SG17 的平板为对照,28 ℃恒温培养5 d, 观察抑菌情况,重复3 次,根据抑菌带直径确定抑菌效果。
1.3.5 SG17 抑菌粗提物的制备 以接种体积分数3%将SG17 接种于100 mL PDA 液体培养基中,在30 ℃以160 r/min 振荡发酵培养5 d。 将发酵液在4 ℃下以 12 000 r/min 离心 10 min, 上清液经吸附树脂吸附后解吸,洗脱液冷冻干燥后得到抗菌物质粗提物。 将粗提物加入2 mL 无菌水进行稀释,并用0.22 μm 除菌过滤器过滤,制备抑菌粗提物原液,4 ℃保存备用。
1.3.6 SG17 抑菌粗提物的稳定性分析
1)热稳定性测定采用无菌水配制2 mL 质量浓度为1 000 μg/mL 的抑菌粗提物, 过滤除菌后置于40、60、80、100 ℃的水浴锅中分别处理 30 min 和 60 min, 将处理后的抑菌溶液采用牛津杯法检测其抑菌圈大小,按照下述公式计算抑菌率,加入等体积的无菌水为对照,重复3 次,确定抑菌活性的变化。
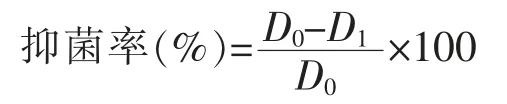
式中:D0为加入无菌水的菌落直径,mm;D1为加入抑菌粗提物的菌落直径,mm。
2)储存稳定性测定按照上述方法配制抗菌粗提物,并在室内环境分别保存 5、10、15、20 d,采用牛津杯法检测其抑菌圈大小,计算抑菌率确定抑菌活性的变化。
1.3.7 SG17 抑菌粗提物对黄曲霉孢子萌发的抑制分析 参考文献[12]的方法,取1.5 mL 无菌离心管,分别加入不同质量浓度的抑菌粗提物和黄曲霉孢子,每管中孢子终浓度为2×105CFU/mL,粗提物的最终质量浓度分别为:1 000、500、200、100、50、20、10 μg/mL,以同体积无菌水为对照。 将各管放置在30 ℃恒温培养箱中孵育 3 d 后, 分别取 100 μL 混合菌液,均匀涂布于PDA 培养基,28 ℃培养2 d,重复3 次,观察孢子萌发结果。
1.3.8 SG17 抑菌粗提物对玉米黄曲霉的抑制分析挑选颗粒饱满、 大小均匀的玉米粒, 用体积分数75%的乙醇浸泡处理1 min,再用质量分数1%的次氯酸钠溶液浸泡处理1 min, 最后用体积分数75%乙醇浸泡处理1 min,无菌水清洗3 次。 将处理后的玉米粒放入无菌培养皿中,每个约20 粒,加入1 mL浓度为2×105CFU/mL 的黄曲霉孢子悬液, 摇匀至玉米表面微干, 再加入1 mL 质量浓度分别为200、100、50 g/mL 的抑菌粗提物, 空白对照加入等体积的无菌水,摇匀后,30 ℃恒温培养箱中培养,重复3次,观察玉米上黄曲霉的生长状况。
1.3.9 数据统计分析 采用SPSS 17.0 软件进行统计分析, 实验结果中数据为3 个平行样品平均值,并用平均数±标准差表示。 组间的差异性分析采用one-way ANOVA 方法,其中P<0.05 表示差异显著。图中分别以数值和误差棒表示, 采用Origin Lab 2017 绘图分析。
2 结果与讨论
2.1 菌株SG17 的形态观察结果
将菌株SG17 接种于PDA 培养基培养5 d。 如图1 所示,菌落具有质地致密,表面呈较紧密的绒状,干燥,多皱,菌落不蔓延,近规则的圆形,微隆起等特征。 在显微镜下观察,气生菌丝发育良好,多分枝,缠绕较紧密,不形成横隔;基内菌丝有隔膜,较易断裂,略短,致密,多分枝,菌丝较平直,基本符合链霉菌属的形态特征。
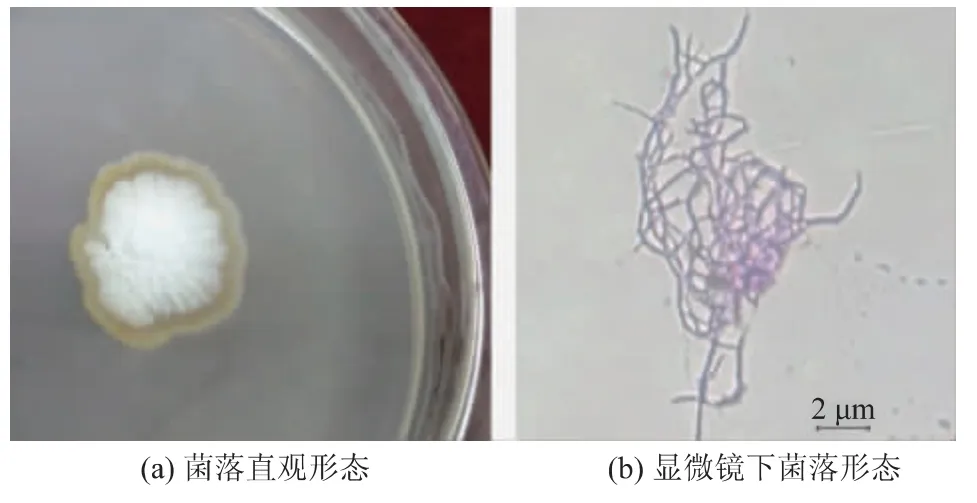
图1 SG17 菌株的形态特征Fig. 1 Morphological characteristics of strain SG17
2.2 SG17 的培养及生理生化特征
菌株SG17 在5 种培养基上生长的结果见表1,菌株生长较好,气生菌丝发达,基内菌丝丰富,气生菌丝颜色从白色到黄色,基内菌丝颜色从褐色到黄褐色。 在伊莫松和营养琼脂培养基上菌落较大,柴纳斯培养基次之,在高氏一号和葡萄糖酵母膏培养基上菌落较小,且在葡萄糖酵母膏培养基上长势最好,培养3 d 首先出现肉眼可见菌落。在伊莫松培养基上菌落呈颗粒状,在葡萄糖酵母膏培养基上为绒状,其余均为表面光滑,且伊莫松和葡萄糖酵母培养基上菌落有明显突起。 在高氏一号培养基上产生黑褐色色素,其余的产生褐色可溶性色素。 根据菌落特征观察,该菌株具有链霉菌属的特征。
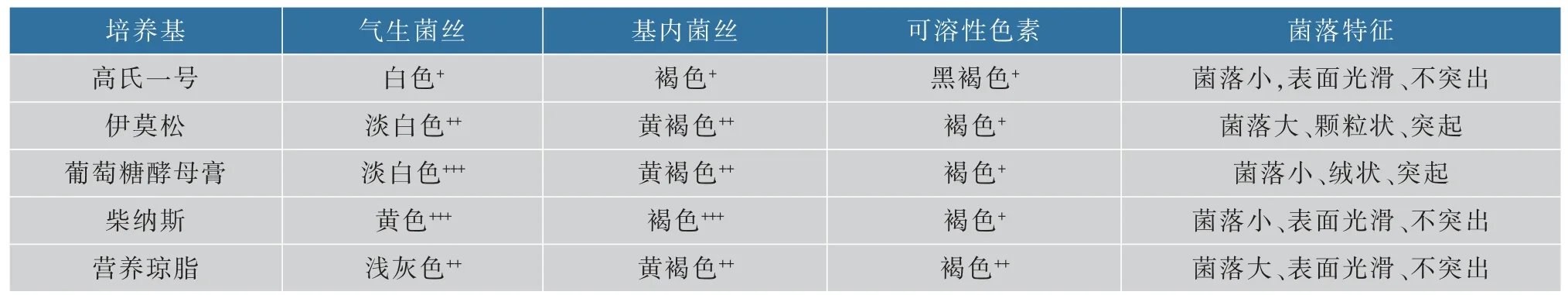
表1 菌株SG17 的培养特征Table 1 Cultural characteristics of SG17
生理生化鉴定结果见表2,菌株SG17 可以使明胶液化,产生淀粉酶,具有酪氨酸酶活性;产生H2S,使牛奶凝固与胨化,但是不能分解纤维素;并且能较好地利用葡萄糖、麦芽糖、蔗糖、肌醇和乳糖等多种碳源。 根据上述的生理生化实验,该菌株具有链霉菌的特征,初步鉴定SG17 为链霉菌属。
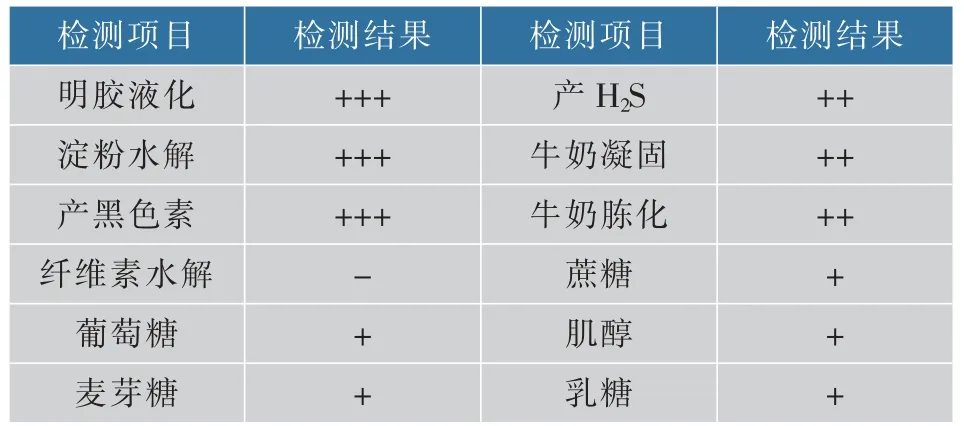
表2 菌株SG17 的生理生化特征Table 2 Physiological and biochemical properties of SG17
2.3 16S rRNA 序列分析结果
菌株SG17 的16S rRNA 序列扩增结果见图2。将测序后的片段与GenBank 数据库中的序列进行对比, 同源性较高的菌株均属于链霉菌属。 选取7株与目标序列相似性高的菌株, 利用MEGA6.0 软件通过邻近法构建系统发育树(见图3)。 结果表明SG17 菌株与 Streptomyces sp. JXJ 0089 KP193140.1菌株的亲缘关系最近, 处于同一分支, 相似度为98%。 结合显微观察、培养特征和生理生化特征,初步确定为链霉菌属。 最终的分类还需通过该菌株与其他已报道的相似菌株之间的核酸杂交实验进行分析。
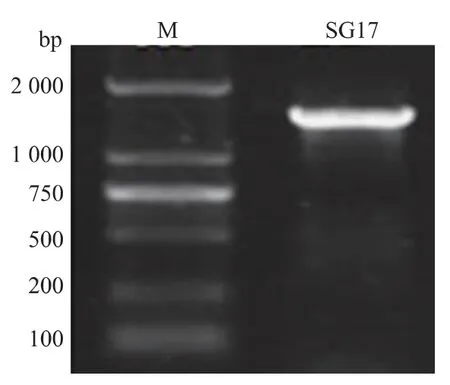
图2 SG17 菌株16S rRNA 扩增结果Fig. 2 Electrophoresis result of 16S rRNA

图3 菌株SG17 的系统发育树Fig. 3 Phylogenetic tree of SG17
2.4 菌株SG17 的抑菌谱分析
由图4 可知, 菌株SG17 对4 种病原真菌均有较强的抑制作用,抑制率在50%以上。图4(e)是SG17发酵液抑制黄曲霉菌的结果, 抑菌圈直径约为38 mm,证明菌株SG17 发酵液能够显著抑制黄曲霉菌的生长。 链霉菌属于放线菌,在土壤、海洋中分布广泛。 目前已经应用的天然活性物质中有70%~80%来自链霉菌,具有抗病原细菌、抗病原真菌、抗寄生虫、抗肿瘤等作用[13]。刘春静等从土壤中分离一株链霉菌TD-1, 其代谢产物对构巢曲霉、(Aspergillus nidulans)、纯绿青霉(Penicillium verrucosum)、赭曲霉(Aspergillus ochraceus) 、黄曲霉(Aspergillus flavus)、黑曲霉(Aspergillus niger)等污染粮食作物的病原真菌均具有明显的抑制活性[14]。 SG17 同属于土壤源链霉菌, 能够显著抑制4 种病原真菌的生长,具有一定的广谱性,并且产生的抑菌活性物质在发酵液中,初步确定为胞外物质。
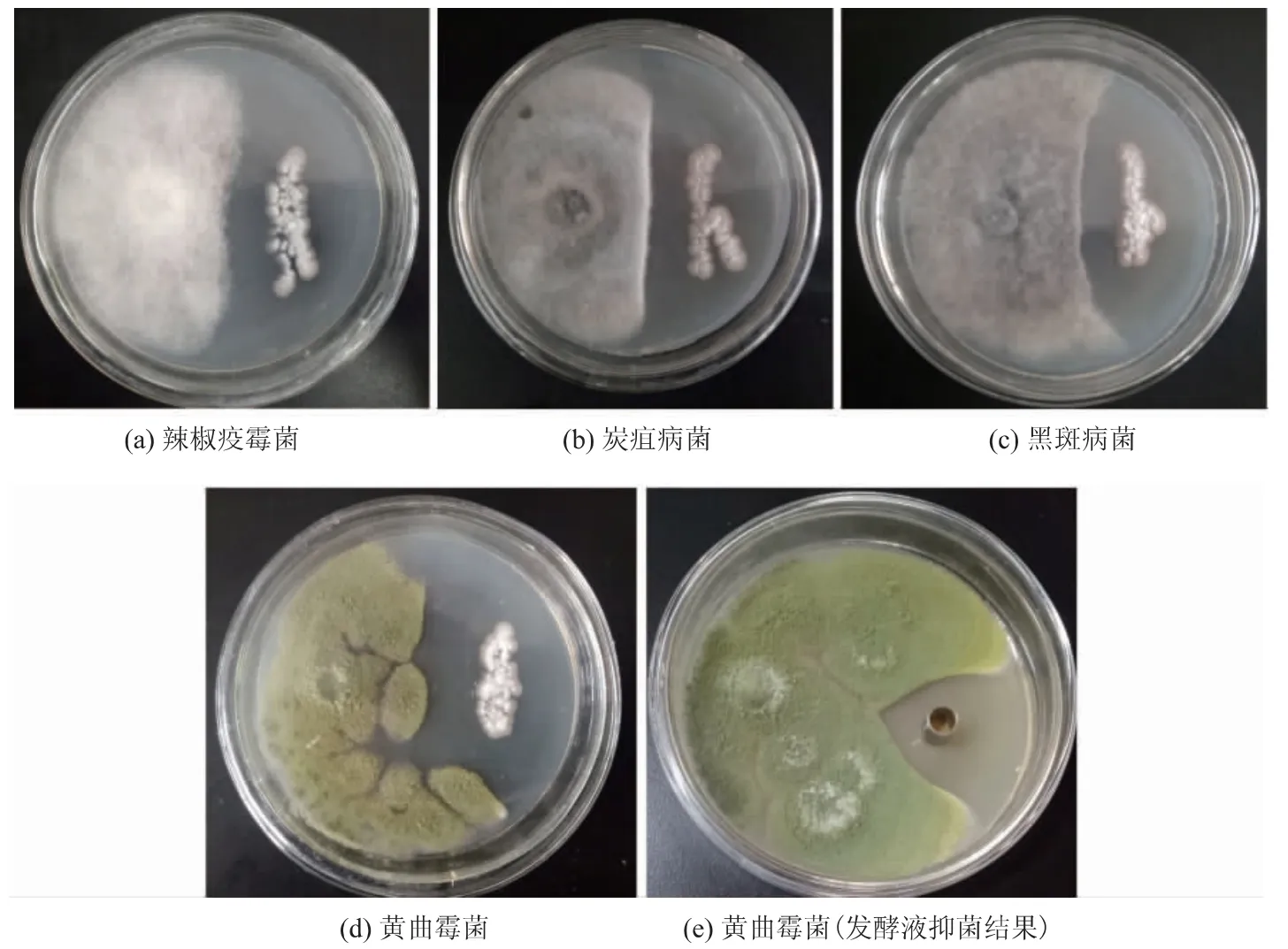
图4 SG17 菌株及其发酵液的抑菌活性Fig. 4 Inhibition effect of strain and fermentation filtrate of SG17
2.5 SG17 抑菌粗提物的稳定性分析
目前,利用微生物次级代谢产物制备生物抑菌剂的研究很多,而实际产品很少,其主要原因在于发酵产生的抑菌物质对环境耐受性差,制约了其应用。 该研究中,SG17 抑菌粗提物对玉米黄曲霉病原菌的抑制率随着温度升高呈现下降趋势,但仍保持在40%以上。 如图5 所示,40 ℃处理后的抑菌率与对照无显著差异,60、80、100 ℃处理 30 min 后,抑菌率分别为 (47.81±0.07)%、(46.75.81±0.31)%、(41.36±0.37)%,显著低于对照组(P<0.05),而 100℃处理60 min 与30 min 的抑菌率无显著差异。 周启升等分离的S24 菌株,其抗菌物质经100 ℃水浴20 min 处理后效价无显著变化, 加热到100 min 效价降低18.18%, 证明该活性物质对热比较稳定,具有潜在的应用价值[12]。 相似地,SG17 抑菌物质在100 ℃条件下处理60 min,其抑菌率降低了16%,且30 min 和60 min 处理后抑菌率无显著差异, 证明SG17 产生的抑菌物质中,主要活性成分具有较好的热稳定性。
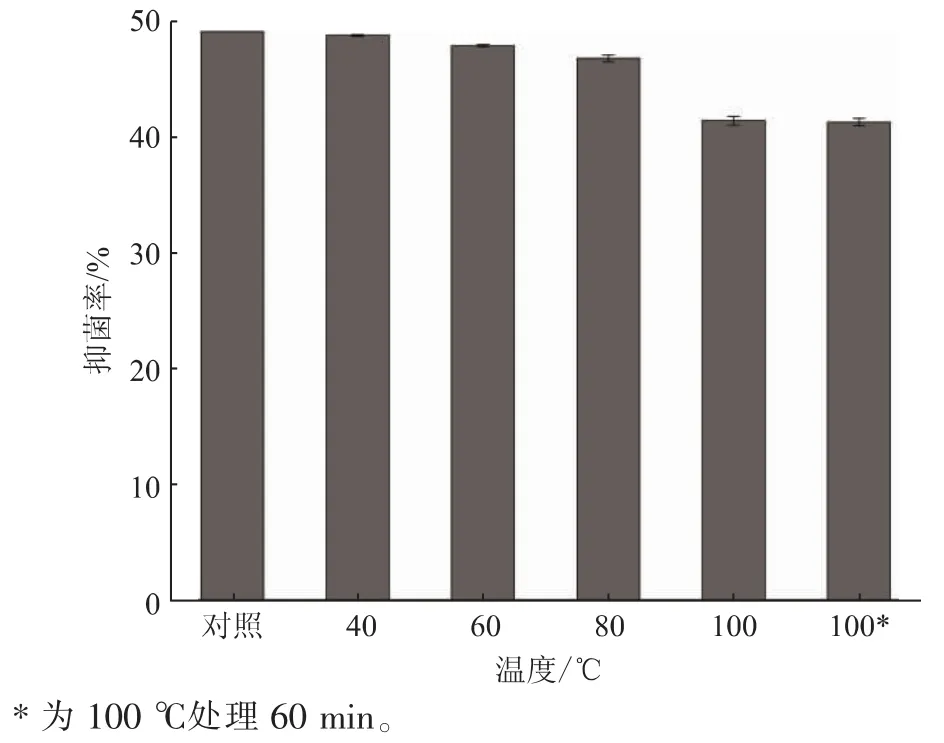
图5 SG17 抑菌物质的热稳定性结果Fig. 5 Thermal stability of antifungal active substances of SG17
存放稳定性的结果见图6,放置15 d 的抑菌率为(25.95±0.68)%,显著低于对照组(P<0.05),而放置 20 d 的抑菌率仅为(3.64±0.31)%,已无明显的抑菌作用。 而刘春静等获得的一株链霉菌TD-1,其发酵产物在不同温度条件下抑菌活性均高于未处理的对照组,且保存20 d 抑菌活性不变。 而SG17 的抑菌粗提物在室内分别放置15、20 d, 其抑菌率显著低于对照组,其原因可能是菌种差异导致的。
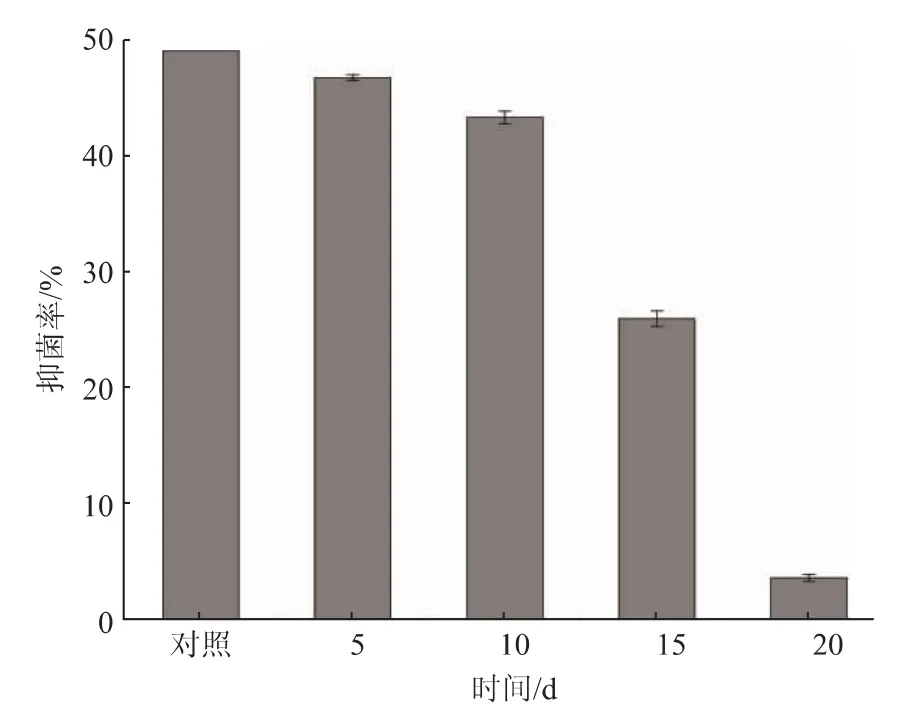
图6 保存时间对SG17 抑菌物质的影响Fig.6 Effects of storage time on antifungal active substances of SG17
2.6 SG17 抑菌粗提物对玉米黄曲霉的抑制结果分析
对比不同质量浓度抑菌物质对黄曲霉孢子萌发的影响见图7。 加入20 μg/mL 抑菌物质的平板上,菌落数显著低于对照组,抑制效果比较明显。 加入50 μg/mL 抑菌物质的混合菌液平板上, 没有肉眼可见的菌落萌发, 说明50 μg/mL 的抑菌物质粗提液可以有效抑制黄曲霉孢子的萌发。
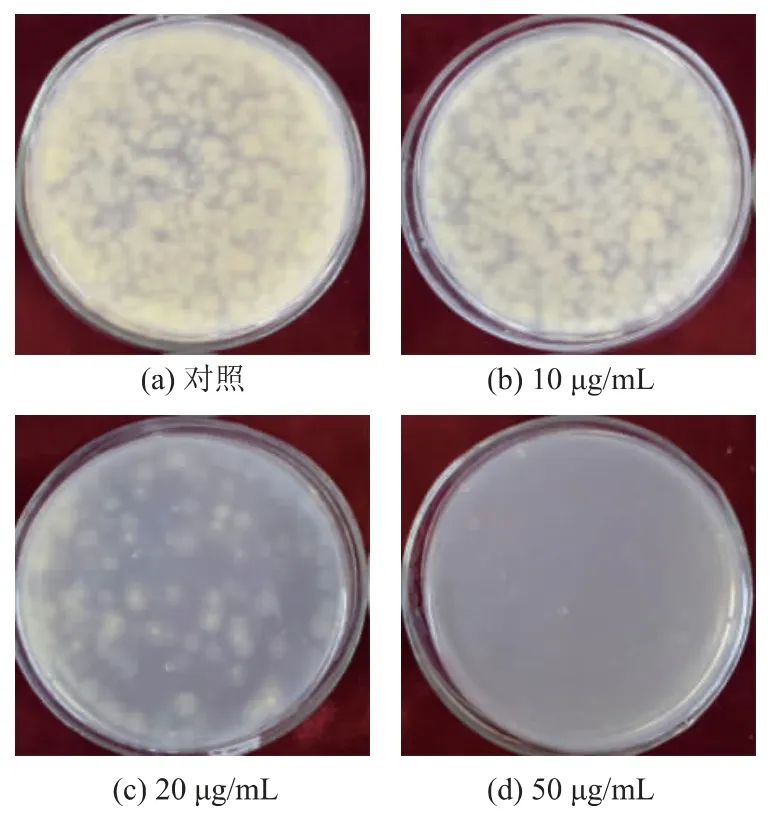
图7 SG17 抑菌物质对黄曲霉孢子萌发的影响Fig. 7 Effects of SG17 antibacterial substances on the spore germination of Aspergillus flavus
以往围绕黄曲霉污染的生物防治及其抑菌活性研究主要通过培养基平板对峙实验完成[15-16]。 为了分析SG17 的实际应用价值, 在平板对峙实验的基础上,将抑菌粗提液直接加入黄曲霉处理的玉米中进行培养,结果见图8。 加入50 μg/mL 抑菌物质的玉米上仅有6 粒玉米有明显的黄曲霉菌生长,加入100 μg/mL 抑菌物质的玉米上未见到明显的黄曲霉菌。继续培养至14 d,100 μg/mL 抑菌物质处理的玉米上有3 粒出现黄曲霉菌生长,抑菌率为80%以上,这与稳定性研究的结果一致(见图6)。 因此,SG17 抑菌物质在玉米黄曲霉污染防治方面具有广泛的应用潜力。

图8 SG17 抑菌物质对玉米黄曲霉的抑制作用Fig. 8 Inhibition effects of SG17 antibacterial substances on Aspergillus flavus in corn
3 结 语
目前,黄曲霉污染仍然是全球玉米作物在饲料及其他深加工领域应用的主要问题之一。 研究表明,各种细菌、放线菌、真菌等均有抑制黄曲霉生长的作用。 且具有不破坏营养成分、环境友好等特点。通过筛选对黄曲霉菌生长有显著抑制作用的微生物及其代谢产物制备生物抑菌剂, 从源头进行防治,具有广泛的应用价值。 作者从洛阳本地畜禽养殖场动物粪便堆积区的土壤中筛选获得多种对黄曲霉有抑制活性的菌株, 其中SG17 菌株的抑菌活性最强。 通过形态学观察、培养鉴定、生理生化检测及16S rRNA 序列对比分析,初步确定为链霉菌属。进一步研究表明SG17 产生的抑菌活性物质具有较好的热稳定性和环境适应性,并能有效抑制玉米黄曲霉的污染。
而作者仅对SG17 发酵液中的抑菌成分进行了简单提取和浓缩,在粗提物中是否存在其他风险物质,仍不确定。 因此,下一步的研究重点在于发酵液粗提物中直接抑菌物质的分离提取,进而制备抑菌剂用于黄曲霉的生物防治。 目前作者所在课题组已经完成了发酵条件优化的工作, 正在对SG17 菌株发酵液中直接抑菌物质进行分离纯化和结构解析,这将进一步扩大该菌株及其代谢产物在粮食特别是玉米中对于黄曲霉防治方面的应用。

