金黄色葡萄球菌肠毒素A、B、C、D、E重组载体的构建及表达
陈威风,崔丽伟,常惟丹,朱龙佼,许文涛*
1.河南牧业经济学院食品与生物工程学院,郑州 450046;2.中国农业大学营养与健康系,北京100083
金黄色葡萄球菌是自然界中最常见的导致细菌性食物中毒的病原菌之一[1-2]。该菌可寄居于人类的皮肤、鼻孔和胃肠道。食品生产一线的无症状工作人员可通过手部接触或呼吸道分泌物污染食物。该菌本身不致病,但在20~37 ℃条件下由其分泌的肠毒素会引起食物中毒[3-5]。金黄色葡萄球菌肠毒素(Staphylococcal enterotoxins,SEs)经典类型有SEA、SEB、SEC、SED、SEE,后来又陆续发现的有SEG、SHE、SEI、SER、SES、SET、SEJ、SEK、SEL、SEM、SEN、SEO、SEU 等[6-8]。其中由SEA 和SEB 引起的食物中毒最常见,其次是SED、SEC和SEE[9-12]。
SEs 比较耐热,一般的灭菌方式(100 ℃,30 min)无法使其灭活[13]。SEs 性质稳定,具有显著耐热耐酸性,进入人体的消化系统后,会引起胃肠炎,导致恶心、腹部疼痛痉挛、出汗和休克等症状,由SEs 引起的食物中毒现象引起了社会的广泛关注[14-15]。国内外用于检测SEs 的有效方法主要包括色谱法[16]、分子生物学方法[17-18]以及免疫学检测方法[19-20]。然而,利用以上3 种方法对SEs检测的前提是需要获得高纯度的SEs 标准蛋白,而目前SEs 蛋白的获取方式主要依靠大规模菌株培养,这种制取方式需要经过复杂的提纯过程,同时还需对提取产物进行鉴定等步骤[21-22]。为了能够更加高效地制备肠毒素纯品,张琨等[21]将SEB基因克隆至pET-22b 载体中进行表达,然后通过Ni 柱亲和层析和DEAE 阴离子层析柱两步纯化,获得了表达量为95.2%的SEB 蛋白。李飞等[23]通过构建pET-28a(+)-SEB 融合表达载体,然后转入BL21 表达细胞诱导表达,表达量较高,但未生成可溶性蛋白。尽管前人利用基因工程的方法制备了肠毒素纯品,但都是针对某一种蛋白,而葡萄球菌食物中毒往往不是由单一毒素引起的,如果一次反应能同时检测多种肠毒素将大大减少葡萄球菌食物中毒分析的工作量。因此,为了达到同步检测多种毒素的目的,需要首先制备多种肠毒素样品,为了高效地制备多种肠毒素纯品,解决SEs的来源困难问题,本实验拟扩增SEA~SEE 5种肠毒素基因,构建原核表达载体,然后转入大肠杆菌BL21(DE3)中进行诱导表达,通过亲和柱进行纯化,为进一步建立相应的快速检测方法奠定基础。
1 材料与方法
1.1 材料与试剂
E.coilBL21(DE3)、E.coilTop10、pET-22b 质粒、氨苄青霉素钠(Amp)、异丙基-β-D硫代半乳糖苷(IPTG)、Ni-NTA琼脂糖纯化树脂、咪唑、乙二胺四乙酸(EDTA)、二硫苏糖醇(DTT)、谷胱甘肽(GSSG/GSH)、T4 DNA 连接酶、柱式DNA 胶回收试剂盒、限制酶NcoⅠ、XhoⅠ、一步法细菌活性蛋白提取试剂盒、质粒DNA 抽提试剂盒、离心式蛋白纯化空柱、DNA 分子量标准蛋白、6X 甘油凝胶上样缓冲液等均购自生工生物工程(上海)股份有限公司。
1.2 仪器与设备
GL-21M高速冷冻离心机(湘仪离心机仪器有限公司);VORTEX-5 涡旋振荡器(上海达姆实业有限公司);KW-1000DC 电热恒温水浴锅(金坛市希望仪器有限公司);ZWY-2102C 恒温培养摇床(上海智城分析仪器制造有限公司);SW-CJ-2F 超净工作台(蓟州净化仪器有限公司);DYY-6C 电泳仪(北京市六一仪器厂);JY-SPC 电泳槽(北京君意东方电泳设备有限公司);Tanon 1600凝胶成像分析系统(北京原平皓生物技术有限公司);LHS-250 智能恒温恒湿培养箱(郑州生元仪器有限公司)。
1.3 实验方法
1.3.1 SEs 序列的合成 从NCBI 基因数据库中查阅SEA~SEE 基因序列,在其两端增加NcoⅠ、XhoⅠ两个酶切位点,合成两端带有酶切位点的基因序列。
1.3.2 表达载体的构建 将合成的SEA~SEE 基因产物和载体pET-22b(+)在各自的酶切体系下,于37 ℃的恒温水浴锅中分别用NcoⅠ、XhoⅠ酶进行双酶切反应2 h,用柱式DNA 胶回收试剂盒回收SEA~SEE 目的片段和载体,之后利用T4 DNA连接酶在16 ℃下的连接体系下混合。将连接液转入到Top10 感受态细胞中,涂布于含0.1%Amp的LB平板培养,37 ℃培养过夜。
1.3.3 筛选阳性克隆 挑取白色菌落,接种于含Amp的LB液体培养基中,37 ℃120 r·min-1摇床充分振荡培养16 h。用限制酶NcoⅠ、XhoⅠ对阳性克隆的质粒进行双酶切验证,用质粒DNA 抽提试剂盒提取质粒并送生工生物工程(上海)股份有限公司测序。
1.3.4 目的蛋白的诱导表达 分别取200 μL 菌液于10 mL 的LB 液体培养基中,加入Amp,37 ℃摇床振荡培养过夜。取过夜培养的BL21(DE3)菌液接种到150 mL 的LB 液体培养基中,加入Amp,16 ℃振荡培养至OD600约为0.5,加入诱导剂异丙基-β-D-硫代半乳糖苷(IPTG),然后分别置于16 ℃和37 ℃振荡培养。
1.3.5 可溶性目的蛋白的纯化 离心诱导表达后的产物,弃上清,向沉淀中加入蛋白质提取试剂,用枪头反复拍打使其形成均匀的不粘稠悬液后,置于恒温摇床上振荡20 min。振荡后的浊液离心2 次,收集上清液作为可溶性目的蛋白部分。重复首次离心后的步骤2~3次,将多次上清液合并,以提高可溶性蛋白的提取率。将约3 mL 琼脂糖纯化树脂小心装入离心式蛋白层析空柱中,避免产生气泡,静置均匀后加入8 倍柱体积的平衡缓冲液A 平衡Ni2+柱;将样品溶液少量多次地加入层析柱中,使其充分与填料结合。然后多次分别加入不同浓度的咪唑缓冲液洗脱杂蛋白;最后换收集管,加入5 倍柱体积的洗脱液洗脱目的蛋白并进行收集。将纯化后的目的蛋白于透析袋中去除咪唑。然后进行15% SDS-PAGE 凝胶电泳。
1.3.6 Western blot 实验 SDS-PAGE 电泳后,将表达的重组蛋白SEA~SEE 转印到PVDF 膜上,4 ℃下,经5%脱脂奶和1%BSA 的TBST 封闭液封闭过夜、漂洗后,加入1∶500 稀释的抗His-Tag 抗体孵育,4 ℃过夜。漂洗后,加入1∶10 000 稀释的辣根过氧化物酶标记的二抗,放入恒温振荡摇床缓慢振荡50 min,漂洗后,加入底物,5 min 显色后观察结果。
2 结果与分析
2.1 表达载体的构建
从NCBI 数据库中查询SEA~SEE 基因序列,5种肠毒素基因序列测序结果表明,SEA、SEB、SEC、SED、SEE 基因序列全长分别为774、798、816、576、639 bp。重组质粒经NcoⅠ和XhoⅠ双酶切鉴定,产物电泳后在预期位置处有明显目的基因条带(箭头所示),大小与预期相符,质粒pET-22b 大小与理论值一致(图1)。后经测序显示,SEA、SEB、SEC、SED、SEE 基因成功构建到表达载体中。
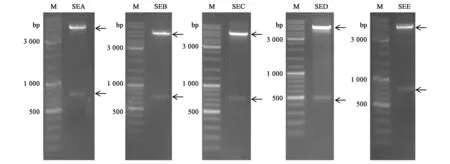
图1 肠毒素A、B、C、D、E重组质粒的双酶切结果Fig.1 The results of double enzyme digestion of enterotoxin A,B,C,D,E recombinant plasmids
2.2 目的蛋白的表达及鉴定
2.2.1 目的蛋白的诱导表达 通过SDS-PAGE 结果显示,与阴性对照相比,含有重组质粒的宿主菌经1 mmol·L-1的IPTG 诱导后有明显的蛋白表达条带(图2),与预期值一致,初步证明目标蛋白在大肠杆菌中成功表达。通过对比,在较低的温度(16 ℃)下,目标蛋白条带更明显,表明16 ℃条件更有利于目的基因的表达。
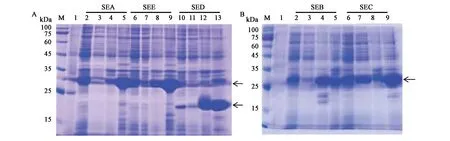
图2 SEA、SEB、SEC、SED、SEE表达产物的SDS-PAGE分析Fig.2 SDS-PAGE analysis of SEA,SEB,SEC,SED,SEE expression products
2.2.2 SDS-PAGE 纯化结果分析 为了得到肠毒素A、B、C、D、E的纯品,本实验对诱导后的产物进行了纯化,通过对纯化后的目的蛋白进行凝胶电泳验证,结果显示,SEA、SEB、SEC、SED、SEE 分别在约32、31、32、22、30 kD 处有明显的亮带(图3),目标条带较为单一,其大小与预期值相符,再次证明目标蛋白被成功表达。
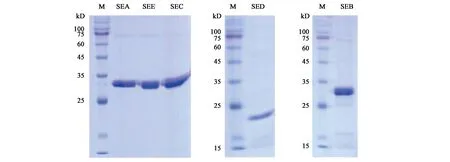
图3 目标蛋白SEA、SEB、SEC、SED、SEE 的SDS-PAGE验证结果Fig.3 SDS-PAGE verification results of target protein SEA,SEB,SEC,SED,SEE
2.2.3 Western blot 实验分析 为了进一步验证目标蛋白是否被表达,本研究进行了Western blot实验,如图4显示,目标蛋白在预期条带位置有条带出现,表明5 种目标蛋白均能够被成功表达出来。
图4 目标蛋白SEA、SEB、SEC、SED、SEE的Western blot验证结果Fig.4 Western blot verification results of target protein SEA,SEB,SEC,SED,SEE
3 讨论
金葡萄球菌肠毒素一旦污染食物链将对人们的身体健康造成严重威胁。因此,研究和开发金黄色葡萄球菌肠毒素快速检测技术是当前食品安全与控制领域的迫切需求之一,尽管目前用于检测SEs的方法较多,但都有其局限性,而且大部分是针对单一类型的肠毒素进行分析,关于同时快速分析多种SEs 的方法报道较少,而一次反应能同时检测多种SEs 也可以大大减少食物中毒分析过程的工作量。肠毒素纯品是建立在快速检测方法的基础上,传统制备肠毒素的方法主要是从产肠毒素菌株中分离纯化而来,这种方法纯化效率较低。本研究通过构建SEA~SEE 5 种肠毒素基因的重组表达载体,实现对5 种目的蛋白的表达和纯化。表达载体的选择对于目的蛋白的顺利表达至关重要,pET-22b 载体含有PelB 信号肽序列,能够将表达的目的蛋白定位于细胞外周质腔中,本实验选择pET-22b 作为表达载体,成功地表达出了5 种肠毒素的可溶性蛋白,通过SDS-PAGE和Western blot 结果可以看出,尽管均有表达,但是表达量存在差异。温度是影响可溶性蛋白表达的主要因素之一,37 ℃的表达条件可以快速制备大量的目的蛋白,但是常常会使一些蛋白累积形成包涵体,而在较低的诱导温度(16 ℃)下进行诱导表达,可以获得一定量的可溶性蛋白,由此证明,16 ℃更有利于可溶性活性蛋白的表达。本研究在一定程度上解决了多种肠毒素标准品来源困难的问题,为以后开发肠毒素的快速检测方法奠定了基础。

