模拟体内环境下血栓形成及药物溶栓作用
任莉莉 张胜海 程昆木 杨凌鉴 黄九林
摘 要:研究应用芯片灌注模型成功模拟体内环境分析不同管径对血栓形成和溶解的影响,并通过荧光显微镜实时检测了溶栓药物对血栓溶解的作用。通过对比研究,发现血栓容易在细小管道内生成,且溶栓所需时间较长。两种不同溶栓药物纳豆激酶(NK)和蚓激酶(LK)对血栓的溶解情况有明显不同,在相同管径和流速条件下,NK和LK质量浓度均为2.5 mg/mL时溶解血栓时间分别为21、12 min;高质量浓度药物溶解血栓速度更快,且LK作用效果比NK较为显著。通过荧光标记,LK可同时减少纤维蛋白原和纤维蛋白,从而高效溶解血栓。
关键词:纳豆激酶;蚓激酶;微流控芯片;血栓形成;血栓溶解
中图分类号:R965.1 文献标识码:A文章编号:1001-5922(2022)02-0001-05
血栓栓塞性疾病(Thromboembolic disease,TD)涉及心血管、肾脏科、神经内科、外科、骨科、肿瘤等多个领域,在很多方面影响着人体健康。纤维蛋白聚合成网状后和血小板一起形成能够止血的凝块,同时也可以生成病理性血管栓塞[1]。体内纤维蛋白凝固和溶解系统是互相协调的,用来保持血栓形成和溶解之间的平衡。一旦平衡打破,病理状况就会发生。纤维蛋白原是纤维蛋白的前体物质,由两个相同亚单位组成,包含3个多肽链。在凝血酶的作用下,纤维蛋白原转变为纤维蛋白,再通过聚合作用形成纤维蛋白凝块。从而引起心肌梗塞、血管栓塞等疾病。纤维蛋白原的活化也与炎症、肿瘤生长和其他疾病有关[2-3]。
降解纖维蛋白是一个重要的治疗血管栓塞性疾病的方法。纤维蛋白溶酶可以直接水解纤维蛋白。其中纳豆激酶(Nattokinase,NK)是从传统食品纳豆、豆豉中提取出来的,有纤溶酶原激活作用,也可以直接溶解纤维蛋白。纳豆激酶的纤维蛋白溶解活性可以在血液中持续3 h[4-5]。蚓激酶(Lumbrukinase,LK)是从蚯蚓中提取的一种丝氨酸蛋白酶,具有很强的溶解纤维蛋白和血栓的能力[6-7]。这两种酶来源丰富、安全有效,是很有潜力的溶栓药物。很多体外血栓形成和溶解实验是在封闭的搅拌条件、培养皿或修饰的流动小室进行的[1,8-9]。为了更好地建立一个体外研究血栓栓塞性疾病的模型,本研究用聚二甲基硅氧烷(PDMS)制备微流控芯片,胶原蛋白修饰管道,模拟人体内微动脉血管[10-12],用少量的血样和凝血酶在芯片管道内形成血栓。在流动条件下,用荧光显微镜观察血栓在不同管道形成情况及其在NK和LK作用下的溶解过程,为体外研究血栓栓塞性疾病的治疗提供更为有效的方法。
1 结果与讨论
1.1 血栓形成分析
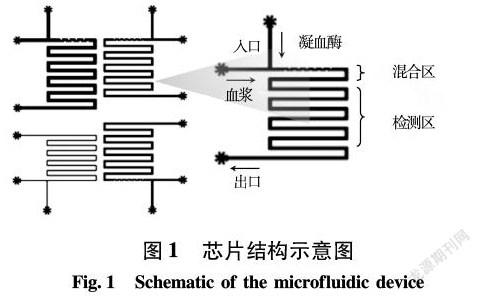
本研究制备了不同管径的微流控芯片反应区(见图1),模拟不同直径血管,芯片管径高均为35 μm,宽分别为300、200和100 μm。其中一个操作区示意图放大后可以看到两个入口处分别加入血浆和凝血酶,溶解血栓时为溶栓药物的进口;波浪处有助于溶液充分混合;可利用显微镜在检测区进行观察;剩余反应液由出口流出。进口和出口处连接带有医用级聚乙烯管的不锈钢管,连接注射泵进行液体的灌注。
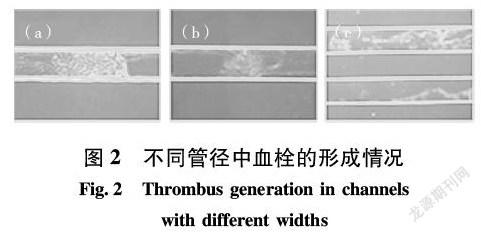
连续注射血浆和凝血酶(10 min)形成血栓,各个管径内血栓的生成情况如图2所示。在灌注过程中,凝血酶激活纤维蛋白原发生凝集反应,血小板聚集,纤维状物质出现。随着持续的注射血浆和凝血酶,上述过程不断循环,血栓变的更多更大。在同样的注射条件下,100 μm的管道内液体流动受到的阻力相对较大,当一处有纤维蛋白覆盖时,凝块很容易快速生长,堵塞管道(见图2(a)示),且这样的部位有多处。300 μm的管径中液体流动受到的阻力较小,没有大的血栓生成,形成的血栓小而松散(见图2(c)示)。200 μm管径内的血栓形成情况介于前两者之间(图2(b)示)。从实验结果可以看出,血栓容易在细小管道内生成,即血栓栓塞易发生在微血管中。该方法模拟血管内血栓形成的可行性较好。
1.2 血栓溶解结果
1.2.1 不同管径对血栓溶解的影响
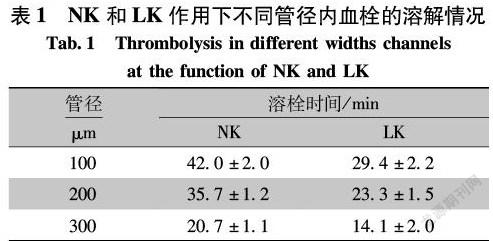
当向不同管径的芯片中以1.5 μL/min的流速注入溶栓药物NK和LK(1.5 mg/mL)时,从表1可以看出,随着芯片管径的增大,血栓溶解需要的时间越少;不同管径内血栓溶解情况基本一致,LK的溶栓时间均少于NK,且LK溶栓效果优于NK;100 μm管径中的血栓溶解时间最长。在同样的注射条件下,100 μm的管道内血栓较多且密度较大,有的地方甚至被堵塞,药物流动时受到的阻力较大,溶解时也需要较长的时间。300 μm的管径中血栓小而松散,液体受到的阻力较小,溶解时所需时间较少。200 μm管径内的血栓溶解情况则介于前两者之间。结合不同管径血栓形成情况,以200 μm管径模型进行后续实验。
1.2.2 不同浓度药物对血栓溶解的影响
溶栓酶的浓度越高,血栓溶解需要的时间越少;同一浓度下,血栓在药物作用下随着时间的增加逐渐减少,这一规律在两种药物中均适应。2.5 mg/mL的NK和LK溶解血栓时间分别为21 min和12 min;0.5 mg/mL的NK和LK溶解时间则分别为60 min和39 min(见图3)。在相同条件下,LK溶解血栓的时间比NK少;药物作用一定时间后,血栓溶解速率加快,面积-时间曲线变陡。可能由于持续的注射,加之管道有所阻塞使得流动液量变小,所受阻力增大,溶液在管道有所积累,导致之后溶解速率加快;另一方面药物已和血栓充分接触,血栓溶解作用增强。随后血栓溶解速率变缓。
随着药物浓度的增加,血栓溶解速率也增加;在相同条件下,LK的平均溶解速率比NK大(见表2)。LK来源于动物组织,NK来源于微生物组织,可能因为来源不同,LK对人体血栓溶解作用更好[7]。在接近静止状态下,NK和LK溶栓时间分别可达260 min和150 min。血小板丰富的血栓不容易溶解,血小板被激活后可以抑制血液内纤溶酶的产生,并通过释放的纤溶酶原激活剂的抑制剂\|1(PAI\|1)和α2-抗纤溶酶中和纤溶酶。此外,血小板通过它们的αⅡbβ3受体连接到纤维蛋白上引起凝块缩回,这可能阻止了纤维蛋白溶解剂在血栓内的扩散[13]。在流动条件下,小的纤维直接通过溶栓药物进行渗透溶解,大的凝块从外部开始溶解,包括外缘小的纤维和栓块。随着管道内液体的流动,溶解产生的碎片立即被运走;同时加强了药物的渗透作用,血栓逐渐变小以致消失。对比近静止状态下的血栓溶解,高流速明显增加了血栓的溶解速率。gzslib2022040121111.2.3 荧光成像
红色荧光素罗丹明(Rhodamine B isothiocyanate, RBITC)标记的纤维蛋白和绿色异硫氰酸荧光素(Fluorescein isothiocyanate,FITC) 标记的纤维蛋白原均在血栓荧光图中存在(见图4),说明血栓中同时存在纤维蛋白和纤维蛋白原。两种荧光在蚓激酶作用下随着溶解时间的延长变的越来越弱,说明蚓激酶可以同时减少纤维蛋白和纤维蛋白原。在溶解时,面积和荧光强度有同样的降低趋势,溶解时间越长,它们变的越小,甚至为0(见图5)。有时该值有所增大,其原因为管道内观测处上游血栓降解碎片随着液体的流动在该处有所停滞。蚓激酶还可以激活纤溶酶原,间接溶栓;吸附并水解凝血因子,发挥间接抗凝作用[7]。蚓激酶可作为一种有效的溶栓药物进行血栓疾病的治疗。
2 实验部分
2.1 芯片制备
用光刻蚀法制备芯片。在硅片表面覆盖一层光刻胶,透过光学掩膜将光刻胶暴露于紫外灯下,将芯片模型转移到芯片上,蚀刻未暴露的光刻胶。将成型的光刻胶作为模板,覆盖PDMS,固化后将带有底片的PDMS 结构取下,连接在载玻片上,85 ℃烘烤3 d。进口和出口处连接带有医用级聚乙烯管的不锈钢管,连接注射泵进行液体的灌注。用质量浓度75%乙醇清洗芯片,再用蒸馏水清洗。注入230 μg/mLⅠ型酸溶性胶原蛋白 (溶剂浓度为0.5 mol/L乙酸,pH2.8),潮湿环境下放置60 min,用pH7.4的磷酸盐缓冲液(PBS)洗去多余的未吸附的蛋白,置于洁净环境下备用[14-15]。
2.2 血栓形成
抽取正常人體的新鲜血液,立即与质量浓度为3.2%柠檬酸钠溶液混合(体积比为1∶9),在转速为800 r/min、温度20 ℃条件下,离心15 min取上清液,获得血小板丰富的血浆,-70 ℃保存。用时将冷冻的血浆样品在温度37 ℃水浴中解冻3 min。用注射泵将血小板丰富的血浆注入不同管径的芯片管道内,流速为1.5 μL/min;同时注入0.14 U/μL的凝血酶,流速为0.5μL/min,反应10 min。用显微镜观察整个血栓形成过程。
2.3 血栓溶解
2.3.1 不同管径对血栓溶解的影响
血浆和凝血酶分别按2.2中浓度和流速注入3种不同管径(宽分别为100、200、300 μm)的芯片反应10 min,以1.5 μL/min的流速注入纳豆激酶和蚓激酶(质量浓度1.5 mg/mL),用显微镜实时观察其溶解过程。在特定区域至少检测3组,溶解时间显示其标准偏差(±SD)。选择血栓形成量适宜和溶解速度适中的管径进行后续实验。
2.3.2 不同浓度药物对血栓溶解的影响
形成稳定血栓后,纳豆激酶和蚓激酶分别以0.5、1.5和2.5 mg/mL质量浓度注入芯片内,流速均为1.5 μL/min。同时设置低流速对照实验,即以缓慢流速0.2 μL/min注入纳豆激酶和蚓激酶(质量浓度1.5 mg/mL),研究动态和近似静态条件下的血栓溶解过程。为了进一步比较不同质量浓度下的血栓溶解速率,平均溶解速率可由如下公式计算:
Rt=(Si-Sf)/T
式中:Rt为平均溶解速率;Si和Sf分别为初始和最终血栓的面积(面积为任意单位);T为总溶解时间。
2.3.3 荧光成像
为了清楚地观察溶解过程中血栓构成物质的变化,在已形成血栓的芯片内加入10 μL鼠抗人纤维蛋白抗体(50 μg/mL),4 ℃过夜,用pH7.4的磷酸盐缓冲液清洗除去未结合的抗体。加入10 μL RBITC标记的羊抗鼠免疫球蛋白M(IgM)(100 μg/mL),4 ℃条件下反应12 h,用来标记血栓中的纤维蛋白。然后,用PBS清洗后,加入10 μL FITC连接的羊抗人纤维蛋白原抗体(100 μg/mL)标记血栓中的纤维蛋白原,4 ℃过夜反应后用磷酸盐缓冲液清洗除去多余未反应抗体。用荧光显微镜观察不同时间特定区域血栓的变化情况,用Image-Pro Plus 6.0分析计算累计荧光密度值和相应的面积。
3 结语
用微流控芯片模拟体内血管环境,光透性好,在显微镜下可清晰的观察整个反应过程;体积较小,每次所用样品量仅需几十微升,可以同时在不同管径通道进行实验,反应迅速,大大减少了实验时间。本研究所设计模型成功实现了体外模拟血管内血栓的形成,并可实时监测药物溶栓过程。与体外静态、搅拌或开放式流动条件下的血栓形成和溶解模型相比,该体系为类似封闭环境,用注射泵控制液体流速,管道内通过扩散和压力介导的渗透效应使得溶栓酶能更好地作用于血栓,更加符合真实血管中药物作用情况。通过荧光标记,可以进一步研究药物的作用机制。该研究结果有利于增强血栓体外和体内实验结果之间的连接,开发新的溶栓药物,对血栓栓塞类疾病的基础研究具有重要意义。
【参考文献】
[1] 倪庆仁,戴进前,张迪,等.血栓预防策略及研究进展[J].实用心脑肺血管病杂志,2021,29(1):6-9.
[2] 黄劲,尹小建,黄芳.纤维蛋白原相关药物研究进展[J].药学研究,2019,38(3):167-171.
[3] 邵雪波,唐卫东,陈琪,等.早期应用人纤维蛋白原对创伤患者凝血功能及预后的影响[J].全科医学临床与教育,2020,18(7):607-613.
[4] 闫泉香,冯利,徐峰,等.纳豆激酶的溶栓作用及其机制研究[J]。食品工业科技,2021,42(24):340-346.
[5] 马上超,杨迪,熊坤,等.纳豆激酶生理功能及其增产增效与改性研究[J].湖北民族大学学报(自然科学版),2021,39(2):162-166.
[6] 肖秋萍,左可轩,李颖萌,等.蚓激酶治疗缺血性脑卒中的研究进展[J].中国当代医药,2021,28(8):37-40.gzslib202204012111[7] 林佳艳,王文文,唐梅,等.秉前环毛蚓蚓激酶的提取及活性研究初报[J].南方农业,2019,13(19):66-78.
[8] LI Q,LIU X,LU Z,et al.Conjugation of urokinase to water-soluble magnetic nanoparticles for enhanced thrombolysis[J].Applied Sciences,2019, 9(22): 1-13.
[9] LIU S,ZHU J,LIU C,et al.Synthesis of sustained release/controlled release nanoparticles carrying nattokinase and their application in thrombolysis[J].Pharmazie,2021,76(4):145-149.
[10] 黎洋,丁玲,邓素容,等.在生理流动条件下分析血小板黏附聚集的简易微流控芯片技术[J].军事医学,2017,41(7):586-593.
[11] 陈静,丁玲,何翠,等.简易微流控芯片技术在生理流动条件下体外动态分析阿司匹林和氯吡格雷对健康志愿者血小板黏附聚集的影响[J].中国医学科学院学报,2018,40(3):299-307.
[12] 戚晓菁,李学进.微流控芯片技术在血细胞变形和流动性分析研究中的应用进展[J].实验流体力学,2020,34(2):1-10.
[13] GRAHAM D A,HUANG T C,KEYT B A,et al.Real-Time measurement of lysis of mural platelet deposits by fibrinolytic agents under arterial flow[J].Annals of Biomedical Engineering,1998,26:712-724.
[14] 司朝霞,韩文.应用于血液检测的微流控芯片制造工藝及应用研究现状[J].医疗卫生装备,2021,42(2):93-98.

