从江田鱼肠道微生物多样性分析
李小义,申晓东,张效平,杨 星,关 梅,王 雪
(贵州省农业科学院水产研究所/贵州省特种水产工程技术中心,贵阳 550025)
肠道微生物的组成对维持宿主生理和代谢稳态至关重要,同时与宿主神经、内分泌及免疫系统的发育和功能有直接关联[1-4]。人类胃肠道中有1×103~1×104种微生物,是人体细胞数量的10 倍,因此,肠道微生物常被称为遗忘的器官[5]。肠道微生物有外源和原生群体的区别,二者均与胃肠道消化相关,但外源微生物具有游离、暂时性的特征,原生微生物则是定植在消化道表面的核心群落,并对外来微生物在肠道表面定植有抵抗作用[6-8]。肠道微生物由真菌、酵母菌、病毒、细菌及古细菌等多种成员构成,其中,细菌是组成肠道微生物的主要区系。鉴于肠道细菌对宿主健康的重要影响,近年来,肠道细菌的多样性、功能及作用机制成为生物学研究的热点。
鱼类与其周围环境及微生物具有独特的紧密关系,可能是互惠的,也可能是有害的。因生活史、生态和环境因素的不同,鱼类肠道细菌的组成在物种和个体之间有很大的差异。占主导地位的非洲慈鲷雄鱼肠道微生物中益生菌丰度高,而从属雄鱼肠道微生物中病原菌丰度高,同时占主导地位的雄鱼Alpha 多样性也高于从属雄鱼,表明肠道细菌多样性受群体地位影响[9]。鲤科(Cyprinidae)鱼的4 个亚科鱼类肠道微生物多样性分析表明,同亚科的鱼肠道菌群相似性较高,而不同亚科的鱼肠道菌群差异较大[10]。喂食不同浓度壳聚糖,虹鳟鱼(Oncorhynchusmykiss)肠道菌群多样性、优势菌种类及虹鳟鱼对嗜水气单胞菌抗感染能力均有差异,表明虹鳟鱼肠道菌受饲料成分的影响[11]。与健康卵形鲳鲹(pompano)肠道菌比较,患病鱼肠道菌种类减少,疑似病原菌黑海弧菌相对丰度由健康鱼肠道中的17.19% 上升到 54.53%[12]。
稻田养鱼在中国有着悠久的历史,《魏武四时公制》中记载:“郫县子鱼黄鳞赤尾,出稻田,可以为酱”,表明早在1 700 年前的三国时代,中国就已经有稻田养鱼这一养殖模式。2011 年,贵州从江稻鱼鸭系统入选全球重要农业文化遗产保护试点地。2013年,从江稻鱼鸭系统入选第一批中国重要农业文化遗产。相较于池塘和其他水域环境,稻田养殖环境不稳定,易受水稻栽培过程水体深度、温度、水稻遮蔽、田内食物种类和数量等的影响[13-15]。因此,稻田养殖鲤鱼(Cyprinus carpio)与池塘养殖鲤鱼肠道细菌种类、丰度均存在差异。本研究分别采集稻田养殖不同时间的从江田鱼样品,解剖取其肠道,对其肠道细菌的多样性进行测序分析,旨在了解稻田养殖鲤鱼肠道细菌多样性,为益生菌饲料开发研究、病原菌防治提供理论依据。
1 材料与方法
1.1 材料
2018 年 6 月、8 月和 11 月,分别从贵州省从江县稻鱼鸭养殖田采集田鱼,每次15 尾。
1.2 田鱼肠道取样
迅速带回实验室,在超净台中对田鱼进行解剖取样。用75%乙醇对田鱼体表消毒后用解剖剪沿肛门朝前对鱼进行解剖。清理出肠道,用75%乙醇擦拭消化道外壁,取样时清洗肠道内容物,只取肠道,用无菌 PBS 缓冲液冲洗 3 次,每 5 尾 1 个组,每个取样时间点3个重复。6月采集的田鱼为刚放入稻田1 d 的鱼,样品名称编号为RS1;8 月采集的田鱼在稻田中饲养了2 个月,样品名称编号为RS2;11 月采集的田鱼在稻田中饲养了5个月,样品名称编号为RS3。
1.3 肠道微生物DNA 提取
采用CTAB 方法对样本的基因组DNA 进行提取,之后利用琼脂糖凝胶电泳检测DNA 的纯度和浓度,并将合格样品干冰保存寄送北京诺禾致源生物信息科技有限公司进行测序分析。
1.4 16S rDNA 文库构建及多样性分析
选 择 细 菌 16S V4 区(515F:5′-GTGCCAGCM GCCGCG GTAA-3′和806R:5′-GGACTACHVGGGTWTCTAAT-3′),使用带 Barcode 的特异引物为模板,进行PCR 扩增,样品纯化后构建文库,使用HiSeq2500 PE250 上机测序。根据Barcode 序列和PCR 扩增引物序列从下机数据中拆分出各样本数据,截去Barcode 和引物序列后使用FLASH(V1.2.7)对每个样本的reads 进行拼接,得到的拼接序列为原始 Tags 数据(Raw tags);参照 Qiime(V1.9.1)的 Tags质量控制流程,进行Tags 截取、Tags 长度过滤等处理,得到的Tags 序列通过与物种注释数据库进行比对检测嵌合体序列,去除其中的嵌合体序列,得到最终的有效数据。
利用Uparse 软件(Uparse v7.0.1001)对所有样本的全部有效数据进行聚类,默认以97%的一致性(Identity)将序列聚类成为 OTUs(Operational taxonomic units),同时选取OTUs 的代表性序列。对OTUs 序列进行物种注释,用Mothur 方法与SILVA132 的SSUrRNA 数据库进行物种注释分析(设定阈值为0.8~1.0),获得分类学信息并分别在各个分类水平界(Kingdom)、门(Phylum)、纲(Class)、目(Order)、科(Family)、属(Genus)、种(Species)统计各样本的群落组成。使用MUSCLE(Version 3.8.31)软件进行快速多序列比对,得到所有OTUs 代表序列的系统发生关系。最后对各样本的数据进行均一化处理,以样本中数据量最少的为标准进行均一化处理,后续的Alpha 多样性分析和Beta 多样性分析都是基于均一化处理后的数据。
2 结果与分析
2.1 细菌16S rRNA 基因测序结果分析
基于Illumina HiSeq 测序平台测序,构建PCR-free 文库,然后进行双末端(Paired-End)测序。通过对Reads 进行拼接,平均每个样品测得88 800 条Tags,经过质控平均得到80 958 条有效数据,质控有效数据量为73 339,质控有效率达82.59%。以97%的一致性(Identity)将序列聚类成为OTUs,共得到3 699 个 OTUs。其中 RS1、RS2 和 RS3 组分别获得1 336、483、3 193 个 OTUs。对 OTUs 序列与 Silva132数据库进行物种注释,注释结果中,共有1 607(43.44%)个OTUs 注释到属水平。其他多样性指数如表1 所示。3 个样品组的覆盖率均大于99.9%,表明本次检测结果具有较好的覆盖性。

表1 基于16S rRNA 基因序列的细菌多样性指数
图1 为蜜蜂群图,图1a 为所有样本不同组别间物种总数的散点分布,即丰富度;图1b 为Shannon 指数的比较,反映不同样本间物种多样性和均一性的差别。通过Wilcoxon 秩和检验,发现测得的物种数在 RS2-RS3、RS1-RS2、RS1-RS3 两两组间具有显著差异(P<0.05),显著性P分别为 0.000 3、0.010 4、0.010 4。Shannon 指数在 RS2-RS3、RS1-RS2 两两组间具有显著差异(P<0.05),显著性P分别为0.019 0、0.025 4。Shannon 指数在RS1-RS3 2 组间不具有显著差异(P>0.05),P为0.827 6。结果表明,鲤鱼在稻田里养殖的不同时间点,肠道微生物群落组成存在差异,RS1 组和RS3 组样本微生物菌群多样性高于RS2 组。
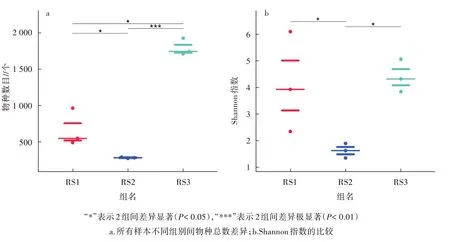
图1 样本组间多样性差异
2.2 细菌多样性分析
田鲤鱼肠道微生物组成门水平分析结果如图2所示。由图2 可知,3 组样品肠道微生物优势菌门差异较大。RS1 组样品中厚壁菌门(Firmicutes)、蓝细菌(Cyanobacteria)、变形菌门(Proteobacteria)和拟杆菌门(Bacteroidetes)为主要优势菌,所占丰度分别为33.43%、28.15%、22.94%和9.79%。RS2 组样品中的优势菌门为变形菌门,所占丰度为94.05%,其次为厚壁菌门(2.58%)、梭杆菌门(Fusobacteria,2.05%)和放线菌门(Actinobacteria,0.68%)。RS3 组样品中优势菌门为蓝细菌(40.69%)、变形菌门(31.65%)、梭杆菌门(10.30%)和厚壁菌门(8.89%)。

图2 样本门水平上的物种相对丰度
属水平分析(图3),RS1 组和RS3 组样品微生物种类较RS2 组丰富。RS2 组样品相对丰度大于1%的优势菌属有2 种,其中,气单胞菌属(Aeromonas)相对丰度最高,为68.86%;其次是鲸杆菌属(Cetobacterium,1.46%)。RS1 组微生物多样性较高,相对丰度大于1%的优势菌属有9 种,依次为未分类的蓝藻细菌(unidentifiedCyanobacteria,28.11%)、Romboutsia(13.33%)、未分类的梭菌属(unidentifiedClostridiales,8.37%)、鞘氨醇单胞菌属(Sphingomonas,4.62%)、Paeniclostridium(2.34%)、叶杆菌属(Phyllobacterium,2.15%)、短波单胞菌属(Brevundimonas,1.60%)、螺杆菌属(Helicobacter,1.11%)、Turicibacter(1.07%)。RS3 组相对丰度大于1%的优势菌有5 种,未分类的蓝藻细菌相对丰度最高,为40.63%;其次是气单胞菌属(12.41%)、鲸杆菌属(10.20%)、未分类的梭菌属(2.07%)和链球菌属(Streptococcus,1.44%)。

图3 样本属水平上的物种相对丰度
3 讨论
鱼类肠道细菌研究可追溯至20 世纪上半叶。1927 年,Reed 等[16]对 34 尾黑线鳕鱼[Melanogrammusaeglefinus(Linnaeus,1758)]的肠道菌进行了培养分离,获得的菌株主要包括变形杆菌、假单胞菌、无色杆菌、黄杆菌、芽孢杆菌等菌属。最初,研究者认为鱼类肠道细菌主要来自周围环境或者食物中,且细菌数量较少[17,18]。但这仅是基于可培养研究得出的结论,随着高通量测序技术的发展,人们对鱼类肠道细菌的认识逐渐增加。门水平分析,转基因鲤鱼肠道中厚壁菌门细菌较多,对照鲤鱼肠道中拟杆菌门细菌较多[19]。基于可培养菌和RT-PCR-DGGE分析,喂食含有β-葡聚糖的饲料组鲤鱼肠道中腐败希瓦氏菌和弧菌含量少于对照组,表明有益的饲料成分有助于防止病原微生物的入侵[20]。门水平分析,冷水性鲤鱼肠道微生物以厚壁菌门、变形菌门、拟杆菌门和放线菌门为主[21]。
本研究采集了稻田养殖不同时间点的田鲤鱼,对其肠道细菌多样性进行了高通量测序研究,为了解不同养殖环境鲤鱼肠道微生物组成提供了数据支持。门水平分析可知,稻田养殖不同时间点鲤鱼肠道的主要优势菌种类和相对丰度均有差异,可能与不同养殖阶段,稻田可食用饵料种类不同有关。RS3 组鱼样采集阶段,水稻已收割,田鱼主要以浮游藻类为饵料,所以田鲤鱼肠道中,蓝细菌相对丰度最高。属水平分析可知,RS1 组田鱼肠道优势菌属较RS2 和RS3 组丰富,可能是受池塘和稻田养殖环境差异影响。

