MTHFR基因C677T多态性对进展期胃癌术后行SOX方案化疗的安全性及预后的影响
郑临海,余春,汪珍珍
根据2020年我国国家癌症中心的数据,胃癌的新发人数及死亡人数均位居第三,严重危害了我国国民的健康。近年来,虽然早期胃癌的诊断率较前有所提高,但进展期胃癌患者仍占胃癌患者的绝大多数。临床主要以手术为主,联合化疗、放疗、免疫治疗等手段,从而延长患者生存期,改善生活质量。局部进展期胃癌的一线化疗是以奥沙利铂为基础的联合化疗,如XELOX、SOX方案,但仍难以控制肿瘤的复发及转移。随着分子生物学的发展,肿瘤的治疗已经进入了精准的个体化治疗的时代,通过分子分型或二代测序来明确哪类胃癌患者通过相关治疗后明显受益是往后的研究方向。
亚甲基四氢叶酸还原酶(MTHFR)在叶酸代谢过程中起着重要作用,其基因中存在C677T多态性,包括野生型CC、杂合突变型CT及纯合突变型TT,MTHFRC677T突变使得MTHFR的活性降低,抑制叶酸代谢的循环,影响嘌呤或嘧啶的合成,导致DNA合成或修复受损。近年来研究表明,MTHFRC677T多态性与肺癌[1]、胰腺癌[2]、胃癌[3]、结直肠癌[4]、乳腺癌[5]、食管癌[6]等多种肿瘤的易感性存在相关性。同时,MTHFR C677T多态性与肿瘤患者对氟尿嘧啶、铂类药物的毒副反应相关[7],与MTHFR C677T CC基因型携带者相比,CT/TT基因型携带者的血液学毒性风险显着增加[8-9]。然而,MTHFRC677T多态性与SOX方案化疗的安全性研究较少,且与肿瘤患者化疗疗效是否相关尚存在争议。因此,本研究探讨MTHFRC677T多态性对进展期胃癌术后行SOX方案化疗的安全性及预后的影响,现报道如下。
1 资料与方法
1.1 纳入与排除标准 纳入标准:(1)经病理检查确诊为胃癌,且无远处转移;(2)行胃癌根治术治疗,术后行SOX方案化疗;(3)治疗前6个月内未服用过免疫调节剂和激素类药物。排除标准:(1)合并有严重肝肾功能不全者;(2)不能耐受化疗或拒绝化疗者;(3)没有足够标本用来检测MTHFR基因遗传变异者;(4)术后病理分期为早期胃癌或TNM分期Ⅳ期;(5)不能配合随访者;(6)合并有其他恶性肿瘤者。
1.2 一般资料 本研究为回顾性研究,收集2015年1月至2018年4月温州医科大学附属衢州医院(衢州市人民医院)收治的胃癌根治术后规范化行SOX方案化疗的胃癌患者,通过医院的病历系统收集整理患者的临床资料,微信、电话或门诊形式随访。共纳入62例,其中男45例,女17例;年龄30~87岁,平均(64.1±12.1)岁。
1.3 方法
1.3.1 治疗方案及随访 患者术前胃镜病理检查确诊胃癌,完善术前检查后行胃癌根治术。术后3~4周行一般健康状态(PS)评分,PS评分≤2分时接受SOX方案化疗。具体如下:奥沙利铂130 mg/m2ivdrip d1,替吉奥40 mg/m2po bid d1~14,每21天重复。通过患者病历、电话随访、门诊随访或微信随访的方法来评价患者的预后。随访截止时间为2021年4月30日。肿瘤复发、失访、到随访截止时间或者死亡视为研究终点。
1.3.2 MTHFRC677T多态性分型 MTHFRC677T多态性分型委托上海科医联创医学检验所完成。用于MTHFRC677T多态性分型的标本为患者术后病理标本的石蜡片,DNA提取试剂提取总DNA。采用primer5.0进行引物设计,并利用Pub Med在线数据库核对引物的正确性和特异度。限制性片段长度多态性聚合酶链反应(PCR-RFLP)技术检测MTHFR C677T位点基因型。MTHFR C677T位点基因型引物上游序列为 5’-AGGACAGTGTGGGAGTTTGGG-3’,下 游 序 列 为 5’-GAAAAGCTGCGTGATGATGA-3’。MTHFR C677T位点基因分型为野生型CC、杂合突变型CT及纯合突变型TT。主要试剂与仪器:琼脂糖凝胶(北京赛百盛基因技术有限公司,中国),DNA提取试剂盒(康为世纪生物科技股份有限公司,中国),Taq Man SNP基因分型人类检测试剂盒及Taq Man基因分型预混液(赛默飞,美国)。Simpli Amp PCR仪(ABI,美国),3500dx测序仪(ABI,美国),稳定DNA电泳仪(Bio Rad,美国),高速离心机(Beckman,美国)。
1.4 疗效评价 患者在完成前2个化疗周期后即开始通过询问病史、体格检查及化验综合评价化疗的不良反应。参照常见不良反应评价标准(CTCAE)5.0版来记录及分级(1~5级)。本研究主要评价血液系统毒性(贫血、骨髓细胞过少、发热性中性粒细胞减少、弥漫性血管内凝血),胃肠道毒性(恶心、呕吐、腹胀、腹水、便秘、腹泻、消化不良),周围神经毒性及手足综合症。
1.5 统计方法 采用SPSS18.0进行统计分析。符合正态分布的计量资料以均数±标准差表示,组间比较采用独立样本t检验;计数资料采用2检验或Fisher精确概率法。采用2检验考察患者各基因型频同基因型临床资料比较 62例中MTHFRC677T位点基因型分布分别为CC型32例(51.61%),CT型23例(37.10%),TT型7例(11.29%),其基因型分布符合Hardy-Weinberg遗传平衡定律(2=0.806,P=0.369)。由于TT型患者少且考虑后期对比的方便,将CT型和TT型合并。不同基因型患者的临床资料分布均衡,见表1。

表1 不同基因型临床资料比较
2.3 进展期胃癌术后行SOX方案化疗的不良反应不同分级发生率情况 57例(91.93%)患者遭受了毒性反应,其中1级不良反应发生率32.26%(20/62)、2级不良反应发生率29.03%(18/62)、3级不良反应发生率24.19%(15/62)、4级不良反应发生率6.45%(4/62)。见表2。

表2 不良反应分布 例(%)
2.4 胃癌患者MTHFRC677T位点基因型分布与各种不良反应的关联 CT+TT基因型患者的血液系统毒性发生率为80%(24/30),高于CC基因型46.88%(15/32)(2=7.281,P=0.007),但毒性反应分级比较率是否符合Hardy-Weinberg遗传平衡定律。等级/频数表资料采用两独立样本非参数检验中的Mann-Whitney U检验。采用Kaplan-Meier方法绘制生存曲线,用Log-Rank检验分析MTHFRC677T多态性与总生存期(OS)和无病生存期(DFS)之间的差异。P<0.05为差异有统计学意义。
2 结果
2.1 进展期胃癌术后行SOX方案化疗的完成情况51例(82.26%)胃癌患者术后完成至少6个周期的SOX化疗方案。在未完成预定化疗周期的11例患者中,5例因肿瘤进展更改化疗方案,4例因血液系统毒性等化疗不良反应改为单药替吉奥口服,1例因手足综合症减少药物用量,1例因全身状况较差、不能耐受而终止化疗。
2.2 胃癌患者MTHFRC677T位点基因型分布及不无差异(Z=0.259,P=0.796);不同基因型在胃肠道毒性、周围神经毒性及手足综合症的不良反应分布差异无统计学意义(P>0.05),见表3~4。

表3 不同基因型分布不良反应比较 例
2.5 不同基因型的DFS、OS分析 62例胃癌术后患者中位随访时间为59个月(95%CI:55.18~62.81),无失访病例,其中27例患者死亡。生存分析显示,MTHFR C677T位点CC基因型与CT+TT基因型的中位DFS分别为39个月(95%CI:32.71~45.29)和44个月(95%CI:41.05~46.95),3年的无病生存率分别为65.6%和70.0%,差异无统计学意义(2=0.496,P=0.481)。MTHFRC677T位点CC基因型与CT+TT基因型的中位OS分别为55个月(95%CI:49.85~60.15)和59个月(95%CI:56.59~61.40),3年的总生存率分别为75.0%和83.3%,差异无统计学意义(2=0.606,P=0.436),见封二彩图5。
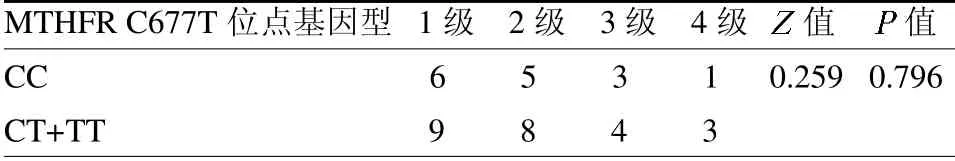
表4 不同基因型分布与血液系统毒性分级的比较 例
3 讨论
胃癌已进入多模式综合治疗,针对D2根治性术后的胃癌,有多项大型III期临床研究证实术后辅助化疗的价值。目前,可切除II/III胃癌的术后辅助化疗的I级推荐为铂类为基础的SOX或XELOX方案[10]。Park等[11]ARTIST2试验结果显示:与S-1单药相比,辅助SOX或SOXRT(SOX联合化疗)可以显著延长DFS,但相对SOX方案来看,SOXRT无额外生存获益。对于胃癌患者的用药应尽可能的个体化,从而保障患者的治疗疗效及安全性。为进一步明确哪类胃癌患者从术后辅助SOX方案化疗中获益,本研究从MTHFR C677T基因多态性方面探讨了进展期胃癌术后行SOX方案化疗的安全性及预后,为肿瘤患者用药的个体化提供了一个新的切入点。
MTHFR是维持细胞内叶酸代谢平衡的关键酶,其能催化不可逆反应将5,10-亚甲基四氢叶酸转变成5-甲基四氢叶酸;而5-Fu需在辅因子5,10-亚甲基四氢叶酸的存在下,和胸苷酸合成酶结合形成三联复合物,影响胸苷酸合成酶与dUMP的结合。有研究证实在5-Fu使用之前提高肿瘤5,10-亚甲基四氢叶酸浓度可增强对胸苷酸合成酶的抑制作用,但同时也可导致5-Fu相关的细胞毒性增加。如果患者的MTHFRC677T存在TT纯合子的变异,将预示疗效较好,但毒副反应较强。替吉奥是一种氟尿嘧啶衍生物口服抗癌剂,其包括替加氟、吉美嘧啶及奥替拉西,其中替加氟能在体内转化成5-Fu,吉美嘧啶能抑制5-Fu的分解代谢。目前替吉奥广泛运用于消化道肿瘤的化疗,如胃癌的SOX方案。Tang等[8]通过一项荟萃分析显示,MTHFRC677T多态性可预测接受5-Fu化疗的GC患者的严重血液学毒性,但不能预测效率。同时,Liu等[9]也通过荟萃分析得出,与肺癌患者MTHFR rs1801133CC基因型携带者相比,CT/TT基因型携带者的血液学毒性风险显着增加。以上两项研究结果与本研究的结果相对应。这一结果可能是由于TT基因型导致MTHFR活性降低,导致胸苷酸合酶的有效抑制(TS)和5-Fu效率增加,这可能对患者产生更大的毒性,因为5-Fu是一种细胞毒性剂[12]。MTHFR C677T多态性是否与化疗的血液学毒性分级呈正相关尚不明确,Nahid等[13]研究发现MTHFR C677T多态性可能作为3级或4级中性粒细胞减少症的预测因子,然而本研究提示MTHFR C677T多态性与血液毒性反应分级无相关性,受制于本研究的病例数偏少,难以进一步分层分析,后续需进一步探讨。
目前,MTHFRC677T多态性与肿瘤预后的相关性争议较大。Chen等[14]通过将5 423名结直肠癌患者纳入荟萃分析,得出MTHFR C677T多态性与结直肠癌患者的预后无关。同时,Yousef等[15]进行了一项103名结直肠癌患者的前瞻性队列研究,得出MTHFR C677T的基因多态性与接受5-FU/卡培他滨化疗辅助方案的结直肠癌患者的DFS没有显著关联。本研究结果显示,MTHFRC677T多态性与进展期胃癌术后行SOX方案化疗患者的DFS、OS无相关性,与Chen及Yousef等[14-15]的研究结果一致。而Meulendijks等[16]通过一项多中心2期研究调查了使用贝伐单抗联合多西他赛、奥沙利铂和卡培他滨作为60例晚期HER-2阴性胃癌患者的一线治疗,发现MTHFR C677T多态性与DFS、OS显著相关,其中TT基因型的患者预后较差。造成上述结果的差异可能与化疗方案、肿瘤类别不同相关。
综上所述,本研究通过MTHFR C677T基因多态性对进展期胃癌术后行SOX方案化疗的安全性及预后的分析,结果显示MTHFR C677T基因多态性与进展期胃癌术后行SOX方案化疗的血液学毒性发生率相关,与血液学毒性程度及患者的预后无关。同时,本研究存在一定的局限性,如本研究只收集到7例TT基因型样本,总样本量相对较少,随访时间偏短,可能影响结果的准确性,后续将进一步扩大样本量及延长随访时间进行验证。本研究为回顾性分析,有一些偏倚难以避免。

