臭氧/过硫酸氢钾体系降解酮洛芬的动力学研究*
林晓璇,王如意
(广东食品药品职业学院,广东 广州 510520)
酮洛芬(Ketoprofen,KET)是一种典型非甾体抗炎、解热、镇痛药,被广泛应用于治疗风湿性关节炎、类风湿性关节炎、关节强硬性脊椎炎、骨关节炎及痛风等。近年来,许多研究中报道,多地的污水处理厂出水、环境水体以及饮用水水源中均频繁检测出酮洛芬[1-2]。污水处理厂和自来水厂的传统工艺不能完全去除这一类污染物,倘若直接排放到自然水体中,对动植物存在重大的生态风险,甚至会影响到人的健康。因此,亟需一种高效快速的方法去除水中的酮洛芬。

前人的研究曾探讨过O3/PMS对KET的降解效果及降解机理[8-9],但未探究各种实验因素对KET降解速率的影响,也未获得自由基与KET反应的二级速率常数,本文将利用竞争实验进一步探究自由基与KET反应的二级速率常数,探讨反应温度、KET初始浓度以及溶液初始pH值等因素的变化对KET降解的影响,并建立O3/PMS体系降解KET的表观动力学方程,以期为O3/PMS体系在降解KET的应用上提供理论参考。
1 材料与方法
1.1 试 剂
酮洛芬(标准品),TCI;苯甲酸、硝基苯(标准品),阿拉丁;过硫酸氢钾、氢氧化钠、冰乙酸(分析纯),广州化学试剂厂;乙腈(色谱纯),ACS。
1.2 仪 器
LC-20A高效液相色谱,岛津;SPD-M20A检测器,岛津;pHS-3C酸度计;臭氧发生器;臭氧氧化反应器(自制);UT-500臭氧浓度检测器,爱迪尔;LZB-3WB流量计;AS20500BDT超声仪,AUTO SCIENCE;超纯水机(Smart2),TKA;AL104型电子天平,梅特勒-托利多。
1.3 实验方法
图1为本实验的反应装置图,实验开始前,先将反应液加入反应器中,再调节初始pH值以及反应温度,然后加入PMS,打开臭氧发生器,气体进入反应体系参与反应,尾气中多余的臭氧通过KI吸收后排空。气体进入体系前经气体分散器,分散成直径更小的小气泡,使反应更充分。当通气第0、2、4、8、12、16、24 min时,在反应器底部取样口取样,测定浓度。
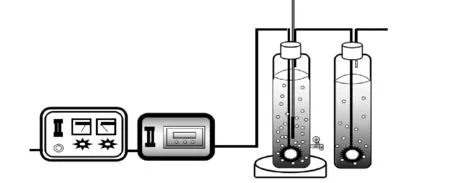
图1 反应装置
1.4 酮洛芬浓度测定方法
用HPLC测定剩余KET浓度,色谱条件如下:流动相0.5%冰乙酸:乙腈=55:45,流速1.0 mL/min,进样量 10 mL,柱温40 ℃,检测波长260 nm。
2 结果与讨论
2.1 KET与的反应速率常数


从如表1的实验结果可知,KET、NB和BA的降解符合一级动力学,其降解动力学如式(1)~式(3)所示。

表1 硝基苯、苯甲酸和酮洛芬的降解动力学

(1)

(2)

(3)

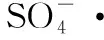
(4)
kNB=k·OH,NB[·OH]
(5)
(6)
2.2 酮洛芬初始浓度的影响

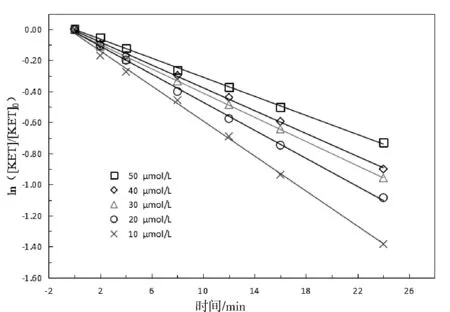
图2 不同初始浓度对酮洛芬降解的影响
2.3 温度的影响
本节讨论不同反应温度对O3/PMS体系降解酮洛芬的影响。臭氧浓度为16 μmol/L、PMS浓度为12 μmol/L,KET初始浓度为20 μmol/L,溶液初始pH值为7。结果表明,随着温度从288升至318 K,酮洛芬的降解速率常数从0.0293 min-1增大到0.0105 min-1,随着温度升高,KET的降解速率随之升高。
根据阿伦尼乌斯方程,在一定范围内,化学反应速率常数与温度变化存在比例关系,即lnk与1/T为线性关系,一般条件下,反应温度越高,反应速率越快。
(7)
(8)
根据式(7)和式(8),可求得,活化能Ea、焓变△H分别为31.49 kJ·mol-1、28.98 kJ·mol-1。一般氧化反应活化能为70~170 kJ·mol-1,O3/PMS体系降解KET所需的活化能为31.49 kJ·mol-1,活化能较低,对于一般化学反应,活化能的大小显著地影响反应速率,活化能越小,代表体系中活化分子越多,活化分子间的有效碰撞机率越大,则反应速率越快。对于任何非特殊的化学反应,升高温度可以提高整个体系中反应物的平均动能,增大活化分子有效碰撞机率,从而提高反应速率,而O3/PMS体系降解KET是一个吸热反应,升高温度有利于反应正向进行,因此升高温度既加快反应速率又加大反应限度。
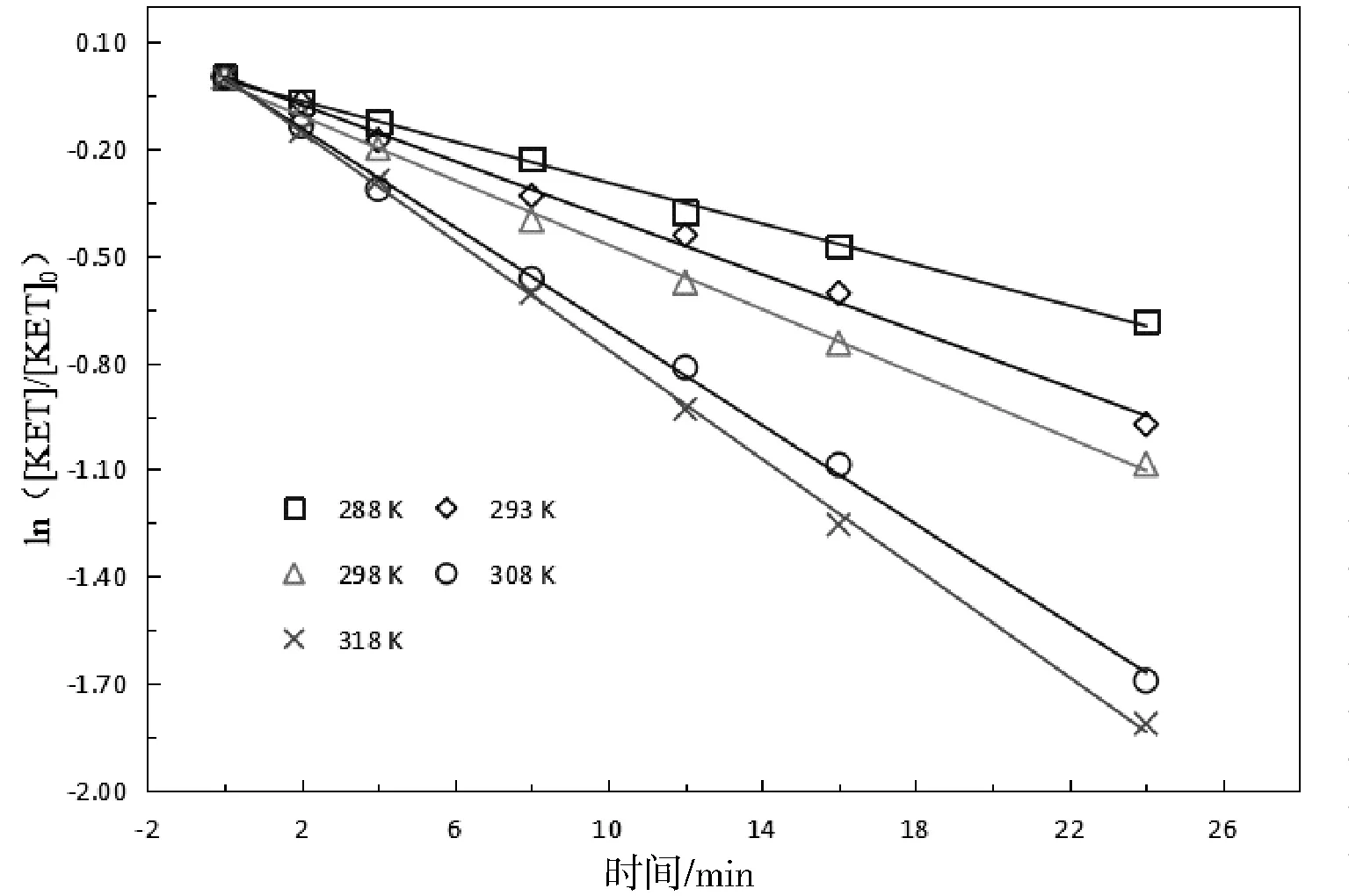
图3 不同温度对酮洛芬降解的影响
2.4 表观动力学模型
由前文的研究可知,O3/PMS体系降解KET过程中,酮洛芬降解速率常数与污染物初始浓度、反应温度有关,而在更早的研究中,曾探究过O3/PMS体系初始pH值对KET降解的影响,结果表明不同初始pH值条件下,KET的降解均符合一级动力学,当初始pH值为5、6、7、8、9时,酮洛芬降解的速率常数为0.025、0.036、0.046、0.077、0.099 min-1[8]。综上而言,降解动力学常数k是关于初始浓度、初始pH值及反应温度的函数,并由一般化学反应表观动力学模型可知。
(9)
(10)
式中,A为指前因子;k为反应速率常数,min-1;Ea为反应活化能,J·mol-1;R为气体常数,8.314J mol-1·K-1;T为反应温度,K;C0为酮洛芬初始浓度;[OH-]为初始OH-浓度,mol/L;α、β为指数。
以lnk为纵坐标,1/T、lnC0、ln[OH-]为横坐标作线性回归方程,结果如图4所示,可求得,α=-0.3667,β=0.1478,-Ea/R=-2700。从数值上看,α<0、即KET初始浓度呈降解速率常数值与负相关,随着初始浓度增大,k值减小,降解速率越慢。β>0,即体系初始pH值与降解速率常数值呈正相关,随着初始pH值增大,k值增大,降解速率越快。另外,Ea/R的值恒大于0,也就是说,对于任何非特殊的化学反应,升高温度可以提高整个体系中反应物的平均动能,增大活化分子有效碰撞机率,从而提高反应速率,而O3/PMS体系降解KET是一个吸热反应,升高温度有利于反应正向进行,因此升高温度既加快反应速率又加大反应限度。这与前文的实验结果是一致的。

图4 lnk/T与1/T(a),lnk与lnC0(b),lnk与ln[OH-](c)的关系
常数项lnA平均值为13.09,因此A的值为494296,最终动力学方程如下。
(11)
3 结 论
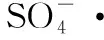
(2)O3/PMS体系能够有效地降解酮洛芬,其降解效率受溶液初始浓度、pH值和温度的影响。KET的初始浓度越大,其降解速率越小;pH值对反应有很大影响,碱性环境对KET降解有利;温度越高对酮洛芬降解越有利。
(3)在本实验设定的条件下(酮洛芬初始浓度10~50 μmol/L,温度为288-318 K,初始pH值为5~10),酮洛芬的降解符合一级动力学,表观动力学方程k=494296exp(-31494/RT)C0-0.3677[OH-]0.1478。

