雷公藤红素治疗类风湿关节炎的组学联合分析
宋新强, 任雨轩,代二琴,张 玉, 何欢欢, 范金克, 赵丽君, 彭 涛, 王 磊
(1.信阳师范学院 a.生命科学学院; b.医学院,河南 信阳 464000;2. 河南中医药大学 第二临床医学院,河南 郑州 450003)
0 引言
类风湿性关节炎(rheumatoid arthritis, RA)是一种免疫相关的疾病,通常会导致持续的关节破坏、预期寿命缩短、工作能力下降、残疾,甚至会导致死亡率增高[1]。成纤维样滑膜细胞(fibroblast-like synoviocytes, FLS)是RA病理的主要细胞类型之一[2]。在RA研究过程中,FLS随着形态变化而失去接触抑制,表达高水平的生物标志物,如c-fos、Jun-B、egr-1和基质金属蛋白酶 (matrix metalloprotease, MMP)-3,并分泌几种炎症细胞因子,如IL-6、IL-8、IL-1、TNF-α和MCP-1[3-7]。FLS是如何被激活来驱动类风湿性关节炎尚不清楚,表观遗传学可能会发挥作用[8]。
从雷公藤(TripterygiumwilfordiiHook.f.)中提取的雷公藤红素(Celastrol,CEL)在中国已广泛用于治疗类风湿性关节炎和炎症性疾病[9-13]。虽然雷公藤红素的临床疗效已被广泛报道,但其作用机制尚不清楚。体外研究表明,高剂量的雷公藤红素可以诱导细胞凋亡,并抑制FLS的生长和侵袭[14]。然而,全面筛选鉴定FLS蛋白和受雷公藤红素影响的过程需要更深入的研究。
转录本和蛋白质的高通量分析可以筛选被特效药物改变的基因表达[15-16]。转录组分析并不包含转录后修饰、翻译效率或转录转换率,所有这些都会影响编码蛋白的活性[17-18]。因此,结合转录组和蛋白质组的分析可能会更有效地识别药物所诱导的变化。在本研究中,通过采用转录组和蛋白质组分析CEL处理后滑膜细胞RNA和蛋白的表达差异,探讨雷公藤红素对RA患者FLS的影响。
1 方法
1.1 细胞培养
类风湿性关节炎患者FLS和滑膜细胞生长培养基购自细胞应用公司(Santiago, California, USA)。在37 ℃、5%CO2的条件下,在含有100 mg/L链霉素和100 U/mL青霉素的滑膜细胞生长介质中培养FLS。在对数生长期,将FLS接种到直径10 cm的培养基中(细胞浓度为1×106个 /盘)。用抗FLS标记蛋白(vimentin)的抗体(1∶50)鉴定细胞类型。用IX2-ILL100荧光显微镜进行分析。
1.2 RNA提取
将雷公藤红素溶解在DMSO中制成100 mmol/L的原液,稀释至所需浓度,使DMSO在培养基中的最终比例为1%(V/V)。人类FLS进行DMSO培养处理作为对照,使其最终比例也为1%(V/V)。将FLS接种在培养基中,然后加入5 μmol/L雷公藤红素培养 24 h。用TRIzol(Invitrogen)从FLS中分离出总RNA。RNA样本用RNase-free DNase set消化去除基因组DNA,并用RNeasy试剂盒(Qiagen)进一步纯化。使用RNA6000纳米芯片和安捷伦2100生物分析仪评估RNA样本的完整性。将完整性大于7的RNA样本进一步用于基因序列和实时PCR(见下文)。
1.3 转录组学
使用SOAPnuke软件(http://www.seq500.com/uploadfile/SOAPnuke.zip)对RNA-Seq原始读数进行质量控制和清理,以删除低质量、受污染的和带有接头的读长。最终得到的读长与人类基因组数据库(http://genome.ucsc.edu/)一致,并使用HISAT2与人类基因匹配。之后计算每个基因对应的读取数,使用“每千个碱基的转录每百万映射读取的片段”(FPKM)方法来实现RSEM算法(https://deweylab.github.io/RSEM/)中的数据规范化以及在每个样本中筛选低表达基因(FPKM<1)。NOIseq用于计算每个基因的log2FC和概率值,并采用以下标准:log2FC>1或<1,概率>0.8。使用Mapman软件进行PageMan分析,我们认为如果P<0.01,则富集项显著。
1.4 蛋白质组学
1.4.1 非标记定量蛋白质组学(Label-free)样品制备
将细胞沉淀物悬于200 μL裂解缓冲液(质量浓度4% SDS, 100 mmol/L DTT, 150 mmol/L Tris-HCl pH 8.0)中,置于冰上。用匀浆器(Fastprep-24,MP Biomedical,California,美国)搅动破碎细胞,并煮沸5 min。进一步超声处理样品,再煮沸5 min。14 000 r/min离心15 min以去除未溶解的细胞碎片。收集上清液并用BCA蛋白质测定试剂盒(Bio-Rad,美国)定量。
1.4.2 液相色谱-串联质谱(LC-MS)法
将每个肽样品在Empore SPE C18膜片上脱盐,然后通过真空离心浓缩,并在40 μL 0.1%(V/V)三氟乙酸中复原。将肽(5 μg)上样到缓冲液A(2%乙腈和0.1%甲酸)中的反相C18柱(Thermo Scientific Easy Column)上,120 min内用IntelliFlow技术在Easy nanoLC系统(Proxeon Biosystems,现更名为Thermo Fisher Scientific)上以250 nL/min的流速用缓冲液B(80%乙腈和0.1%甲酸)的线性梯度进行分离。液相色谱系统连接到Q萃取电喷雾电离-串联质谱仪(美国Waters公司)。对每个样品进行三次质谱实验。
1.4.3 序列数据库检索与分析
使用可免费获得的MaxQuant软件1.3.0.5(www.maxquant.live)对数据库uniprot_human_152544_20160420.fasta(总条目152 544,下载于2019年12月20日)进行了质谱数据分析。根据Max-Quant软件中的默认算法执行共片段化。根据归一化光谱蛋白(LFQ)强度计算蛋白丰度。蛋白质组学结果已保存在PRIDE信息库的ProteomeXchange Consortium中,数据集标识符为PXD006350。
1.5 Cel与预测靶蛋白对接模拟
从RCSB蛋白数据库(http://www.pdb.org/pdb/home/home.do)中下载预测靶蛋白的晶体结构,使用YASARA对选定的目标蛋白与Cel进行对接模拟。将氢原子添加到蛋白质受体上后,使用CHARMM力场进行对接模拟。把侧链至少部分落在以配体Cel为中心,直径为1.2 nm的球体内的残基定义为Cel的结合位点。其他参数使用默认值,并对每个配体执行遗传算法。
1.6 实时荧光定量PCR(qRT-PCR)检查目的基因mRNA表达
按照RNAiso Plus试剂说明提取各组FLS RNA,采用NanoDrop2000 紫外分光光度计检测RNA 的纯度及浓度。按照TaKaRa中PrimeScript RT Master MiX操作说明进行cDNA的合成,根据SYBR Green Master(罗氏) 试剂盒说明书检测COMP、MMP1、LAMC1、ANXA6、THBS1和SERPINE2 mRNA水平,以β-actin作为内参。扩增体系包括:上游引物(10 μmol/L)0.5 μL、下游引物(10 μmol/L)0.5 μL、cDNA 2.5 μL、TB GreenTMPremix Ex TaqTMII 5 μL、RNase Free dH2O 1.5 μL。反应条件:95 ℃预变性10 min,95 ℃变性10 s,60 ℃ 退火10 s,72 ℃延伸15 s,循环45 次,实验重复3 次。引物由上海生工生物有限公司合成,使用的具体引物序列见表1。采用2-ΔΔCt法计算各基因mRNA相对表达量。

表1 qRT-PCR引物序列Fig. 1 qRT-PCR primer sequences
1.7 Western blot
CEL处理滑膜成纤维细胞(FLS)进行总蛋白提取,用BCA试剂盒测定蛋白质含量。提取等量的蛋白质样品(20 mg),在100 ℃条件下变性5 min。然后使用SDS-PAGE凝胶电泳法分离并转移至PVDF膜,在4 ℃条件下加入相应一抗并孵育过夜,清洗,然后在4 ℃下加入辣根过氧化物酶标记的二抗,孵育2 h,最后加入发光液,曝光处理。Syngene成像系统软件统计灰度值。
2 结果
2.1 FLS活性鉴定
RA患者滑膜成纤维细胞(FLS)培养,加入抗DAPI抗体后,看到细胞核显示蓝色荧光(图1)。波形蛋白是成纤维细胞特有的骨架蛋白,加入抗波形蛋白抗体后,细胞骨架部分发出红色荧光(图1-A3),证明此细胞为FLS。DMSO处理组作为对照组(Ctrl组),5 μmol/L CEL处理组为实验组(Cel组),结果如图1-B,发现Ctrl组细胞呈多呈梭形,细胞核位于细胞中央核仁清晰;Cel组存活细胞数量明显减少,形状不规则,体积变小,核质浓缩。

注: (A)免疫荧光染色法鉴定FLS: (1)不加抗体,(2) 加抗DAPI抗体,(3) 加抗波形蛋白抗体,(4) 加抗DAPI抗体和抗波形蛋白抗体. 放大率:200×;(B)用DMSO(Ctrl)或5 μmol/L CEL 处理24 h的FLS。放大率: 10×
2.2 Cel处理后的转录组分析
转录组测序鉴定得到7 803个差异表达基因,4 479个上调,3 324个下调。通过GO功能分析,富集到17 354个条目,按照P<0.05 的阈值过滤,显著富集到1 056个子条目,富集到生物过程(biological processes,BP)的条目是107条,主要集中在氧化应激反应、对氧气压力的反应等,特别是与氧气压力和应激相关的基因HIF-1α 和 HIF-3α显著表达;富集到分子功能(Molecular function,MF)的条目有871条,主要参与的MF为细胞外基质组成、伴侣蛋白的结合等;富集到细胞组分(Cell component,CC)的条目是78条,主要定位于细胞器、细胞质和细胞外基质(见图2)。KEGG富集得到信号通路335条,按照P<0.05 的阈值过滤,其中显著富集通路18条,包括MAPK信号通路、Rap1信号通路、ECM受体间互作P53信号通路PI3K-Akt信号通路等。

注:(A)差异基因表达火山图;(B)差异基因GO功能富集分析;(C)差异基因KEGG 通路富集分析
2.3 Cel处理后的蛋白质组分析
通过蛋白质组分析获得3 372个蛋白质, 按照P<0.05 的阈值和差异倍数(Fold Change, FC)> 2进行过滤,差异表达蛋白质294个,106个蛋白质上调表达,188个蛋白质下调表达。对差异蛋白进行GO富集分析,显示蛋白共参与了8 080条生物过程或途径,其中574条的P值小于0.05,467个与BP相关、40个与CC相关、67个与MF相关。如图3所示,靶点主要涉及细胞外结构组织、细胞外基质的组织、对压力的反应等生物过程;靶点主要集中于细胞外基质结构成分、糖胺聚糖结合、生长因子活性等分子功能;靶点主要涉及细胞外基质和富含胶原细胞外基质等细胞组分。KEGG分析共获得18条通路(P<0.05),如图3所示。主要通路有ECM受体相互作用、细胞因子-细胞因子受体相互作用、P53信号通路等。

注:(A)差异蛋白聚类分析;(B)差异蛋白GO功能富集分析;(C)差异蛋白KEGG 通路富集分析图3 Cel处理后的蛋白质组分析Fig. 3 Proteomic analysis after treatment with Cel
2.4 转录组和蛋白质组关联分析
总体比较转录组和蛋白质组的表达量以及比较差异表达的基因和蛋白水平,显示弱相关,相关系数分别为r=0.206 7和r=0.250 7。 如图4所示,加入CEL后,在转录组水平和蛋白质组水平,有36个基因上调表达和15个基因下调表达。 27个基因转录水平下调表达但翻译水平上调表达;2个基因转录水平上调表达但翻译水平下调表达。
2.5 候选基因和蛋白验证
转录组学和蛋白质组学分析表明,Cel对FLS细胞外基质中涉及的几种蛋白质起作用。因此,通过分子对接模拟了Cel与几种晶体结构已知的蛋白质的潜在相互作用模式(图5)。模拟结果显示,药物与靶蛋白作用的主要形式有氢键和疏水相互作用。例如,Cel与MMP1的ASP-279、LYS-298、LYS-276等氨基酸残基形成氢键;Cel除了与ANXA6的LYS-224形成氢键,还与GLU-643之间具有疏水作用。
挑选6个基因进行qRT-PCR验证,LMAC1和MMP1表达趋势与转录组测序结果相反,COMP、ANXA6、THBS1、SERPINE5等4个基因表达趋势与转录组测序结果一致。采用Western blot方法验证蛋白质组结果,Annexin A6表达量与Ctrl组相比显著上调,与蛋白质组学结果一致。
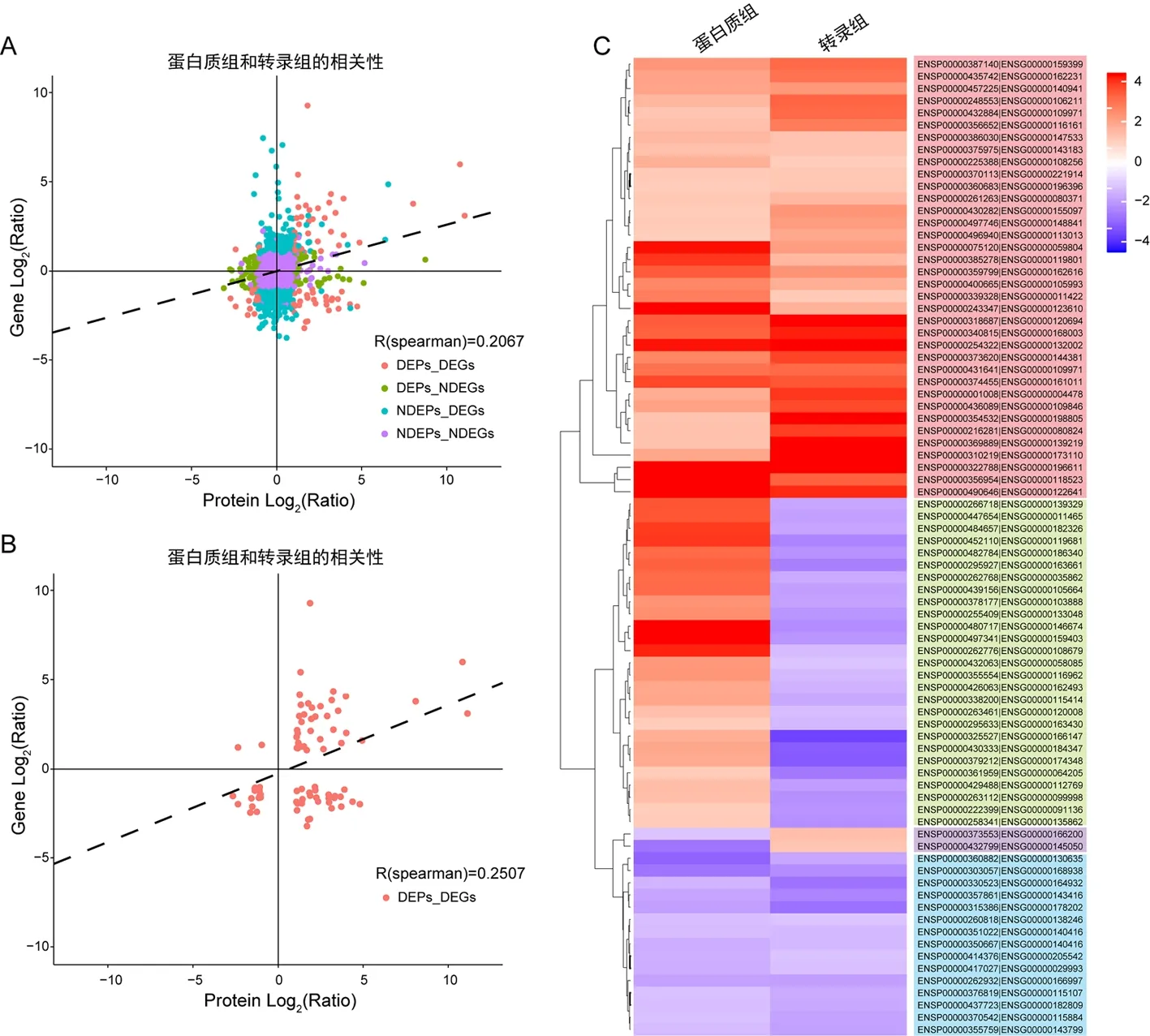
注:(A)所有基因和蛋白的关联分析;(B)差异表达基因和蛋白的关联分析;(C)差异表达基因和蛋白的聚类分析

注:(A)Cel与潜在的作用靶点蛋白分子模拟对接;(B)荧光定量PCR验证;(C)Western blot验证
图5A显示Cel与FLS细胞外基质潜在6种靶蛋白的分子对接模式图。模型展示了0.4 nm以内的相互作用力及其键长、活性位点的关键氨基酸残基,红色虚线表示氢键。6种靶蛋白分别是软骨寡聚基质蛋白(COMP,PDB ID: 3FBY)、基质金属蛋白酶1(MMP1,PDB ID: 1SU3)、膜联蛋白A6(ANXA6,PDB ID: 1M9I)、血小板反应蛋白1(THBSP 1,PDB ID: 2OUH)、丝氨酸蛋白酶抑制剂E2(SERPINE2,PDB ID: 4DY0)、层粘连蛋白亚基γ-1(LAMC1,PDB ID: 5XAU)。
3 讨论
类风湿关节炎(RA)患者的滑液和血清中炎症标志物(例如CRP、IL-6和TNF-α)高表达,并且这些标志物在血液中的水平与疾病严重程度相关。在RA中,炎症的原发部位是滑膜组织,细胞因子可能从该滑膜组织释放到血液循环中。这些细胞因子几乎参与了类风湿关节炎的关节发炎和破坏的所有方面[19-20]。
许多研究已经部分揭示了雷公藤红素抗炎作用的机制。 LI等[21]发现雷公藤红素抑制缺氧诱导的FLS迁移,抑制缺氧诱导的CXCR4在RA-FLS的mRNA和蛋白水平上的表达。XU等[22]结果显示雷公藤红素通过诱导DNA损伤、细胞周期阻滞和凋亡来抑制RA-FLS增殖。其他研究者发现[14],在雷公藤红素处理后,几种趋化因子基因的表达发生了显著变化。雷公藤红素对FLS影响的转录组学和蛋白质组学研究表明,该药物通过影响氧化应激反应、氧气压力反应小分子代谢调节等发挥抗炎作用,这与之前的研究结果一致[21]。本实验结果还表明,雷公藤红素可直接干扰细胞外基质,抑制FLS增殖和存活。
在FLS中表达的转录组和蛋白质组之间只有弱的相关性。这与肺腺癌和胚胎干细胞中的转录组学和蛋白质组学研究一致[23-24]。这也部分反映了影响蛋白质组的翻译调控和翻译后过程[25]。
在关节炎部位,缺氧是微环境的一个显著特征,这是通过炎症浸润的免疫细胞消耗氧气增加,以及由于血管功能障碍而破坏血液供应而产生的[26]。缺氧触发了几种导致RA病理的信号通路,缺氧激活的主要信号通路涉及缺氧诱导因子(HIFs),其在RA的滑膜中高表达。 HIFs 诱导炎症、血管生成、细胞迁移和软骨破坏,并抑制滑膜细胞和炎性细胞的凋亡。HIF的表达与炎症细胞因子一样,可以通过氧依赖和非氧依赖两个途径触发,使疾病加重[27-30]。实际上,HIF-1α阳性细胞的数量与炎症内皮细胞浸润的程度、滑膜炎的严重程度直接相关[31-32]。活性氧(ROS)的过量产生会导致蛋白多糖、透明质酸、硫酸软骨素和胶原蛋白的分解[33],从而破坏关节。
4 结论
雷公藤红素可以降低HIF的表达,杀死FLS,减轻RA中的炎症反应,雷公藤红素可能靶向细胞外基质中的几种蛋白质。通过组学的联合分析,提示雷公藤红素可通过影响类风湿关节炎发展的多条信号通路来减轻炎症发生,为理解RA的发病机制和CEL治疗RA提供理论支持。

