水网藻生长及铀对其生长影响的模型构建
张建国 罗学刚
(1. 西南科技大学生命科学与工程学院 四川绵阳 621010; 2. 西南科技大学环境与资源学院 四川绵阳 621010)
核能的广泛应用、铀矿的开采以及铀尾矿维护过程形成了不同赋存形态的含铀废水。含铀废水的环境泄露会损害身体健康、威胁生命安全。因此,对含铀废水的治理备受关注[1-3]。铀的形态不仅与环境化学组成有关,也与pH值关系密切,铀在碱性水体条件下主要以UO2(CO3)22-,UO2(OH)3-等阴离子形态存在[4-6],而在酸性条件下主要以UO22+,(UO2)3(OH)5+等阳离子形态存在[7-8]。目前,含铀废水的治理研究主要集中在物理化学和生物技术方法方面。生物富集是生物技术方法中的一种重要方式。已有大量文献报道了有关活体生物进行铀富集的研究成果,但关于碱性条件下铀的富集报道较少[1]。具有富集碱性水体铀的生物筛选有利于拓宽生物修复应用范围。水网藻(Hydrodictyonreticulatum)是一种少见的大型网片状能自由漂浮的淡水绿藻,具备容易采集的特征。水网藻对营养要求低且生境广泛,便于大规模培养,能廉价获得以满足应用需求。已有文献报道水网藻对重金属污染水体有着较强的重金属富集能力、耐受能力及良好的净化效果[9-10]。1988年Rybova等[11]研究了铊离子与水网藻的吸收交换;Gao等[12]研究发现水网藻对铅离子具有很好的富集能力,每千克干重可以富集4 000 mg;林秋奇研究发现水网藻对Pb2+,Fe3+,Cd2+等重金属有着良好的富集能力[13]。虽然水网藻在重金属富集方面有着良好的开发前景[14],但水网藻对铀的富集研究鲜见报道。虽然作者在前期研究过程中发现水网藻对铀具有良好的生物富集能力,但对其富集机制了解不足。生物富集重金属与其生理活性关系密切,生理活性又与其培养条件和培养基组分关系密切,当培养基组分存在差异时往往会引起培养最优条件的差异从而导致细胞生理活性的差异[15]。生长动力学是描述生物细胞代谢活性的一种重要方式,也是机理分析的重要手段。本文基于BG11培养基优化水网藻生长条件,了解水网藻生长和培养条件的关系;假设水网藻生长过程受到自身抑制,构建其生长动力学模型,分析其抑制机理;构建铀胁迫对水网藻生长影响的模型,表征铀浓度对水网藻生长影响规律。本研究可为水网藻富集铀的生理机制研究提供参考。
1 材料与方法
1.1 材料
1.1.1 藻种来源和预培养
供试水网藻采集自湖南省衡阳市某铀尾矿废水沟渠中,经分离纯化获得。将纯化的水网藻接入含有BG11新鲜培养基的玻璃容器中, 将玻璃容器置于人工气候培养箱 (MGC-1500HP-2, 上海一恒科学仪器有限公司)中进行单种预培养。设定温度为25 ℃,光照强度为3 000 lx,光照/黑暗为14 h/10 h,培养时间约7 d。当水网藻长度为2~5 cm时即可作为种子。
1.1.2 铀储备液
称取一定质量硝酸铀酰(238U,UO2(NO3)2·6H2O,分析纯,西安鼎天化工有限公司)溶解于去离子水,适当稀释后用电感耦合等离子体质谱仪(ICP-MS, Agilent 7700x, Agilent Technologies, Ltd., USA)测定U的质量浓度,然后将其稀释调节为5 000 mg/L作为U储备液。根据实验要求利用铀储备液进行调节至目标浓度。
1.1.3 BG11培养基组分
90 mg/L NaNO3, 16 mg/L K2HPO4·3H2O,75 mg/L MgSO4·7H2O, 36 mg/L CaCl2·2H2O, 20 mg/L Na2CO3, 25 mg/L NaCl, 5 mg/L FeSO4·7H2O, 31 mg/L KOH 以及 1 mL/L 微量元素 (2.86 g/L H3BO3, 1.81 g/L MnCl2·4H2O, 0.222 g/L ZnSO4·7H2O, 0.39 g/L Na2MoO4, 0.079 g/L CuSO4·5H2O, 0.049 4 g/L CoNO3·6H2O),pH值 8.35。所有试剂均为国产分析纯。
1.2 方法
1.2.1 培养条件对水网藻生长的影响
每个300 mL的植物组织培养瓶中装入100 mL BG11培养液,每瓶接入湿重为0.20±0.01 g的水网藻,置于人工气候培养箱中进行培养。设定温度为25 ℃,光照强度为3 000 lx,光照/黑暗为14 h/10 h,pH值8.35,分别按照以下因素梯度进行单因素试验:
(1) 温度梯度:10,15,20,25,30 ℃;
(2) 光照强度梯度:2 500,3 000,3 500,4 000,5 000 lx;
(3) pH值梯度: 5.98,7.01,8.01,9.04,9.98。
每个梯度试验5次以上重复,培养至48 h和72 h 时,测定水网藻湿重并计算其比生长速率和温度Q10(Q10表示温度每升高10 ℃比生长速率增加的系数),即Q10=(μ2/μ1)10/(T2-T1),T和μ分别表示温度和比生长速率且T2>T1。
1.2.2 水网藻生长动力学模型构建
每个300 mL的植物组织培养瓶中装入100 mL BG11培养液,每瓶接入湿重为0.20±0.01 g的水网藻。置于人工气候培养箱中进行培养。设定温度为25 ℃,光照强度为3 000 lx,光照/黑暗为14 h/10 h,培养18 d,间隔2 d称其鲜重,并换算为干重。假设:(1) 水网藻在生长过程中营养物质满足且不对水网藻的生长产生底物抑制;(2) 无水网藻自身分泌物的抑制;(3) 存在自身生长过程由于争夺生存空间而产生抑制。根据假设获得方程(1):
(1)
式中:Cx为干水网藻质量浓度(mg/L);t为培养时间(h);μmax为最大比生长速率;Cx,max为干水网藻最大质量浓度(mg/L)。
1.2.3 铀对水网藻生长的影响
每个300 mL的植物组织培养瓶中装入100 mL BG11培养液,调节铀质量浓度分别为0 ,1,2 ,3,4 ,5,10,20,30 mg/L,然后每瓶接入湿重为0.20±0.01 g 的水网藻,置于人工气候培养箱中进行培养。设定温度为25 ℃,光照强度为3 000 lx,光照/黑暗为14 h/10 h,培养28 h。分别于0 ,28 h称其鲜重,并换算为干重,计算0~28 h间水网藻的比生长速率。每个浓度梯度5次重复,取其平均值且相对误差小于10%。
1.2.4 水网藻干重与湿重的关系及比生长速率计算方法
利用吸水纸吸走鲜活的水网藻表面水分,随机分成质量不等10份,烘干至恒重,以湿重为横坐标、对应的干重为纵坐标作图,拟合曲线得到干重与湿重标准曲线,mdry= 0.0128+0.2268mwet(R2=0.9987)。mdry表示水网藻干重(mg),mwet表示水网藻湿重(mg)。
比生长速率:μ=ln(mt/m0)/t
其中:mt为时间t时水网藻的质量(mg),m0为起始时水网藻的质量(mg),t为间隔时间h。
生长代时:tG=ln2/μ。
1.2.5 数据处理
未特殊说明平行试验为3次重复,取其平均值,标准偏差小于5%。使用Excel 2007进行数据处理后,使用SPSS 20.0软件工具进行统计分析。
2 结果与讨论
2.1 温度对水网藻生长的影响
水网藻比生长速率与温度关系如图1所示。水网藻生长的最适温度为25 ℃,比生长速率为0.193 1 g·g-1·d-1。当培养温度低于25 ℃时,比生长速率与温度(T)关系服从μ=0.0087T-0.0219 (R2=0.9874,P<0 .05),可见水网藻在高于2.6 ℃ 温度环境就可生长,与文献[15]报道的4 ℃ 有偏差,但比较接近。2.6 ℃ 至25 ℃ 水网藻生长温度Q10值为 2.38(Q10表示温度每升高10 ℃,比生长速率增加的系数,可以用来描述温度对水网藻的生长影响程度,Q10越高,说明温度对水网藻生长影响越大)。一般藻类(10~20 ℃)Q10为1.8~3.5[16]。王朝晖等[15]和Hawes等[3]报道了水网藻在不同条件下Q10分别为 2.86和3.50,说明本实验条件下水网藻对温度的敏感度降低,但也可能与藻种有关。当温度超过25 ℃ 时,根据两点法可以推测水网藻停止生长的上限温度为38 ℃,略低于文献[13]报道的40 ℃。由此可见,水网藻能在较为宽泛的温度条件下生长,最适温度为25 ℃,尤其适合铀尾矿丰富的南方水体,为水网藻用于铀尾矿修复提供了有利条件。
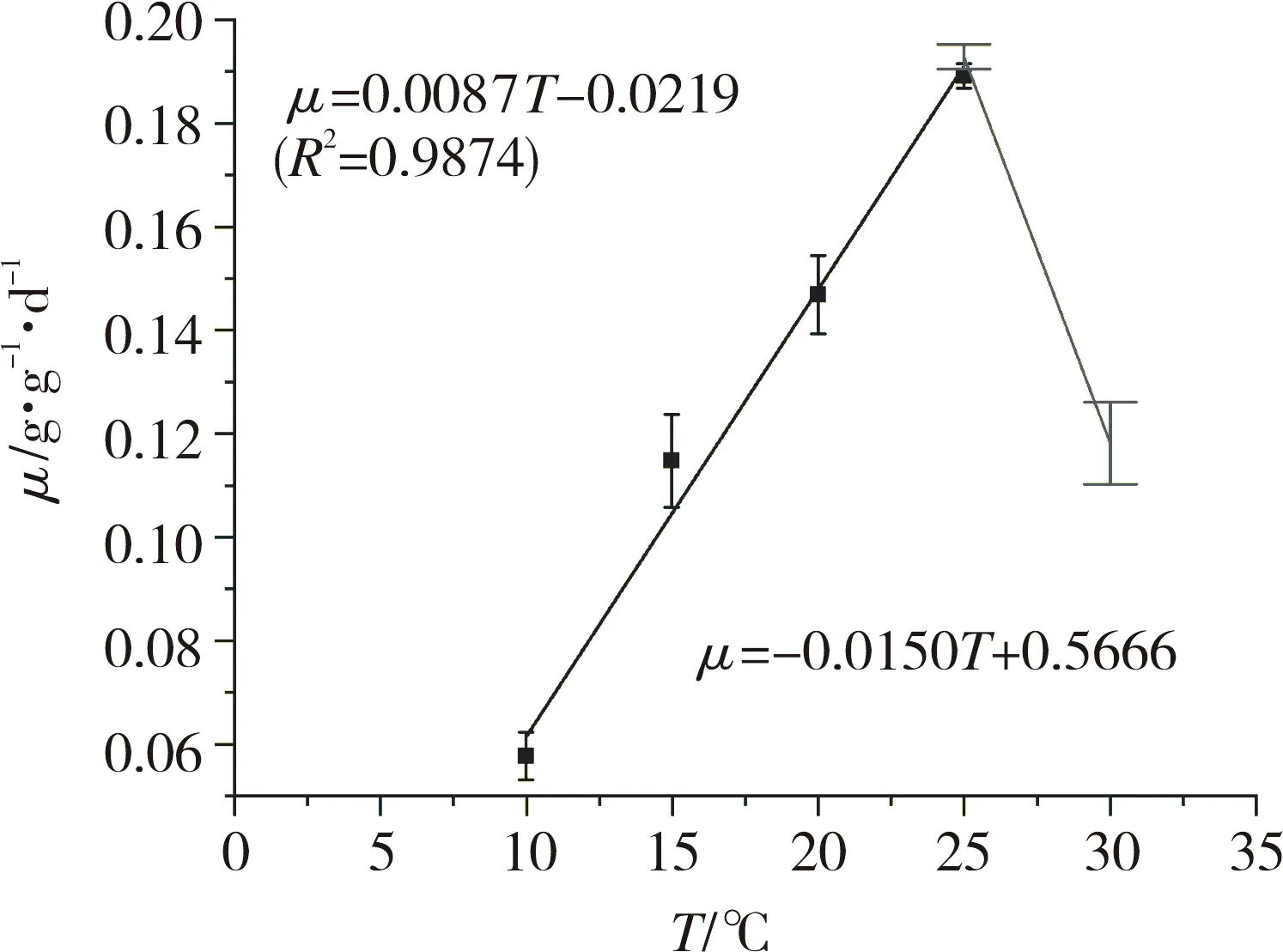
图1 水网藻不同温度条件下的比生长速率Fig.1 Specific growth rate of H. reticulatum under different temperatures
2.2 pH值对水网藻生长的影响
pH值对水网藻比生长速率的影响见图2。从图2可以看出,水网藻适合于碱性条件生长,虽然水网藻在pH值6时也能够较好生长但其比生长速率显著低于pH值7~10时的比生长速率(P<0.05), pH值9时水网藻的比生长速率明显高于其他pH值条件下的比生长速率(P<0.05),说明水网藻最适pH值为9。通过图2可以得知水网藻生长pH值跨度宽泛,便于培养,适合碱性条件下铀的富集。
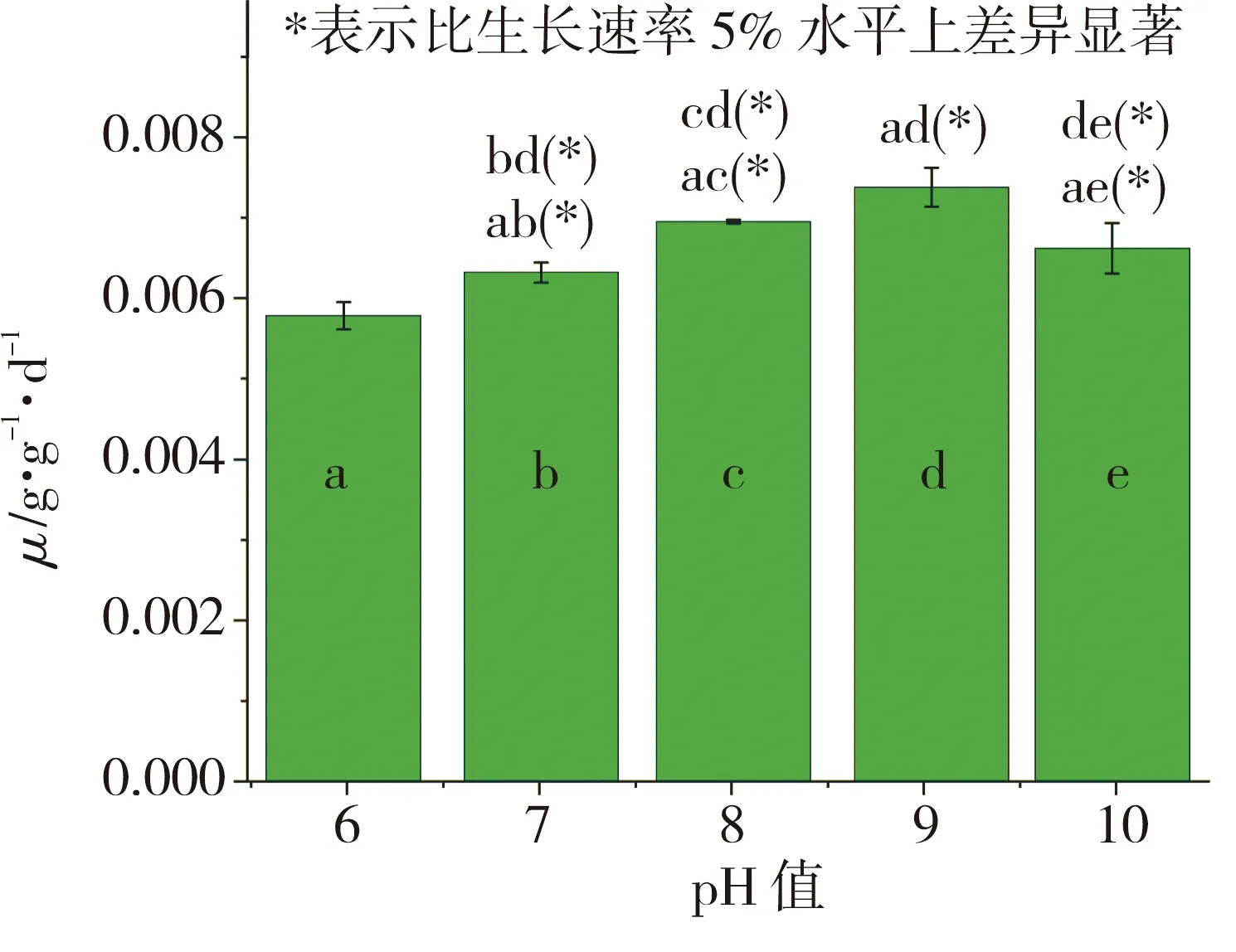
图2 水网藻在不同pH值条件下的比生长速率Fig.2 Specific growth rate of H. reticulatum under different pH values
2.3 光照强度对水网藻生长的影响
不同光照强度对水网藻生长速率的影响结果如图3所示。从图3可以看出,在光照强度为2 500 lx时, 水网藻虽能较好生长,但比生长速率显著低于3 000~5 000 lx光照强度下的比生长速率。 3 000~ 5 000 lx光照强度下,水网藻比生长速率差异不显著,说明在25 ℃时,水网藻的光饱和点在3 000 lx 以上。Hawes等[3]和王朝晖等[15]的研究结果分别表明水网藻的光饱和点为3 000 lx和6 800 lx。光饱和点的差异,一方面和水网藻藻种差异有关,另一方面与温度有关。当温度较高时,代谢加快,不能及时通过光照获得物质补给与能量供给,可能会导致水网藻生长减缓甚至负增长[15]。不过,Raven 等[17]研究表明新西兰水网藻和非洲水网藻对光强要求不太高, 均适合于弱光环境,认为水网藻趋向于阴生性。
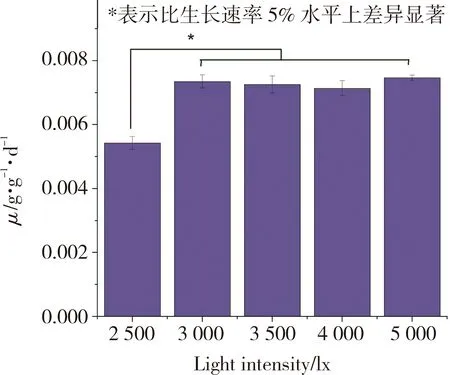
图3 水网藻不同光照强度条件下的比生长速率Fig.3 Specific growth rate of H. reticulatum under different light intensities
2.4 水网藻生长动力学模型
将式(1)按照张建国等[18]方法进行积分,获得方程(2):
(2)
将实验数据带入式(2)进行非线性拟合获得水网藻生长动力学参数Cx,0,Cx,max,μmax分别为64.573 2,621.427 1,0.016 4,再带入式(2)获得水网藻生长动力学方程(3):
(3)
利用式(3)获得模型预测值并与实验值比较进行模型验证,结果见图4。从图4可以看出,模型可以较好模拟水网藻的生长,准确度可达85.51%以上。
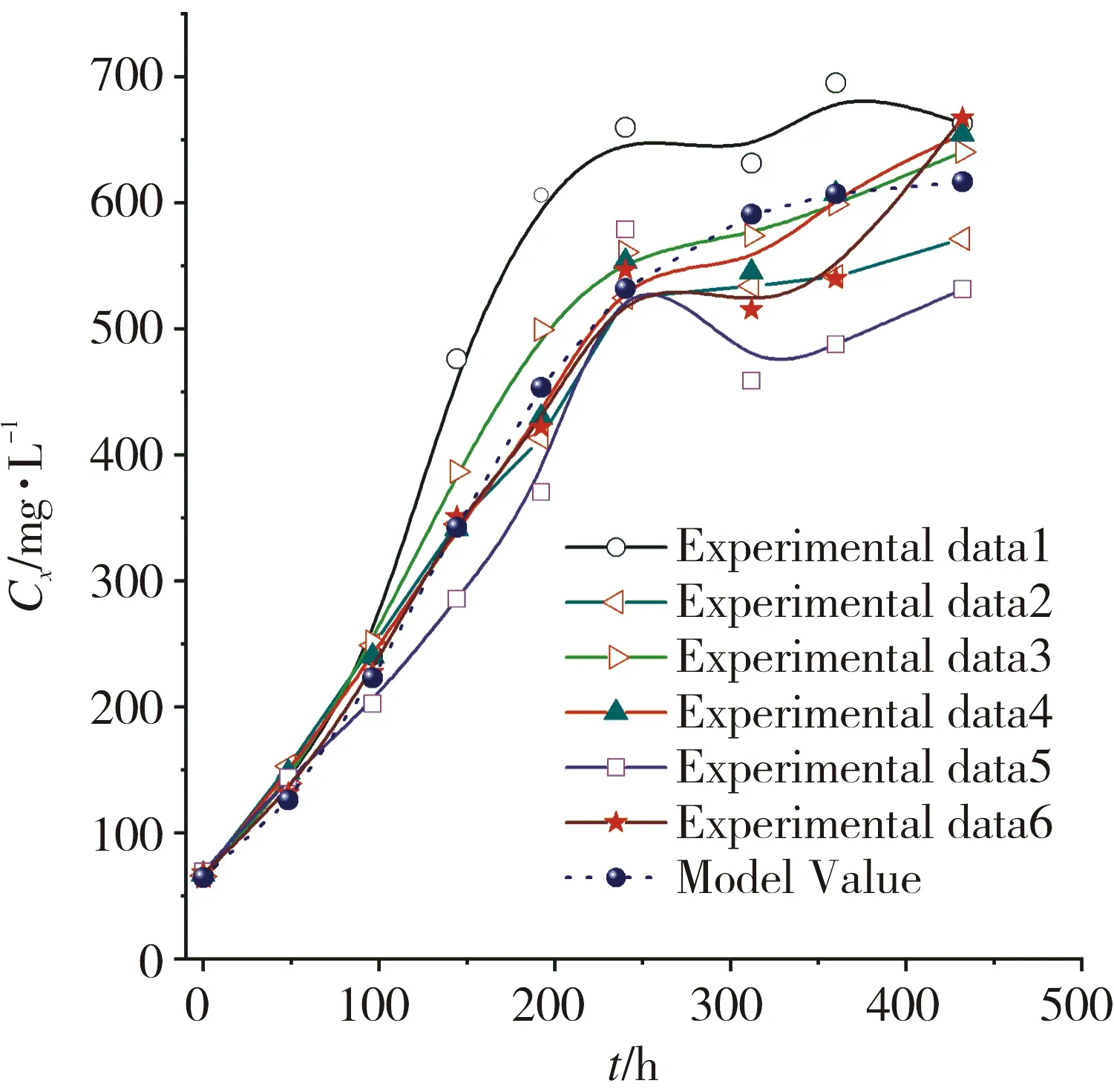
图4 水网藻生长动力学模型及其验证Fig.4 Growth kinetics model and its verification of H. reticulatum
从图4可以看出,水网藻生长过程中会受到自身生长空间争夺,导致相互抑制。当干水网藻质量浓度为621.427 1 mg/L时,水网藻生物量增加缓慢甚至不增加,称为水网藻最大生长抑制浓度,可为水网藻的后期研究方案设计提供参考。假设水网藻没有抑制时,最大比生长速率为0.016 4 g·g-1·h-1,计算获得其代时为42.5 h。
2.5 铀对水网藻生长的影响模型
将0~28 h水网藻的平均比生长速率与对应铀胁迫浓度作图,如图5所示。由图5可以看出,随着铀浓度增长,水网藻的比生长速率呈现先升高后降低的抛物线形式,可见铀对水网藻生长的影响呈现“低促高抑”的生物学效应[19]。可以认为水网藻对铀的胁迫响应过程由3个部分组成:第一部分是无铀胁迫时的比生长速率P0; 第二部分是低浓度铀(x)促进的比生长速率函数S(x);第三部分是高浓度铀(x)抑制的比生长速率函数I(x)。化感物质诱导的低促高抑现象被称为赫米斯(Hormesis)现象,常用式(4)表达[20-21]:
P(x)=P0+S(x)-I(x)
(4)
虽然铀作为重金属并非化感物质,但是呈现出相同的变化趋势,因而在形式上可以采用该方程进行描述。米氏专门构建了米氏方程(Mitscherlich model)用以描述限制因子影响生物生长的数学模型:
μ=μmax(1-exp(-c·f(i)))
(5)
式中:μ为生长比速;i为限制性因子;μmax为最大比生长速度;c为常数;f(i)为关于i的函数。
铀对水网藻生长的影响与化感物质对生物体生长的影响在本质上都与酶的活性表达或活性抑制有关, 将米氏方程(5) 引入方程(4)中的S(x)和I(x)就可以赋予方程(4)具有酶促反应的生物学特征[22]。
Hormesis模型中引入米氏(Mitscherlich)因子后的模型描述如下:
P(x)=P0+Smax(1-exp(-ks·x))-
Imax(1-exp(-ki·x))
(6)
将P0设置为对照值,即P0=0.0066,采用最小二乘法进行非线性曲线拟合获得模型参数代入方程(6),得到描述铀对水网藻胁迫呈现的“低促高抑”方程(7)。
m=0.0066+0.0187(1-exp(-0.9563CU))-
0.0215(1-exp(-0.2978CU))
(7)
式中CU表示铀的质量浓度(mg/L)。
将模型预测值(如图5中红线所示)与实验值进行比较得到的相关系数为 0.991 4,说明该模型能够较好地拟合实验值。
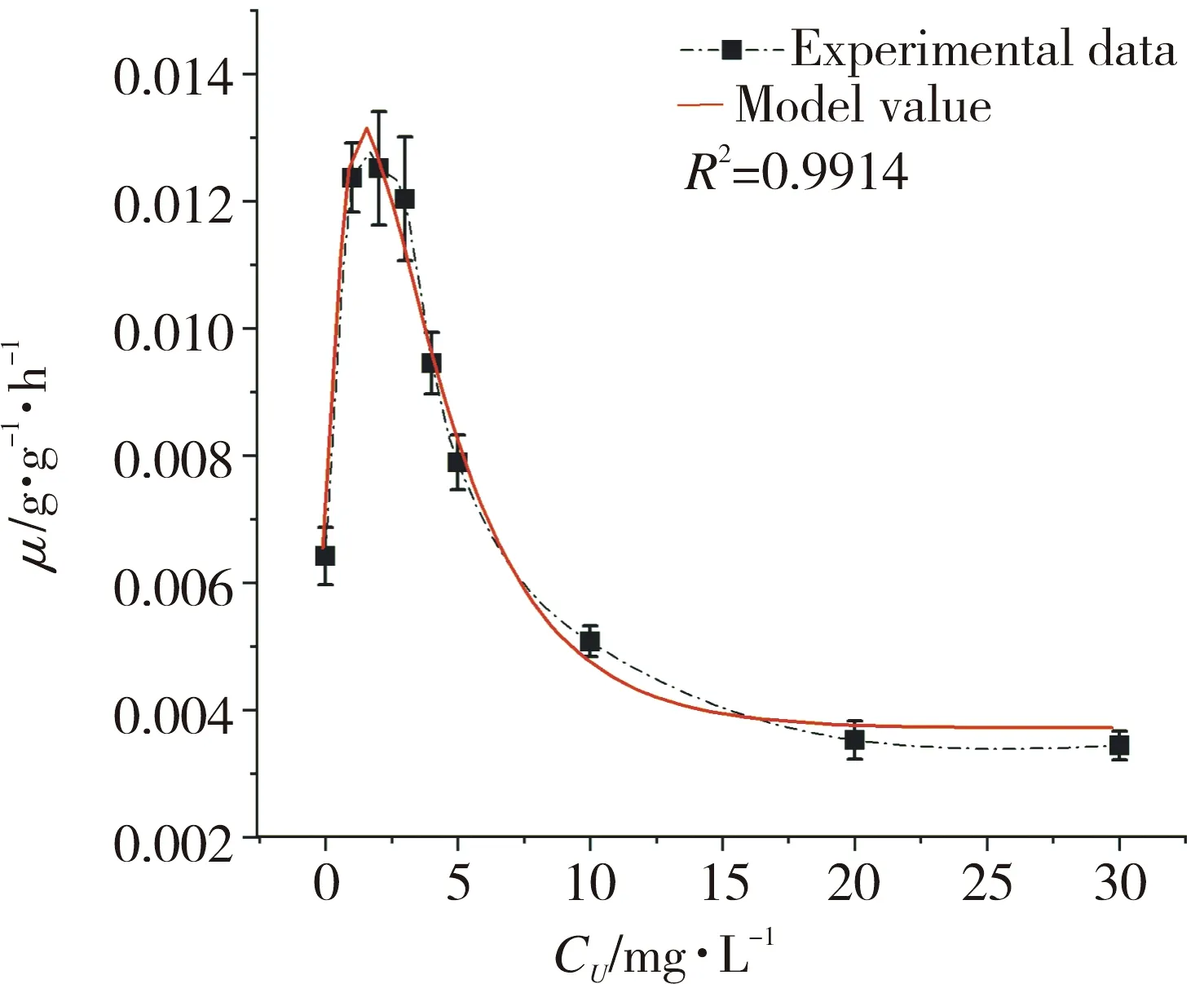
图5 铀胁迫下的水网藻比生长速率模型Fig.5 Specific growth rate model of H. reticulatum under uranium stress
3 结论
(1)水网藻具有2.6~38 ℃ 的模型生长温度,最适温度为25 ℃,能够适合我国南方水体铀的富集;pH值 6~10水网藻都能较好生长,且pH值 9时最适生长,水网藻适合用于碱性条件下含铀废水的富集。
(2)水网藻的生长存在藻间的相互抑制,可利用生长竞争模型描述,最大比速为0.016 4 g·g-1·h-1,最小代时为42.5 h。
(3)Hormesis模型中引入米氏(Mitscherlich)因子能够描述铀胁迫下水网藻呈现的“低促高抑”现象。

