虾青素对脂多糖(LPS)诱导奶牛子宫内膜细胞凋亡的影响
张相伦 靳青 赵红波 刘晓牧 刘桂芬 张冬梅 谭秀文


关键词:虾青素;子宫内膜细胞;凋亡;线粒体;Fas/FasL通路;脂多糖(LPS)
子宫内膜炎是牛场常见的繁殖障碍性疾病,多发于产后,如果治疗不及时或治疗不当可造成产后第一次发情延迟、配种成功率和妊娠率降低,严重者导致不孕,给奶牛养殖业造成巨大的经济损失。已有研究证实,致病菌感染是导致该病最重要的因素,这些致病菌在母牛分娩后由子宫颈口入侵至子宫内膜层,进而引起炎症反应[1,2]。目前,临床上针对子宫内膜炎的治疗以抗生素为主,但药物残留引发的食品安全隐患以及耐药菌株的不断出现使得治疗效果愈发不明显,因此,开发新的抗生素替代品迫在眉睫。
研究发现,炎症反应诱发细胞凋亡,使机体正常的组织结构受到严重损伤。Monack等[3]报道,沙门氏菌和志贺氏菌感染巨噬细胞,造成促炎级联反应和细胞凋亡。Zhang等[4]报道,金黄色葡萄球菌可产生多种毒素,引起细胞凋亡;在某些疾病例如特异性皮炎和败血症中,金黄色葡萄球菌诱导的细胞凋亡会影响疾病的严重程度和预后结果。Bhadaniya等[5]利用病毒、细菌等病原微生物感染人子宫内膜上皮细胞,发现炎症因子IL-6、IL-8和TNF-α表達水平升高,细胞凋亡比例升高,说明病原微生物导致细胞发生炎症反应,进而引起细胞凋亡。因此,针对子宫内膜炎的防治有必要从抗凋亡角度入手寻找合适的药物或添加剂。
虾青素(astaxanthin,AST)是一种酮式类胡萝卜素,广泛存在于海洋生物、藻类、真菌及少数植物中[6]。研究发现,虾青素具有多种生物学效应,尤其在抗凋亡方面具有重要作用[7],迄今为止使用虾青素抗炎症诱导细胞凋亡的报道非常少。因此本研究利用已成功构建的奶牛子宫内膜细胞炎症模型[8],分别从内源性和外源性两种凋亡途径探讨虾青素在抵御炎症诱导的子宫内膜细胞凋亡方面的作用,为其在炎症预防和治疗方面的应用提供理论依据。
1材料与方法
1.1试验材料
1.1.1主要试剂 胎牛血清(FBS)、三抗混合液(BiologicalIndustries);血清白蛋白(BSA)、虾青素(Sigma);DMEM/F12培养基、脂多糖(LPS)、0.25%Trypsin-EDTA(Gibco);引物(济南博尚生物技术有限公司);FasL酶标试剂盒(武汉华美生物工程有限公司);AnnexinV凋亡检测试剂盒(上海碧云天生物技术有限公司);TRIzonReagent(北京康为世纪生物科技有限公司);HiscriptⅡQRTSuperMixforqPCR(+gDNAwiper)、ChamQTMSYBRColorqPCRMasterMix(南京诺唯赞生物科技股份有限公司)
1.1.2主要仪器 倒置相差显微镜及全自动显微摄像装置(Nikon)、流氏细胞仪(BD)、高速冷冻离心机(Eppendorf)、酶标仪(美国伯腾)、CO2细胞培养箱(Thermo)、荧光定量PCR仪(罗氏)、化学发光凝胶成像系统(Invitrogen)。
1.2试验方法
1.2.1细胞培养及分组处理 奶牛子宫内膜细胞系购自美国ATCC细胞库,按说明书要求进行复苏并继续培养。待细胞贴壁80%~90%时用胰酶消化,加入含10%胎牛血清、1%三抗的DMEM/F12培养液调整细胞密度为1×104个/mL,置于38℃、5%CO2、饱和湿度的培养箱内培养。待细胞贴壁80%~90%后,随机分为4组:对照组(CK组)、脂多糖组(LPS组)、虾青素保护组(LPS+AST组)和虾青素组(AST组),每组6个重复。具体操作为:弃培养液,LPS组加入终浓度为1μg/mL的LPS培养液作用6h,之后更换为新鲜培养液;LPS+AST组加入终浓度为1μg/mL的LPS培养液作用6h,之后更换为含1μmol/LAST的培养液;AST组加入新鲜培养液作用6h,之后更换为含1μmol/LAST的培养液;CK组加入新鲜培养液作用6h,之后再次更换为新鲜培养液。
1.2.2酶标仪检测 在酶标板孔中分别加入100μL标准品或待测样品,每孔加入100μL酶结合物工作液,37℃避光孵育60min,洗板5次;每孔加入100μL生物素化抗体工作液,37℃孵育60min,洗板5次;加入100μL显色底物,37℃避光孵育15min;最后加入100μL终止液,酶标仪测定450nm处吸光度,经空白校准后绘制标准曲线并计算每个样品的蛋白浓度。
1.2.3细胞凋亡检测 待测细胞培养板用PBS液洗两次,加入胰酶37℃消化5min,待大部分细胞脱落时加入含10%FBS的细胞培养液轻轻吹打,收集细胞悬液到1.5mL离心管中,300×g离心5min,去掉上清液,加入195μL缓冲液轻轻重悬细胞,然后加入5μLAnnexinV-FITC并轻轻混匀,室温避光孵育10min,再加入10μLPI染液轻轻混匀,室温避光孵育5min,立即流式细胞仪上机检测并利用WinMDI2.9软件计算细胞凋亡率。
1.2.4荧光定量RT-PCR 利用Primer5.0软件设计PCR引物(表1)。
利用试剂盒进行细胞总RNA提取,通过A260和A280比值和琼脂糖电泳检测RNA纯度和完整性。采用反转录试剂盒进行cDNA合成,-20℃保存备用。荧光定量RT-PCR反应体系(μL):SYBRPremix10μL、上下游引物各1μL、cDNA模板2μL、ddH2O6μL。扩增条件:95℃30s;95℃10s,60℃30s,共40个循环;95℃15s,60℃60s,95℃15s。设置内参β-actin表达量作为参照,采用2-△△Ct法计算mRNA的相对表达量。20
1.2.5WesternBlot 细胞用预冷的PBS洗两次,加入蛋白裂解液反复吹打,收集裂解液4℃高速离心吸取上清液;将所有样品的总蛋白浓度调至1mg/mL;向样品中加入缓冲液,混匀后置于水中煮沸5min,使蛋白质变性;制备5%浓缩胶和12%分离胶,将蛋白样品加入点样孔中,浓缩胶和分离胶电泳电压分别为90V和120V;70V电压下转膜30min;将PVDF膜取出置于含3%BSA的TBST中室温封闭1h;取出将PVDF膜置于一抗中4℃过夜,TBST洗膜;将PVDF膜放入辣根过氧化物酶标记的二抗溶液室温孵育2h,TBST洗膜;取出PVDF膜,加入化学发光液室温避光孵育2min,使用凝胶成像系统拍照并进行灰度分析,计算蛋白相对表达量。
1.3数据分析
采用SPSS19.0软件的ANOVA进行分析,数据先经LSD转换后进行单因素方差分析,P<0.05为差异显著。
2结果与分析
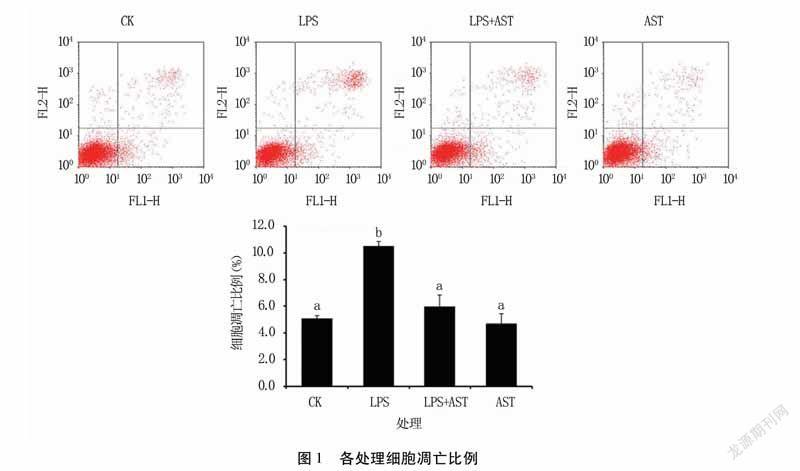
2.1虾青素对子宫内膜细胞凋亡的影响
利用流式细胞仪检测子宫内膜细胞凋亡比例,结果(图1)发现,LPS作用6h导致细胞凋亡比例显著升高(P<0.05);加入虾青素作用24h后,细胞凋亡比例显著下降(P<0.05)。说明虾青素可降低LPS诱导的子宫内膜细胞凋亡。
2.2虾青素对子宫内膜细胞凋亡相关基因表达的影响
利用荧光定量RT-PCR检测Bax、Bcl-2、Fas、Caspase8、Caspase3基因的mRNA表达水平,结果(图2)发现,与CK组相比,LPS处理显著提高子宫内膜细胞Bax、Fas、Caspase8、Caspase3基因的mRNA表达水平(P<0.05),降低Bcl-2基因的mRNA表达量(P<0.05);加入虾青素作用后Bax、Fas、Caspase8、Caspase3的mRNA表达量显著低于LPS处理组(P<0.05),Bcl-2的mRNA表达量显著高于LPS组(P<0.05)。说明虾青素通过线粒体途径和Fas/FasL途径抑制LPS誘导的子宫内膜细胞促凋亡相关基因在mRNA水平上的表达。
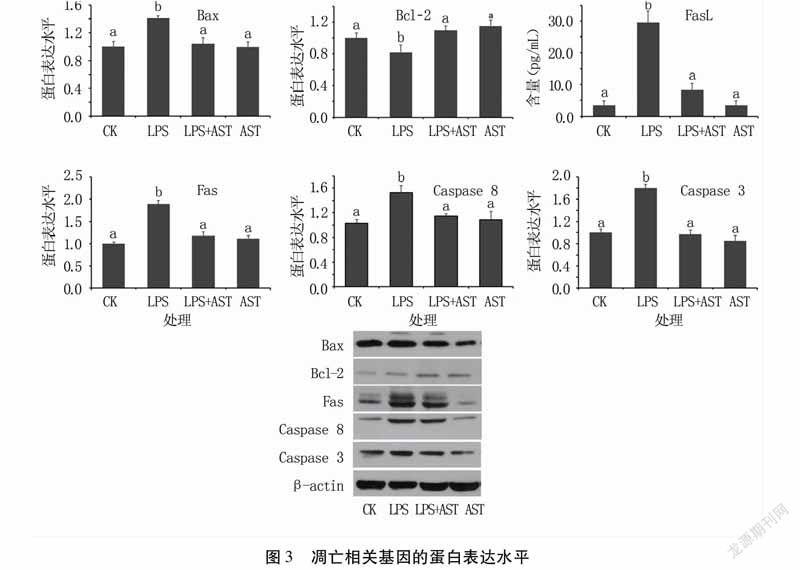
2.3虾青素对子宫内膜细胞凋亡相关基因蛋白表达的影响
利用WesternBlot法检测Bax、Bcl-2、Fas、Caspase8、Caspase3蛋白表达水平,利用酶标仪检测培养液中FasL含量。结果(图3)发现,与CK组相比,LPS处理显著提高子宫内膜细胞Bax、Fas、Caspase8、Caspase3蛋白表达水平以及培养液中FasL含量(P<0.05),降低Bcl-2蛋白表达水平(P<0.05);加入虾青素后Bax、Fas、Caspase8、Caspase3蛋白表达量以及FasL含量显著低于LPS处理组(P<0.05),Bcl-2蛋白表达量显著升高(P<0.05)。说明虾青素通过线粒体途径和Fas/FasL途径抑制LPS诱导的子宫内膜细胞促凋亡相关基因在蛋白水平上的表达。
3讨论与结论
虾青素作为自然界存在的一种高度活性的化合物,具有增强机体局部和全身免疫的能力,抵抗机体炎症,这种抗氧化性与免疫调节特性相结合[8],降低机体组织发生细胞凋亡,在防止疾病发生与传播中发挥重要作用。Yoshihisa等[9]利用紫外线诱导HaCaT角质形成细胞发生凋亡,虾青素处理降低诱导型一氧化氮(iNOS)、环氧合酶(COX)-2蛋白和mRNA表达水平,抑制角质形成细胞凋亡,降低TNF-α、IL-1β和巨噬细胞迁移抑制因子(MIF)的蛋白质和mRNA表达水平。Lin等[10]发现虾青素预处理可能通过维持氧化还原平衡并抑制钙内流和内质网应激,显著降低谷氨酸诱导的神经细胞活性丧失和细胞凋亡。Zhang等[11]在小鼠腹腔内注射虾青素然后注射LPS,发现虾青素显著降低血清中TNF-α、IL-1β和IL-6等促炎细胞因子水平以及JAK/STAT3活性,说明虾青素通过靶向JAK/STAT3介导的凋亡和自噬信号通路抑制急性胰腺炎造成的胰腺损伤。Xu等[12]研究发现,利用碘海醇处理大鼠的肾小管上皮细胞造成急性肾脏损伤,虾青素处理提高SIRT1表达水平,下调促凋亡蛋白P53和Bax的表达水平以及上调抗凋亡蛋白Bcl-2的表达水平,降低凋亡细胞数量,从而对肾小管上皮细胞起到保护作用。Sj等[13]报道,虾青素预处理保护抗凋亡缺陷菌株酿酒酵母免受乙酸和过氧化氢诱导的细胞死亡。Xue等[14]利用大鼠口服虾青素,然后构建冠状动脉微栓塞模型,结果发现虾青素预处理激活Nrf2/HO-1信号通路抑制氧化应激,阻止冠状动脉微栓塞诱导的心肌细胞凋亡并改善大鼠的心脏功能障碍。本研究利用已成功构建的子宫内膜细胞体外炎症模型[8],发现LPS作用6h导致细胞凋亡比例升高,加入虾青素处理后凋亡比例显著下降,说明虾青素可降低LPS诱导的子宫内膜细胞凋亡。
细胞凋亡在真核细胞生物的稳态和发育中起重要调节作用。目前已经发现信号通路主要有两种,即线粒体介导的内源性通路和死亡受体介导的外源性通路,其受大量促凋亡和抗凋亡分子的调控。线粒体是参与能量代谢的细胞器,在信号转导、能量转化和细胞凋亡中发挥重要作用[15]。研究发现,Bcl-2蛋白家族是细胞凋亡中线粒体途径的主要参与者。细胞受到外界刺激后,促凋亡蛋白Bax寡聚化并在线粒体外膜中形成大孔,导致凋亡因子(如细胞色素c)释放到细胞质中,进而启动凋亡信号级联反应[16]。相比之下,Bcl-2家族的抗凋亡蛋白阻止Bax寡聚化,协助它们重新易位到细胞质中,从而保持线粒体完整性并抑制细胞凋亡[17]。本研究中LPS诱导的子宫内膜细胞炎症模型,Bax在mRNA和蛋白水平上表达均升高,Bcl-2表达量降低;虾青素作用24h后,Bax表达降低而Bcl-2表达升高。说明虾青素通过调控线粒体介导的Bcl-2家族促凋亡和抗凋亡蛋白水平保护子宫内膜细胞免受LPS诱导的凋亡损伤。
另一种凋亡途径是外源性凋亡途径,该途径由位于细胞表面的膜受体与对应的配体结合启动,激活细胞凋亡的信号级联反应。研究发现,Fas是细胞凋亡级联反应最重要的上游信号分子,配体FasL与Fas的死亡域结合启动细胞凋亡[18]。FasL可以作为膜分子或作为哺乳动物细胞表面的可溶性分子存在[19]。多项研究表明,Fas存在于正常哺乳动物胸腺[20]、心脏[21]、肝脏[22]、肺[23]、睾丸[24]和其他组织,而FasL存在于大网膜[25]、睾丸[26]、胎盘[27]和其他器官中。Fas相关蛋白死亡域(FADD)、Fas、FasL和Caspase8形成死亡诱导信号复合物(DISC),促进Caspase8激活。本研究中,LPS诱导的子宫内膜细胞Fas、FasL和Caspase8的转录和蛋白表达水平升高;虾青素处理后降低了LPS对子宫内膜细胞造成的凋亡损伤。因此,虾青素不仅通过线粒体介导的凋亡途径,还通过Fas/FasL凋亡途径的关键蛋白调控细胞凋亡。
Caspase3激活是触发细胞凋亡关键且不可逆事件。Caspase3的非活性前体Pro-Caspase3存在于细胞质中,当细胞发出死亡信号时,这种前体转化为活性异二聚体。许多研究表明,Caspase3被各种刺激激活,包括受体介导的Caspase8激活、Caspase9激活、凋亡蛋白Bax和Bcl-2表达改变以及活性氧等[28,29]。本研究中,虾青素显著抑制LPS诱导的子宫内膜细胞Caspase3活性。由于Bcl-2家族蛋白和Fas死亡受体在Caspase3表达和激活的调节中起关键作用,因此Caspase3水平下降可能是虾青素能够抑制抗凋亡Bcl-2蛋白下调以及Fas/FasL关键蛋白上调。
本试验表明,虾青素通过调控线粒体介导的内源性和Fas/FasL介导的外源性凋亡途径中促凋亡因子和抗凋亡因子的表达,抑制LPS诱导的子宫内膜细胞凋亡。本研究首次报道了虾青素对奶牛子宫内膜细胞抗凋亡作用的可能机制,但仅限于细胞范围,因此后续需要临床研究来评估虾青素是否可应用于奶牛子宫内膜炎的防治。

