磷酸镁的相转变过程研究
陈启煊,孙树全,王婵,项东亮,张咪,宋启军
(1.江南大学 化学与材料工程学院,江苏 无锡 214122;2.江苏雪豹日化股份有限公司,江苏 无锡 214406)
磷酸镁具有良好的生物相容性和生物降解性[1-2],是一类重要的材料。磷酸镁的研究主要集中在生物医学方面的应用如骨组织材料[3-7]、抗菌材料[8]、基因传递载体材料[9]。为了深入理解和拓展磷酸镁的应用,磷酸镁的形成及其相转变过程的研究极其重要。
本文研究了在不同pH和镁磷比的溶液中磷酸镁的形成及相转变过程。使用NMR,Raman和IR考察了溶液酸碱度、镁磷摩尔比以及培养时间等因素对磷酸镁形成和转变过程的影响,并使用XRD对生成的磷酸镁物相进行确认,最后探讨了磷酸镁相转变可能的途径,为其在生物领域的研究提供基础。
1 实验部分
1.1 试剂与仪器
氯化镁、磷酸二氢钠、磷酸一氢钠、氢氧化钠、盐酸、乙醇均为分析纯。
布鲁克D8 X射线衍射;雷尼绍inVia显微共聚焦拉曼光谱仪;Nicolet iS50 傅里叶红外光谱仪;AVANCE Ⅲ HD 400 MHz核磁共振谱仪。
1.2 磷酸镁的制备
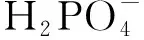
1.3 磷酸镁的结构和组成表征
用XRD对磷酸镁的晶型进行表征,使用Cu-Kα(λ= 0.154 051 nm)作靶材,扫描范围为5~50 °。在785 nm激光激发下,用共焦拉曼显微镜采集拉曼光谱。将干燥好的磷酸镁样品与溴化钾粉末混合,反复研磨,压制成测试片,用于Nicolet iS50红外光谱仪测试。用D2O配制0.1 mol/L NaHPO4·12H2O和0.1 mol/L MgCl2·6H2O,直接混合后,用核磁共振仪对其进行连续跟踪监测。
2 结果与讨论
2.1 pH对磷酸镁形成的影响
不同pH培养条件下,培养母液上清液中的pH变化,见图1。

图1 初始pH为7.4,8.0和9.0的培养液时的pH变化Fig.1 pH shift of the incubating solutions with initial pH at 7.4,8.0 and 9.0
由图1可知,当磷酸盐跟氯化镁溶液等体积混合后,溶液pH急速下降,这说明在培养的初始阶段,反应过程迅速,导致了磷酸镁的前驱体的形成。随着反应时间的延长,前驱体开始趋于稳定。而培养液中的絮状磷酸镁附近的pH比混合离心后的清液pH低。这是因为磷酸镁不断地在发生溶解结晶反应,其反应主要发生在磷酸镁与水分子的结合层,对上清液中的pH影响较小。在磷酸镁的水合作用与磷酸根的质子化作用下,随着离心后溶液中部分质子化的磷酸盐颗粒沉淀,上清液的pH变高。延长反应时间,体系的pH值下降速度趋缓,最终达到一个比较稳定的pH值。
不同起始pH环境下浓度为0.1 mol/L Mg2+和磷酸盐溶液在30 min时形成磷酸镁的晶型见图2(a)。
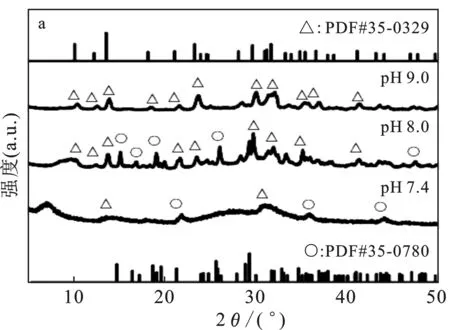
图2 磷酸镁的XRD光谱图(a);对应的红外光谱图(b)Fig.2 The XRD spectra of magnesium phosphate(a);the corresponding infrared spectra(b)△=Mg3(PO4)2·5H2O;○=MgHPO4·3H2O
由图2(a)可知,在pH为7.4的环境下形成的磷酸镁在2θ=30°处有一宽峰,可判断有无定型磷酸镁生成[10]。同时还可观察到几处来源于MgHPO4·3H2O和Mg3(PO4)2·5H2O的衍射峰。当pH为8.0时,在2θ=10°处有一个明显的宽峰,而pH为9.0时,此衍射峰明显变得尖锐。此特征与Mg3(PO4)2·5H2O (JCPDS card No.35-0329)相符,说明pH高有利于Mg3(PO4)2·5H2O的生成,中性pH有利于MgHPO4·3H2O的生成。图2(b)展示了在培养时间为30 min时磷酸镁的红外光谱。
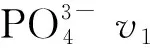
以上红外光谱数据较好地补充了Mg3(PO4)2·5H2O与Mg3(PO4)2·8H2O在XRD光谱中难以区分的不足,说明在碱性的环境下,生成的磷酸镁相趋于一致,利于Mg3(PO4)2·5H2O与Mg3(PO4)2·8H2O的形成与稳定。
2.2 镁磷比对磷酸镁形成的影响
考察了pH 7.4时镁磷比对磷酸镁形成初期的影响,结果见图3。
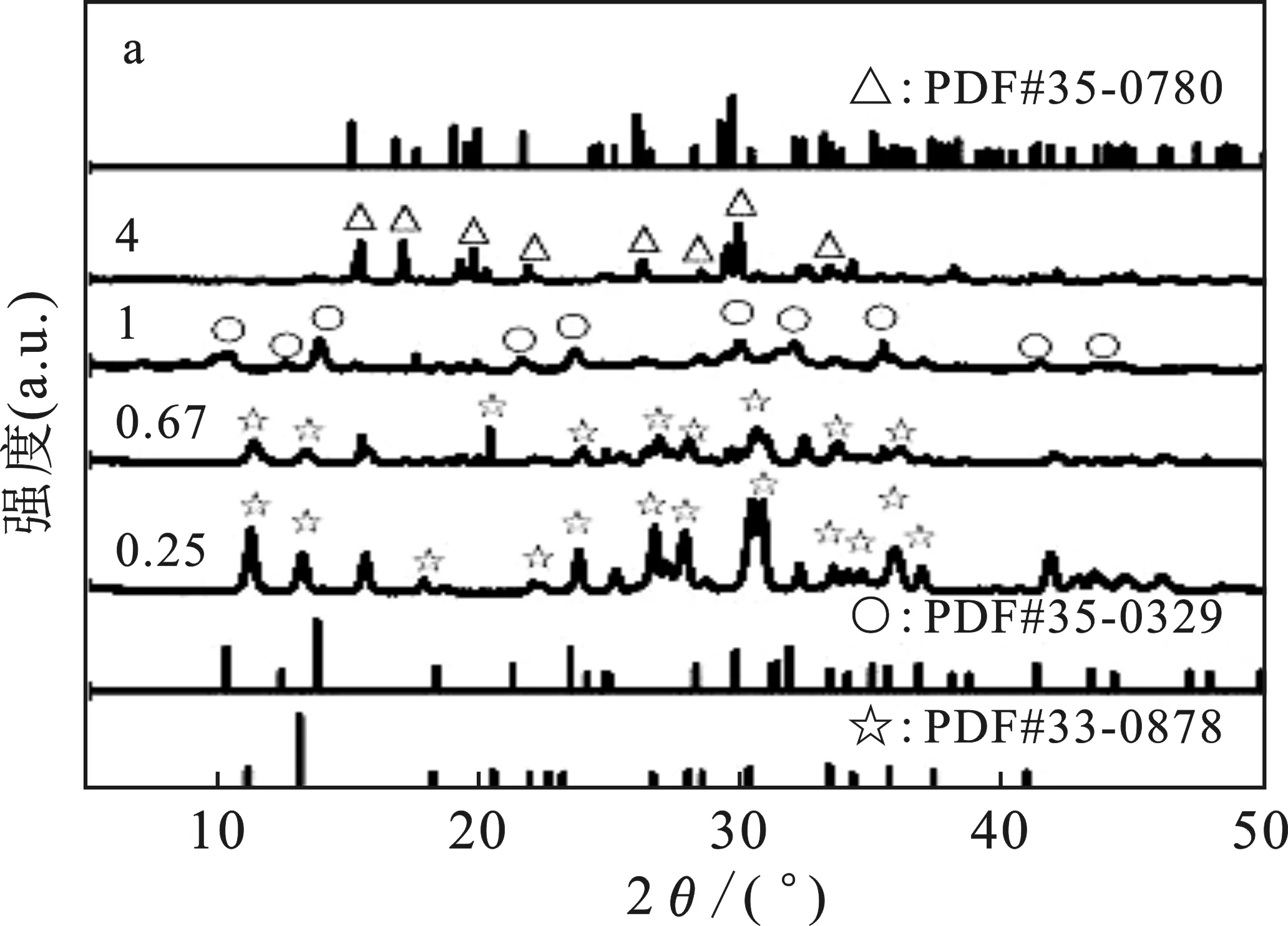
图3 磷酸镁的XRD光谱图(a);对应的红外光谱(b)Fig.3 XRD spectra of the magnesium phosphate(a);the corresponding infrared spectrum(b)△=MgHPO4·3H2O;○=Mg3(PO4)2·8H2O;☆=Mg3(PO4)2·5H2O
由图3(a)可知,Mg/P比为1时,反应24 h后出现了典型的Mg3(PO4)2·5H2O相(JCPDS card No.35-0329)。而由上述图2(a)可知,在30 min时形成的物相主要是无定型磷酸镁,随后转变为MgHPO4·3H2O,随着时间的进一步延长,最后转变为Mg3(PO4)2·5H2O。而当镁磷比分别为0.67和0.25时,24 h后的主要产物为Mg3(PO4)2·8H2O(JCPDS card No.33-0878)。尤其是当镁磷比为0.25时,Mg3(PO4)2·8H2O相的峰型更加尖锐,意味着磷源丰富,利于Mg3(PO4)2·8H2O的形成。而当Mg/P为4时,出现了MgHPO4·3H2O相,表明提高镁离子含量,有利于MgHPO4·3H2O的形成与稳定。
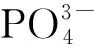
2.3 磷酸镁相转变过程探究
不同pH下 0.1 mol/L Mg2+和0.1 mol/L磷酸盐溶液制备磷酸镁,培养时间对磷酸镁形成过程的影响。图4(a)展示了初始pH 7.4时,得到的磷酸镁的红外光谱。

图4 磷酸镁的红外光谱以及对应典型的v1 PO4的拉曼光谱Fig.4 Infrared spectra of magnesium phosphate and corresponding Raman spectra of typical v1 PO4(a),(b)pH 7.4;(c),(d)pH 8.0;(e),(f)pH 9.0
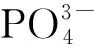
此条件下形成磷酸镁的过程如式(1)、(2)和(3)所示。该磷酸镁相转化过程,还未见有文献报道。
(1)

(2)

(3)
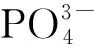
(4)

(5)
2.4 基于核磁共振在线监测的磷酸镁相转变机制研究
通过核磁共振仪对磷酸镁相转变过程进行连续监测,并结合XRD技术对磷酸镁晶型的确定,进一步研究了磷酸镁可能的相转变机制。图5表明了由0.1 mol/L MgCl2·6H2O与0.1 mol/L Na2HPO4作为母液形成的磷酸镁的31P NMR的变化。

图5 随时间变化的31P NMR谱图(a)、XRD光谱图(b)及pH值变化图(c)Fig.5 31P NMR spectra(a),the corresponding XRD spectra(b) and pH shift(c)

3 结论
研究了在不同pH和镁磷比的影响下,磷酸镁的形成和相转变过程。pH可以对磷酸镁相态的形成和转变起到有效的调控作用。碱性环境中,会促进Mg3(PO4)2·5H2O的形成;而中性甚至酸性环境下,将会形成MgHPO4·3H2O。在中性环境下,磷酸镁在形成初期,培养液中镁源含量高(Mg/P=0.4/0.1),利于MgHPO4·3H2O的形成;磷源含量高(Mg/P=0.1/0.4),利于Mg3(PO4)2·8H2O的产生。在碱性环境中(pH 9.0),将直接形成Mg2(PO4)(OH)·3H2O相,通过溶解再沉淀机制,向Mg3(PO4)2·5H2O进行转变。这些发现不仅有助于理解不同环境下磷酸镁的形成和转变过程,也为基于磷酸镁的生物材料研究及应用提供了基础。

