大鼠肝纤维化病理过程中肝组织SHP2表达与在体肝星状细胞凋亡的关系
郝礼森 杨小师 张朋垒 陈盼盼 展宗媛 何宇 苗笑佳
含SH2结构域的蛋白酪氨酸磷酸酶2 (SH2 domain-containing protein tyrosine phosphatase 2, SHP2)是一个广泛表达于人体各个组织和细胞,并具有促癌作用的蛋白酪氨酸磷酸酶,其过表达可通过抑制肿瘤细胞的凋亡参与多种恶性肿瘤的形成及发展[1- 4]。过去对SHP2的研究多集中在肿瘤领域,近年来其在非肿瘤领域的作用也逐渐受到关注。研究发现[5],HBV感染相关的肝细胞癌患者的肝组织中,伴有纤维化的癌旁肝组织SHP2表达增高;另有研究发现,体外活化肝星状细胞(hepatic stellate cells, HSC)的SHP2表达下调,其增殖受到抑制[6]。而HSC是肝脏的主要纤维生成细胞,在肝纤维化病理过程中发挥重要作用[7-8]。这提示肝纤维化病理过程中肝组织的SHP2表达可能异常,并可能通过影响HSC的生物学行为参与肝纤维化的发病机制,但迄今有关肝纤维化病理过程中肝组织SHP2表达与在体HSC凋亡的关系仍不清楚。本研究采用腹腔注射四氯化碳法建立大鼠肝纤维化模型,探讨肝纤维化病理过程中纤维化肝组织的SHP2表达与在体肝星状细胞凋亡的关系。
材料与方法
一、实验动物及试剂
清洁级健康雄性 SD大鼠50只(350~400 g/只)由北京华阜康生物科技股份有限公司提供,大鼠均在华北理工大学动物实验中心按清洁级要求饲养,自由进食水; TUNEL试剂盒购于北京中山生物试剂公司;兔抗 SHP2多克隆抗体购于武汉三鹰生物技术有限公司;小鼠抗α-平滑肌肌动蛋白 (alpha-smooth muscle actin,α-SMA)单克隆抗体购于台湾arigo公司; Masson染色试剂盒购于北京雷根生物有限公司;SP试剂购于北京中山金桥生物有限公司。
二、方法
(一)实验分组及大鼠肝纤维化模型的建立 上述SD大鼠50只被随机分成对照组(10只)、模型组(40只),大鼠肝纤维化模型采用腹腔注射四氯化碳法构建[9-10]。模型组大鼠腹腔注射50%四氯化碳橄榄油混合液,剂量为1 mL/kg,每周2 次,共8周;对照组大鼠腹腔注射生理盐水,剂量同模型组,每周2 次。在造模 2、4、6、8周分别取模型组大鼠10只,麻醉后切开大鼠腹腔,取适量大鼠肝组织,用4%多聚甲醛固定后用于免疫组织化学及HE、Masson三色染色。对照组大鼠肝组织标本与8周模型组大鼠一同留取。本研究所涉及的动物实验操作经华北理工大学实验动物伦理委员会审批。
(二)肝组织病理学及SHP2免疫组织化学染色 大鼠肝组织以4%多聚甲醛溶液固定,石蜡常规包埋并做成5 μm的连续切片,进行HE及Masson三色染色,观察肝组织病理学变化。应用SP法按试剂操作说明进行SHP2免疫组织化学染色。阴性对照用PBS代替一抗染色,染色结果为棕褐色代表阳性表达。SHP2免疫组化染色图像应用Image Pro Plus 6.0软件分析,积分光密度值 (IOD) 被用于表示SHP2阳性表达水平。
(三) α-SMA免疫组织化学及TUNEL双重染色检测在体HSC凋亡 肝组织石蜡切片脱蜡及水化后滴加蛋白酶K,然后放于37 ℃烤箱中30 min;滴加3%过氧化氢于室温下孵育20 min;滴加TUNEL检测液于37 ℃孵育60 min后用PBS洗5 min,再滴加适量的标记反应终止液于室温下孵育10 min;滴加Streptavidin-HRP工作液于室温下孵育30 min;滴加DAB显色液;滴加封闭液10%山羊血清于37 ℃孵育30 min,然后去除封闭液,滴加一抗小鼠抗α-SMA 单克隆抗体(1∶100稀释)于4 ℃孵育过夜,取出肝组织切片于室温下30 min后弃去一抗;滴加HRP标记的山羊抗小鼠IgG(1∶200稀释)二抗于 37 ℃ 30 min。上述每一处理步骤结束后均用PBS冲洗3次,每次5 min。再次于上述处理的肝组织切片上滴加DAB显色液,并在出现黄色后立即停止,用自来水冲洗2次(5 min/次)后在苏木素液中染色及放入10%盐酸酒精液中并水洗反蓝,再用酒精梯度脱水,最后用中性树胶封片,阴性对照不加末端脱氧核苷酸转移酶,其余操作不变。将各组染色的肝组织切片放在光镜下观察,凋亡活化肝星状细胞表现为胞质呈棕黄色而胞核呈蓝褐色或蓝黑色(α-SMA免疫组织化学染色将活化HSC胞浆染成棕黄色,TUNEL染色将凋亡的活化HSC胞核染成蓝褐色或蓝黑色)。随机选取5个高倍视野,计数凋亡的活化肝星状细胞及总的活化肝星状细胞,并计算凋亡指数(凋亡指数=凋亡的活化肝星状细胞数/总的活化肝星状细胞数×100%)。
三、统计学分析
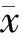
结 果
一、大鼠肝组织病理组织学变化
Masson三色及HE染色显示,大鼠肝纤维化模型成功构建,随着造模时间延长,大鼠肝纤维化逐渐加重(图1)。
二、大鼠肝组织的SHP2表达变化
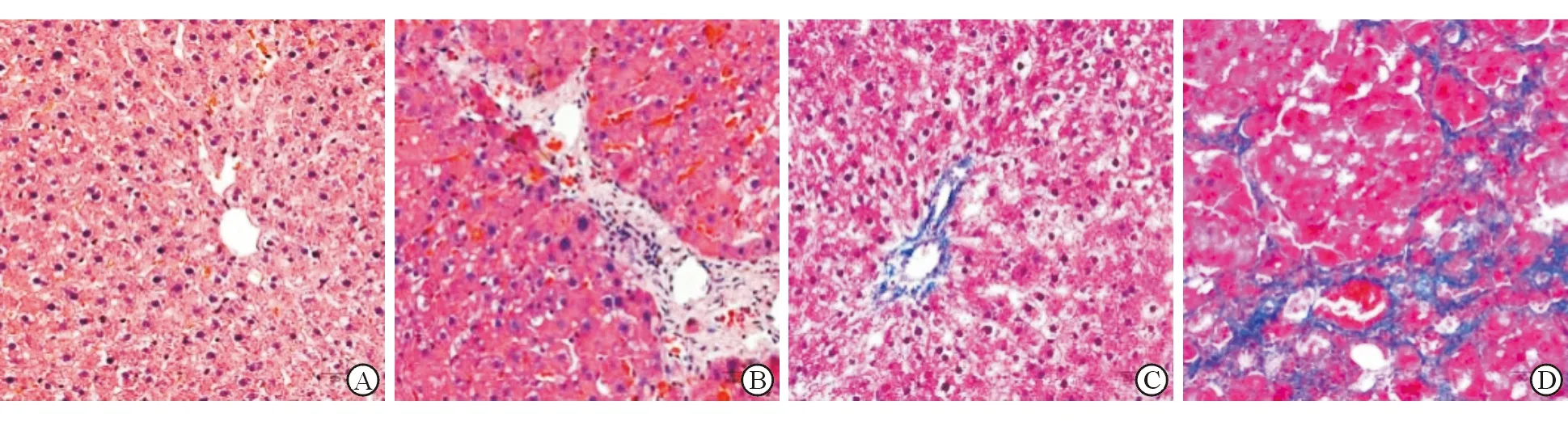
免疫组织化学染色显示,与对照组大鼠肝组织SHP2阳性表达IOD(0.19±0.01)比较,不同造模时间(2、4、6、8周)的大鼠肝组织SHP2阳性表达IOD(0.23±0.01, 0.27±0.01, 0.30±0.01, 0.33±0.01)明显增加,并随着造模时间的延长逐渐升高(P<0.05,图2)。
三、大鼠肝组织中HSC凋亡变化
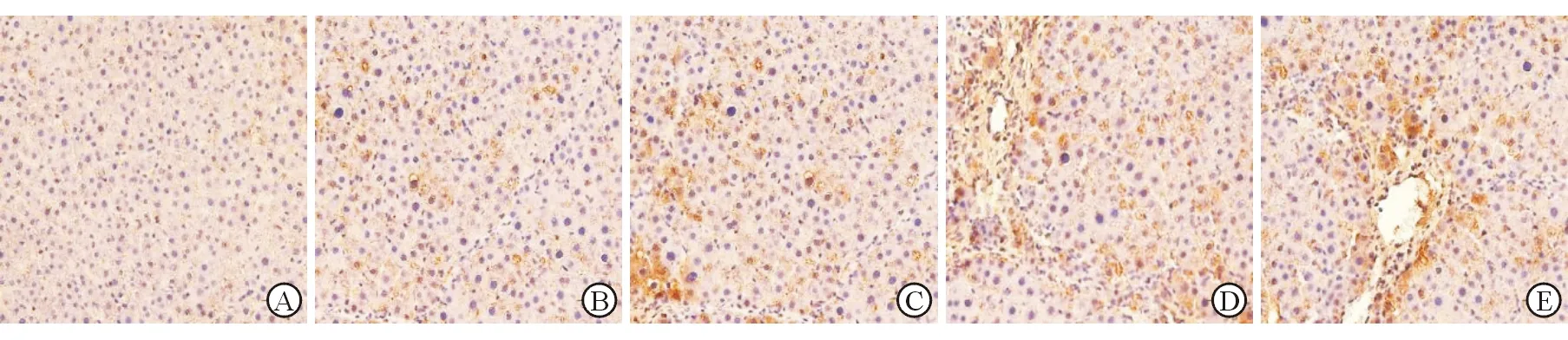
α-SMA免疫组化与TUNEL双染显示,模型组大鼠肝组织中活化肝星状细胞与凋亡肝星状细胞同时存在,而对照组大鼠肝组织中几乎见不到凋亡的肝星状细胞;在大鼠肝纤维化过程中,随着肝纤维化程度加重,不同造模时间(2、4、6、8周)大鼠肝组织中肝星状细胞凋亡指数(47%±1%、41%±2%、35%±1%、29%±1%)逐渐下降(P<0.05,图3)。
四、SHP2表达与在体HSC凋亡的相关性
Pearson’s相关性分析显示,不同造模时间的大鼠肝组织SHP2免疫组化结果与不同造模时间的大鼠肝组织中活化肝星状细胞凋亡指数呈显著负相关(r值为-0.958,P<0.05)。上述分析表明,在四氯化碳诱导的大鼠肝纤维化病理过程中,纤维化大鼠肝组织SHP2表达与在体HSC的凋亡呈显著负相关。
A:对照组HE染色;B:造模6周HE染色;C: 对照组Masson三色染色;D:造模6周Masson三色染色
A:对照组;B:造模2周;C:造模4周;D:造模6周;E:造模8周
A:对照组;B:造模2周;C:造模4周;D:造模6周; E:造模8周
讨 论
肝纤维化是各种慢性肝病演变为肝硬化的病理过程,在参与此过程的众多细胞中肝星状细胞是最重要的细胞,其活化及增殖在肝纤维化的形成及发展中扮演重要角色[11-14];但在肝纤维化恢复期活化肝星状细胞的清除主要通过细胞凋亡机制实现[7, 15]。因此诱导活化HSC凋亡则成为逆转肝纤维化的重要策略。SHP2是具有促癌作用的蛋白酪氨酸磷酸酶,其在多种肿瘤中过表达,并可通过抑制肿瘤细胞的凋亡而促进肿瘤的发生、发展[1-4]。近年来对SHP2的研究已从肿瘤领域延伸至非肿瘤领域。有研究发现,在HBV感染相关的肝细胞癌患者的肝组织中,伴有纤维化的癌旁肝组织SHP2表达增高[5]。本研究发现,四氯化碳诱导的大鼠肝纤维化肝组织的SHP2表达明显高于正常大鼠肝组织,这与上述研究结果及SHP2在多种肿瘤组织中过表达相一致,证实在肝纤维化病理过程中肝组织的SHP2表达异常。同时,本研究也发现,在大鼠肝纤维化病理过程中,随着肝纤维化程度的加重,大鼠肝组织中在体肝星状细胞的凋亡指数(凋亡活化肝星状细胞占总的活化肝星状细胞百分比)逐渐下降,并与逐渐升高的肝组织SHP2表达呈显著负相关。如上所述,HSC 凋亡对肝纤维化的修复具有重要意义, 在肝纤维化恢复过程中 ,活化 HSC 数量的减少主要是通过细胞凋亡机制实现。尽管肝纤维化病理过程中影响在体HSC凋亡的因素较多,但SHP2在肿瘤方面的研究已证实,其过表达可通过抑制肿瘤细胞凋亡促进肿瘤的形成及发展,并且已有体外研究显示,体外活化HSC的SHP2表达下调,其增殖受到明显抑制[6]。故本研究提示,肝纤维化病理过程中肝组织的SHP2表达上调可能通过抑制在体活化HSC的凋亡参与了肝纤维化的病理过程,这一结论尚需进一步研究证实。

