紫堇灵对三阴性乳腺癌细胞增殖、干性以及凋亡的影响
李施霖,孔祥溢,方 仪
国家癌症中心 国家肿瘤临床医学研究中心 中国医学科学院 北京协和医学院 肿瘤医院乳腺外科,北京 100021
随着医学的进步与发展,虽然癌症的治疗手段越来越先进,但癌症尤其是乳腺癌的发病率却始终居高不下。据统计,仅2020年,全球乳腺癌新发病例约226万,我国新发乳腺癌病例则超过40万,全球死亡病例68万,且发病呈现年轻化趋势[1]。乳腺癌严重危害女性身心健康,其中三阴性乳腺癌(triple negative breast cancer,TNBC)是乳腺癌中恶性程度最高的类型,约占诊断出乳腺癌病例的15%~20%[2]。TNBC中雌激素受体、孕激素受体及人类表皮生长因子受体- 2均为阴性,缺乏治疗靶点,且易发生化疗耐药,传统化疗药物治疗效果较差,因此寻找新型治疗药物十分必要。天然产物来源广、毒性小、副作用少,是筛选新型化疗药物的理想来源。近年各领域均更倾向于应用天然产物开发药物[3]。布氏紫堇为多年生草本植物,分布于中国北部和东部、蒙古的东南部、朝鲜半岛的北部和俄罗斯的远东地区等[4]。干燥的整株布氏紫堇在中国传统中药中称之为苦地丁,苦地丁多用于抗炎、清热解毒以及凉血消肿。而紫堇灵是提取自布氏紫堇干燥根带全草的一种生物碱类,也是布氏紫堇的主要活性成分之一[5]。有研究显示,紫堇灵的抗炎作用是由c-Jun氨基末端激酶和p38磷酸化的抑制介导的,而不是细胞外调节蛋白激酶1/2磷酸化,这些磷酸化事件又受到核因子E2相关因子2/抗氧化响应元件通路的调控[6]。紫堇灵还可在关节炎大鼠模型中通过抑制氧化应激及炎症反应发挥抗风湿性关节炎的作用[7]。从中医学的角度来讲,肿瘤与体内毒邪有关,一般使用清热解毒药物加以治疗,而肿瘤本身又可导致炎症反应的产生,炎症反应又反过来促进肿瘤的发生发展,因此,抑制炎症反应可以在一定程度上扼制肿瘤的发展。目前对紫堇灵抗肿瘤的研究较少,仅报道了紫堇灵对于黑色素瘤的抑制作用:经紫堇灵处理的黑色素瘤细胞系活性氧增多,凋亡增加,细胞周期被阻滞于G2期,可被作为治疗黑色素瘤的潜在药物[6]。紫堇灵在TNBC中的抗癌作用报道更少。本研究通过CCK- 8法、Western blot等方法,探究紫堇灵对TNBC细胞增殖、干性、凋亡以及侵袭、转移的作用,以明确紫堇灵对TNBC细胞的作用及机制,为开发新的抗TNBC药物提供候选对象并奠定研究基础。
材料和方法
材料紫堇灵(1 mg,纯度 98.17%)购于上海陶素生化科技有限公司,以10 mmol/L的浓度溶解在二甲基亚砜(dimethyl sulfoxide,DMSO)中,于-80 ℃储存(图1)。

图1 紫堇灵化学结构式
细胞培养MDA-MB- 436细胞购自美国组织培养库,在含10% 胎牛血清、1%青霉素-链霉素的DMEM培养基中,饱和湿度培养箱(37 ℃,5% CO2)中培养。MCF- 10A细胞购自美国组织培养库,在含5% 马血清、1%青霉素-链霉素2 mmol/L谷氨酰胺、20 μg/L生长因子、 100 μg/L霍乱霉素、0.01 g/L胰岛素、500 μg/L氢化可的松的DMEM-F12培养基中,饱和湿度培养箱(37 ℃,5% CO2)中培养。
CCK- 8检测细胞活力以 4×103个细胞/孔的密度将MDA-MB- 436 细胞接种在 96 孔板中。 24 h后,加入不同浓度的紫堇灵(0、0.1、0.2、0.5、1、2、5、10 μmol/L)培养24、48、72 h。培养终止,每孔加入10 μl CCK- 8试剂和100 μl无血清培养基,孵育1 h。使用96孔热循环仪测量 450 nm 处的光密度值。
细胞平板克隆实验以4.0×103/孔的密度将MDA-MB- 436细胞接种于6孔板中,用不同浓度的紫堇灵(1、2、5 μmol/L)处理细胞,并将加入等体积的DMSO处理者作为对照组。10 d后,将细胞用甲醇固定并用结晶紫染色。洗去多余的染料后,在倒置显微镜下拍照,按一定标准计数细胞形成的克隆数。
流式细胞术检测细胞凋亡膜联蛋白 V-荧光素异硫氰酸酯/碘化丙啶双标记用于确定紫堇灵对MDA-MB- 436细胞的凋亡诱导作用。以每孔 5×105个细胞/孔的密度将MDA-MB- 436细胞接种于6孔板中,并以3、5 μmol/L的紫堇灵处理细胞24 h。然后用胰酶将细胞消化,离心,收集,用荧光素异硫氰酸酯偶联的膜联蛋白V和碘化丙啶对细胞进行孵育。通过流式细胞术测量细胞凋亡,并使用软件(美国BD 生物科学细胞探索研究 6.1.3)分析数据。
蛋白质印迹分析使用蛋白裂解液(购自上海翊圣生物科技有限公司)从MDA-MB- 436细胞中提取蛋白质。使用BSA测定法测定蛋白浓度。本研究采用的分离胶浓度为10%,上样量为20 μg蛋白质。采用70 V电压,待蛋白样品越过浓缩胶并且大约呈一条直线时,将电压调升至100 V,直至电泳结束。电泳结束后,将分离胶上的蛋白转移到 聚偏二氟乙烯膜。转膜条件:4 ℃,转膜2 h。转膜结束后,使用5%脱脂奶粉封闭聚偏二氟乙烯膜,并以抗聚腺苷二磷酸核糖聚合酶(1∶1000)、抗剪切的-半胱氨酸蛋白酶 3(1∶800)、抗β-actin(1∶3000)、抗八聚体结合转录因子4(octamer-binding transcription factor- 4,Oct- 4)(1∶1000),抗Kruppel样因子4(Kruppel-like factor- 4,KLF4)(1∶800),抗人胚胎干细胞关键蛋白2(SRY-related high-mobility-group-box protein- 2,SOX2)(1∶800),抗重组人B细胞淋巴瘤因子2 XL(recombinant human B-cell leukemia/lymphoma XL,Bcl-XL)(1∶1000),抗髓样细胞白血病蛋白- 1(myeloid cell leukemia- 1,MCL- 1)(1∶1000)抗体4 ℃过夜孵育,然后加入二抗(1∶4000)在室温下孵育1.5~2 h。使用普通曝光液和增强曝光液(均购自赛默飞世尔科技有限公司)对条带进行显影。此外,β-actin用于量化蛋白质的数量和完整性。使用ImageJ 1.8.0(美国国立卫生研究院)量化条带的灰度。
细胞侵袭转移按照1.2×105个细胞/孔的密度,将MDA-MB- 436细胞接种至由聚碳酸酯过滤器隔开的24孔碳酸脂膜板的上室。在上室添加无血清培养基(其中实验组加入3 μmol/L紫堇灵,对照组加入等体积DMSO),下室则添加含有20%胎牛血清的培养基。24 h后,弃去上室细胞,并用 0.5% 结晶紫将细胞在4 ℃固定染色24 h,使用倒置显微镜计数并拍照。
转录组测序分析用紫堇灵(3 μmol/L)处理MDA-MB- 436细胞。使用Trizol收集样本并将其邮寄至明码(上海)生物科技有限公司进行转录组测序与分析。
统计学处理使用 SPSS 26.0和 Prism 8.0.1中的t检验进行统计分析。P<0.05 为差异有统计学意义。
结 果
半数抑制浓度根据测定结果绘制曲线并得出紫堇灵的半数抑制浓度为(4.209±0.898)μmol/L(图2)。

图2 紫堇灵在MDA-MB- 436细胞中24 h的半数抑制浓度
细胞增殖CCK- 8检测显示,紫堇灵可以抑制MDA-MB- 436细胞的增殖,且呈现时间与浓度依赖性(图3)。另外,相应浓度的紫杉醇与紫堇灵对人正常乳腺上皮细胞MCF- 10A具有相似的抑制效应(图4)。经过紫堇灵处理后,TNBC细胞MDA-MB- 436中的干性相关蛋白的表达量下降,且药物作用浓度越高,干性蛋白表达量下降越多(图5)。平板克隆实验结果显示,紫堇灵可以减少MDA-MB- 436细胞克隆数量的形成,并呈现浓度依赖性,进一步证实紫堇灵可对TNBC细胞的干性产生抑制(图6)。
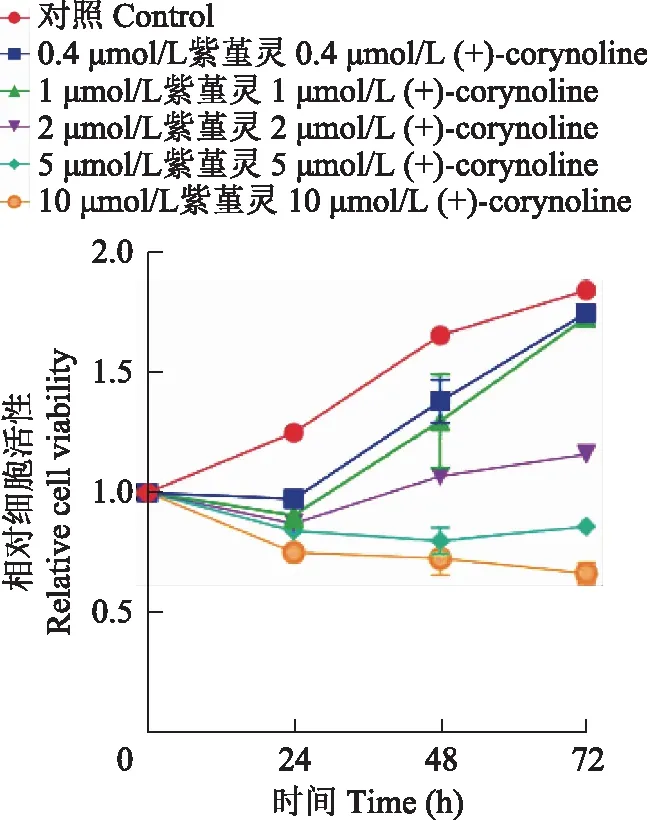
图3 不同浓度紫堇灵处理的MDA-MB- 436细胞生长曲线

图4 不同浓度紫堇灵与紫杉醇对正常乳腺上皮细胞MCF- 10A生长的影响

SOX2:抗人胚胎干细胞关键蛋白2;Oct4:八聚体结合转录因子4;KLF4:Kruppel样因子4;Mr:相对分子质量;DMSO:二甲基亚砜;1:DMSO;2:3 μmol/L紫堇灵;3:5 μmol/L紫堇灵

图6 不同浓度紫堇灵处理后MDA-MB- 436细胞克隆形成情况
细胞凋亡Western blot检测显示,经过紫堇灵处理后,聚ADP核糖聚合酶(poly-ADP-ribose polymerase,PARP)和剪切的半胱氨酸天冬酶 3蛋白表达量增高,而Bcl-XL和MCL- 1蛋白表达量减少(图 7)。此外,流式细胞术检测结果证实,紫堇灵可以促进TNBC细胞发生凋亡,且药物作用浓度越高,凋亡越显著(图8)。

PARP:聚腺苷二磷酸核糖聚合酶;Bcl-XL:重组人B细胞淋巴瘤因子2 XL;MCL- 1:髓样细胞白血病蛋白- 1;1:DMSO;2:3 μmol/L紫堇灵;3:5 μmol/L紫堇灵

图8 流式细胞术检测不同浓度紫堇灵处理MDA-MB- 436细胞时细胞凋亡情况
侵袭和转移细胞侵袭转移能力检测结果显示,紫堇灵对MDA-MB- 436细胞的侵袭和转移能力无影响(图9)。
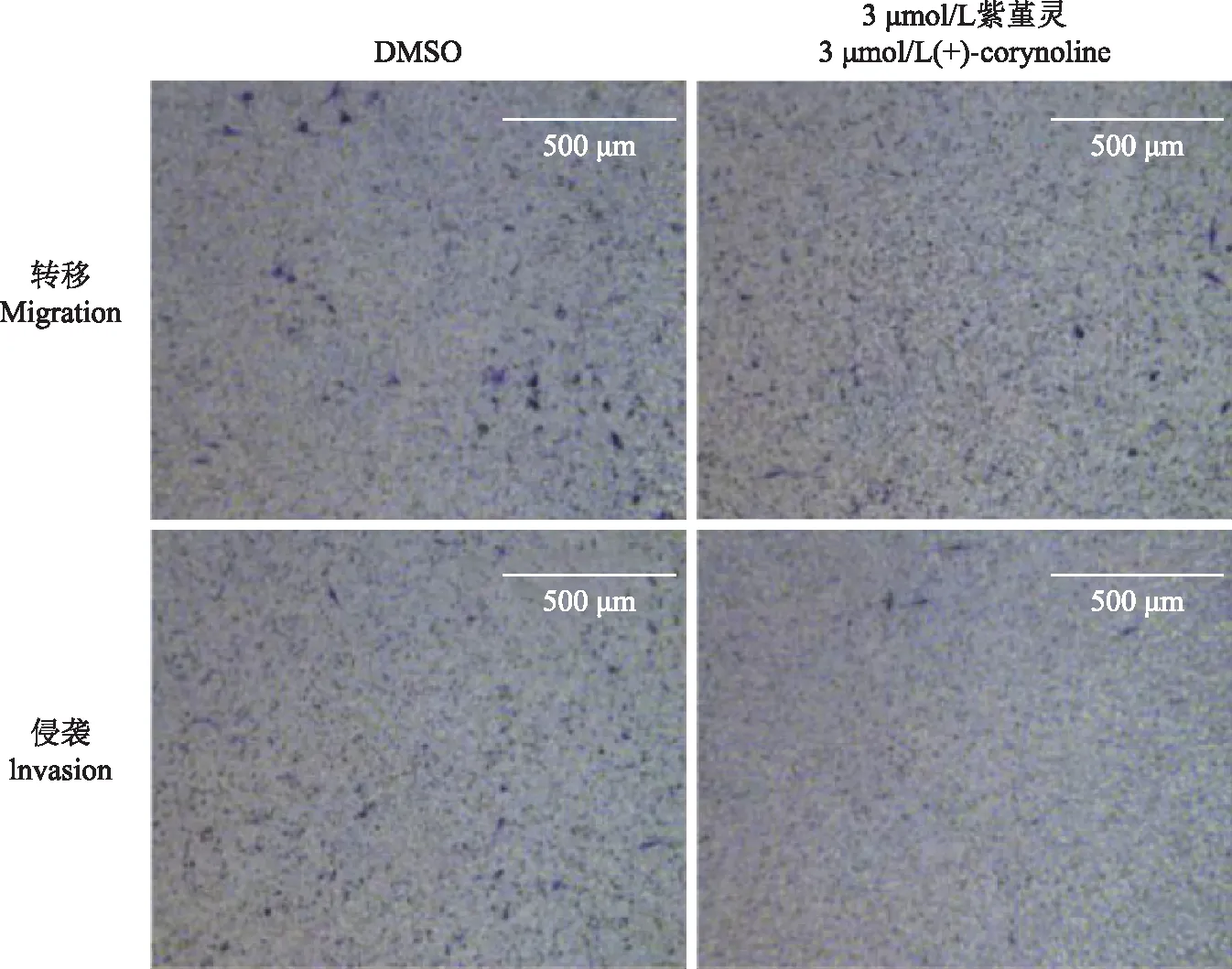
图9 紫堇灵对MDA-MB- 436细胞侵袭与转移能力的影响
RNA-Seq转录组测序分析结果经过紫堇灵处理后的TNBC细胞与对照组相比,二者的差异表达基因的生物学过程主要富集在氧化磷酸化、电子转移等方面。分子功能主要富集在NADH脱氢酶的活性,而细胞成分则富集在呼吸链中(图10)。京都基因与基因组百科全书通路富集分析显示,差异表达基因主要富集在氧化磷酸化通路中(图11)。

图10 基因本体论富集分析结果

图11 京都基因与基因组百科全书通路富集分析
讨 论
紫堇灵是苦地丁的有效活性成分,常用于抗炎、清热解毒,既往研究显示,其在大鼠模型中可有效抑制关节炎的发生[5]。但目前尚无紫堇灵在抗乳腺癌领域中的研究。本研究用不同浓度的紫堇灵处理TNBC细胞不同的时长,观察细胞表型(包括增殖、干性、凋亡、侵袭和转移),结果显示紫堇灵可以抑制TNBC细胞的增殖,具有时间依赖性和剂量依赖性。同时,还可以促进TNBC细胞的凋亡,呈现浓度依赖性。此外,本研究以正常乳腺上皮作为对照,证明紫堇灵对正常乳腺上皮无抑制作用,且与目前临床化疗用药紫杉醇相当,表明紫堇灵对正常乳腺上皮细胞的毒副作用有限并可以被接受。
紫堇灵可以降低干性相关蛋白的表达水平。SOX2在细胞发育的所有阶段均发挥重要作用。有研究证明,SOX2的过表达和基因扩增与多种肿瘤侵袭和转移有关,SOX2常用于在乳腺癌中定义分化程度较低的“干细胞表型”[8- 9]。Oct4可在多种肿瘤细胞中被检测到,并且在肿瘤干细胞中高表达;研究显示治疗后残留的乳腺癌细胞中Oct4的表达显著增加[10- 11],这些都表明Oct4与肿瘤细胞的干性有关。KLF4也已被证明可用作多种肿瘤细胞的干性标记物。提示紫堇灵可抑制TNBC细胞的干性。
紫堇灵可以影响多种凋亡相关蛋白的表达:PARP、剪切的半胱氨酸天冬酶和MCL- 1等,并能通过多种方式调节细胞凋亡。PARP是一种DNA修复酶,可以修复DNA。PARP是细胞凋亡核心成员半胱氨酸天冬酶的裂解底物,在DNA损伤修复和细胞凋亡中发挥主要作用。PARP被剪切,表明细胞凋亡正在发生[12]。半胱氨酸天冬酶3是一种蛋白酶,其剪切体被认为是细胞凋亡发生的通用标志物和细胞毒性淋巴T细胞杀伤机制的重要组成部分。大多数与细胞凋亡相关的事件和生化过程都与半胱氨酸天冬酶3相关[13- 15]。Bcl-XL是Bcl- 2家族的一种抗凋亡蛋白,可与线粒体凋亡通路中的关键分子结合,抑制细胞凋亡[16- 17];有研究表明,Bcl-XL可以通过破坏诱导死亡的信号复合物的形成,从而使半胱氨酸蛋白酶- 8失活,进而抑制细胞发生凋亡[18]。另一方面,Bcl-XL还可以通过与Bcl- 2家族的促凋亡成员Bax相互作用抑制细胞凋亡[19]。此外,Bcl- 2家族的抗凋亡蛋白MCL- 1最初发现于分化的髓系细胞中[20],在高度分化的上皮细胞(如乳腺、肺上皮细胞等)的顶端层更为常见。MCL- 1的表达在细胞凋亡过程中降低,半胱氨酸天冬酶介导的切割可能与MCL- 1的下调有关。MCL- 1在恶性细胞的存活中发挥关键作用,其活性降低影响细胞的活力。其中PARP和剪切的半胱氨酸天冬酶3为促凋亡蛋白,而Bcl-XL和MCL- 1为抑制凋亡蛋白,表明紫堇灵可以促进TNBC细胞MDA-MB- 436发生凋亡,并呈现药物浓度依赖性。本研究显示高浓度药物治疗组相比于低浓度组和对照组,促凋亡蛋白的表达量明显高于低浓度组,而高浓度药物治疗组抗凋亡蛋白的表达则受到抑制。表明紫堇灵可以显著增强MDA-MB- 436细胞的凋亡途径,从而抑制TNBC细胞的生长。
通过转录组测序和生物信息学相关分析,推测紫堇灵可能靶向氧化磷酸化途径发挥抗癌活性。而且,其抗炎特性可能对肿瘤引起的炎症反应发挥抑制作用,从而更好地抑制肿瘤的发生和发展。Weinburg等[21]研究显示线粒体和活性氧与KRAS介导的肿瘤形成密切相关。另有研究显示TNBC中的耐药干细胞可以通过MYC和MLC1基因的扩增,上调肿瘤细胞的氧化磷酸化水平[22]。另外,在体外和异种移植模型中已经被证实,抑制氧化磷酸化水平可以抑制肿瘤生长,这为未来的抗肿瘤治疗提供了潜在的选择与方向[23]。由此,笔者大胆猜想紫堇灵可能通过调节氧化磷酸化途径发挥抗TNBC的作用。
考虑到时间、培养条件、设备以及经费等客观条件的限制,本研究未对RNA-Seq测序得出的结果进行进一步实验验证以及体内动物实验。
针对紫堇灵相关的进一步研究,笔者认为可从以下几方面进行:(1)本研究仅在1个TNBC细胞系中进行,若想得到深入的研究结论还应在其他更多的TNBC细胞系中进行实验;(2)需要在多个其他TNBC细胞系中对紫堇灵进行药代动力学评估、药理研究以及药物毒性的评价。若体外实验结果较为理想,为了探索紫堇灵的临床药用价值,需要进行动物实验,甚至是临床药物试验;(3)针对紫堇灵作用机制的探索,可以从氧化磷酸化通路出发,检测药物作用前后通路中相关酶活性的变化,通过酶活性的差异继续探究具体的作用机制(例如紫堇灵可特定靶向作用于某种酶);(4)紫堇灵与目前临床用药(如紫杉醇)联合使用的疗效以及紫堇灵是否可以对化疗药物发挥增敏的效果也是未来值得探索的方向。
综上,紫堇灵作为苦地丁的有效成分,可抑制MDA-MB- 436细胞的增殖与干性,并促进其发生凋亡。此外,这些抗癌作用可能都与紫堇灵对氧化磷酸化通路的调控相关。本研究为未来在临床中使用紫堇灵治疗TNBC提供了新的理论基础,并为TNBC的治疗提供了新的思路。

