FOXO3A诱导结肠癌西妥昔单抗耐药的发生
黄志鹏 安娜 游必凯 付达华

摘 要:目的 分析转录因子FOXO3A在消化道肿瘤中的表达,并分析其在西妥昔单抗耐药中的作用。方法 通过TCGA数据库分析FOXO3A在消化道肿瘤中的表达水平及其与疾病无进展生存期和总体生存期的关系。通过对临床西妥昔治疗患者的术后样本进行FOXO3A免疫组织化学染色,分析其表达水平与西妥昔治疗效果的关系。通过构建西妥昔耐药Caco2细胞系(Caco2-CR),分析FOXO3A表达水平。通过在Caco2-CR细胞系中敲减FOXO3A,在Caco2西妥昔敏感细胞系(Caco2-CS)中上调FOXO3A表达,CCK-8(Cell Counting Kit-8)分析其增殖能力及对西妥昔治疗的反应性。结果 FOXO3A在食管癌、胃癌及直肠癌中表达高于其对应癌旁组织,在胃癌患者中,高表达FOXO3A患者的总体生存(P=0.044)及疾病无进展生存(P=0.015)较低表达FOXO3A患者差。在西妥昔耐药的结肠癌患者中,腫瘤组织中FOXO3A表达水平较高;而在西妥昔敏感患者中,肿瘤组织FOXO3A表达水平呈中等-低水平。西妥昔单抗不能有效抑制过表达FOXO3A的Caco2-CS细胞系;但在敲减FOXO3A的Caco2-CR细胞中,西妥昔单抗能有效抑制细胞增殖。结论 FOXO3A作为转录因子,在结肠癌患者西妥昔单抗耐药中发挥重要作用。
关键词:FOXO3A;西妥昔单抗;消化道肿瘤
中图分类号:R735文献标识码:A文章编号:1009-8011(2022)-10-0-05
消化道肿瘤是常见的癌症,其中结直肠癌(colorectal cancer,CRC)为全球第三大常见的癌症。目前,只有少数的转移性结直肠患者可以治愈;对于其他患者,化疗可改善症状,同时延长生存期。在大部分患者中,随着治疗时间的延长,肿瘤耐药性也随之出现。西妥昔单抗属于靶向治疗,其本身是一种嵌合单克隆抗体,对表皮生长因子受体(epidermal growth factor receptor,EGFR)具有高度选择性,可与EGFR胞外段结合,阻断下游的信号通路,抑制肿瘤细胞增殖。研究发现[1],在25%~80%的结直肠癌中存在EGFR过表达,且与疾病进展相关,用于治疗RAS基因野生型转移性CRC。然而肿瘤细胞对西妥昔单抗的耐药限制了其临床使用及药物的有效性。
叉头框O(fork head box class O,FOXO)家族是一种广泛表达的转录因子,FOXO3A是其核心成员,在人体多个器官均有表达,包括胃、肠、肺、乳腺、卵巢、前列腺和白细胞等,其活性受到多个水平的调节,包括基因表达水平、翻译后水平、蛋白稳定性及蛋白质相互作用等多个层面[2]。FOXO3A作为中央转录因子,转录调节多种生理和病理过程,参与细胞凋亡、细胞增殖、细胞周期、生存和DNA损伤。FOXO3A通过直接诱导或间接激活与细胞增殖、生长和存活相关基因的表达,调节肿瘤多种病理生理过程,其信号传导调控异常可促进肿瘤的发生发展。既往研究发现结直肠癌中FOXO3A表达上调,且与肿瘤分化程度、浸润深度、远处转移、分期和组织学分类相关[3]。然而,FOXO3A在消化道肿瘤中与抗肿瘤药物治疗的关系,特别是在单抗药物治疗中的作用尚不清楚。
1 材料与方法
1.1 TCGA数据库数据分析
在数据库中分析消化道肿瘤中,包括食管癌、胃癌、结肠癌及直肠癌,肿瘤组织与癌旁组织中FOXO3A的表达水平;同时,比较在不同肿瘤分期中的表达差异;分析不同FOXO3A表达水平与患者疾病无进展生存期及总体生存的关系。利用Kaplan-Meier法绘制生存曲线,Logrank秩检验分析生存差异。
1.2 西妥昔耐药细胞系的建立
Caco2细胞系购自中国科学院细胞库,且通过DNA分析测试。Caco2细胞在含10%胎牛血清的DMEM培养基中培养,培养条件37℃、5% CO2。在6个月的时间里,使Caco2细胞持续暴露于浓度不断增加的西妥昔单抗(生产企业:Merck Healthcare KGaA,注册证号S20171039)中,起始剂量10 μg/mL,2个月后增加至50 μg/mL,再经过2个月后增加至200 μg/mL,最后,将建立的西妥昔单抗耐药的Caco2细胞株(Caco2-cetuximab-resistance,Caco2-CR)保持在连续培养中,使用200 μg/mL的西妥昔单抗条件下维持细胞增殖。未经西妥昔单抗处理的Caco2细胞为西妥昔单抗敏感细胞系(Caco2-CS)。
1.3 CCK-8检测细胞增殖
利用Cell Counting Kit-8检测西妥昔单抗及对照组培养基连续处理西妥昔单抗敏感细胞系和西妥昔单抗耐药细胞系4 d的细胞增殖水平;检测过表达FOXO3A的西妥昔单抗敏感细胞系及敲减FOXO3A的Caco2-CR细胞系经西妥昔单抗及对照培养基连续处理4 d的细胞增殖水平。具体操作如下所述:将细胞按每孔2000细胞/100 μL铺入96孔板中,每孔加入300 μg/mL的细胞培养液,连续检测4 d。检测前,在培养基中加入10 μL CCK8终止培养。2 h后,使用酶标仪测定酶标板,利用OD450值测定细胞增殖水平,按照试剂盒说明书进行操作。
1.4 免疫组织化学染色
对临床接受西妥昔单抗化疗的15例术前结肠癌样本进行FOXO3A免疫组织化学染色。石蜡切片经过二甲苯(10 min,2次)、无水乙醇(10 min)、95%乙醇(10 min)、85%乙醇(10 min)、75%乙醇(10 min)后,利用EDTA缓冲液(pH 9.0)高压2 min进行抗原修复,然后自然冷却至室温,利用1×PBT缓冲液洗3遍后,切片在0.3%的过氧化氢中孵育30 min以灭活内源性过氧化物。然后利用正常山羊血清工作液封闭1 h,采用抗FOXO3A单克隆抗体(1:100稀释,生产企业:美国Cell Signaling Technology)作为一抗,在4℃下孵育过夜;利用1×PBT缓冲液洗3遍后,用高度敏感的链亲和素-生物素-过氧化物酶检测系统进行染色;利用1×PBT缓冲液洗3遍后,用苏木素进行细胞核染色。显微镜下观察染色情况。
1.5 WB检测蛋白表达
收集各处理组的细胞样本,加入全蛋白酶抑制剂及RIPA裂解液提取细胞蛋白,4℃充分裂解细胞15~20 min后,4℃离心15 min,收集上清液后利用BSA蛋白定量试剂盒进行总蛋白定量,按试剂盒说明书进行操作。定量后,在蛋白上清液中加入5×loading buffer,摇匀,100℃水浴变性10 min后将蛋白保存于-20℃冰箱。将20 μg总蛋白进行SDS-PAGE分析,采用10%分离胶进行蛋白电泳;使用半干转法将蛋白转移至PVDF膜后,利用5%脱脂牛奶室温封闭1 h后加入一抗,FOXO3A单克隆抗体(CST)4℃孵育过夜。利用1×TBST缓冲液洗膜3遍后,加入辣根酶标记山羊抗兔IgG(1:5000稀释,生产企业:北京中杉金桥生物技术有限公司),室温孵育1 h。利用化学发光试剂显影(ECL)。
1.6 细胞转染
构建携带绿色荧光蛋白序列的人FoxO3A-shRNA慢病毒载体(吉凯基因),重组FoxO3A慢病毒和阴性对照慢病毒的转染滴度为109 TU/mL。将西妥昔单抗耐药细胞按每孔2×105细胞接种于6孔板中,第2 d加入8 μg/mL polybrene及病毒。转染72 h后,用含4 μg/mL嘌呤霉素的选择培养基替换DMEM培养基,培养14 d后,更换为2 μg/mL嘌呤霉素的培养基,扩增7 d后转移至正常培养基中。过表达细胞系的构建流程:将FOXO3A ORF克隆至慢病毒载体GV358中(吉凯基因),利用包装质粒pHelper 1.0及2.0生成表达FOXO3A的慢病毒并感染西妥昔单抗敏感细胞系。转染72 h后,在含1 μg/mL嘌呤霉素的DMEM中培养筛选出稳定表达FOXO3A的细胞。
1.7 统计学分析
应用SPSS 20.0统计软件,计量资料比较采用单因素方差分析,计数资料比较采用χ2检验,应用ANOVA法分析FOXO3A在肿瘤组织及癌旁组织的表达差异,及FOXO3A在不同肿瘤分期中的表达差异,使用GarphPad Prism 7软件绘图。P<0.05表示差异有统计学意义。
2 结果
2.1 FOXO3A在消化道肿瘤的表达及与预后的关系
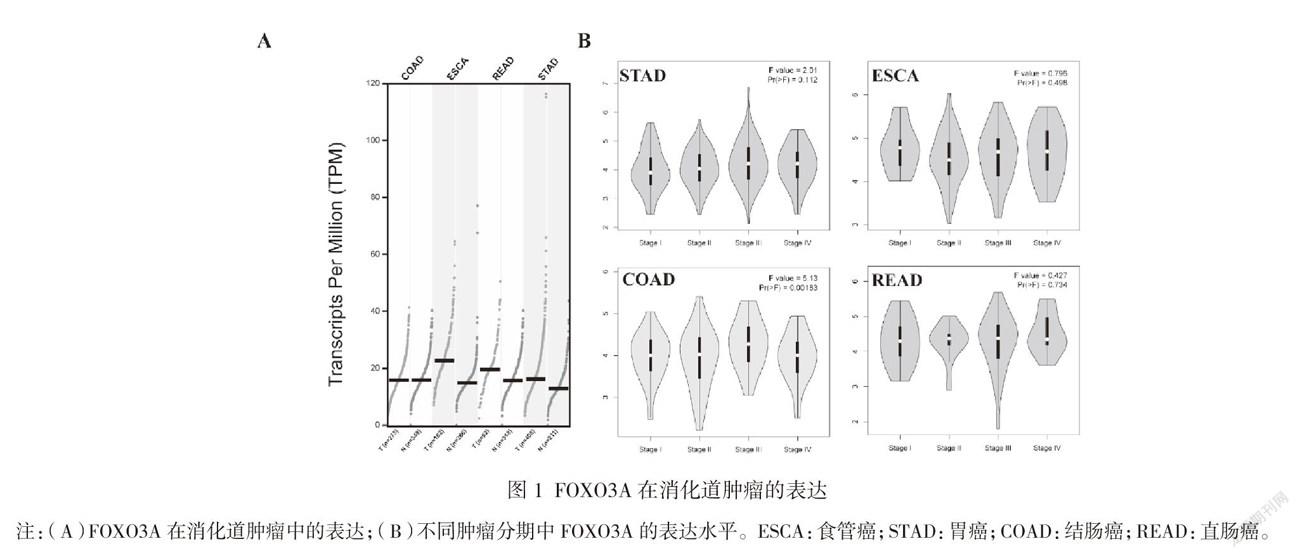
通过TCGA数据库分析发现,FOXO3A在食管癌、胃癌及直肠癌中表达高于其对应癌旁组织,而在结腸癌中FOXO3A在肿瘤及癌旁组织中的表达差异无统计学意义(P>0.05),见图1A。根据肿瘤分期进一步分析发现,在食管癌、胃癌及结直肠癌临床分期中,FOXO3A转录水平差异无统计学意义(P>0.05),见图1B。在胃癌患者中,高表达FOXO3A患者的OS(P=0.044)及DFS(P=0.015)较低表达FOXO3A患者差;而在食管癌、结肠癌及直肠癌中未发现FOXO3A的表达与预后的关系,见图2。
2.2 FOXO3A在西妥昔单抗耐药细胞系中的表达
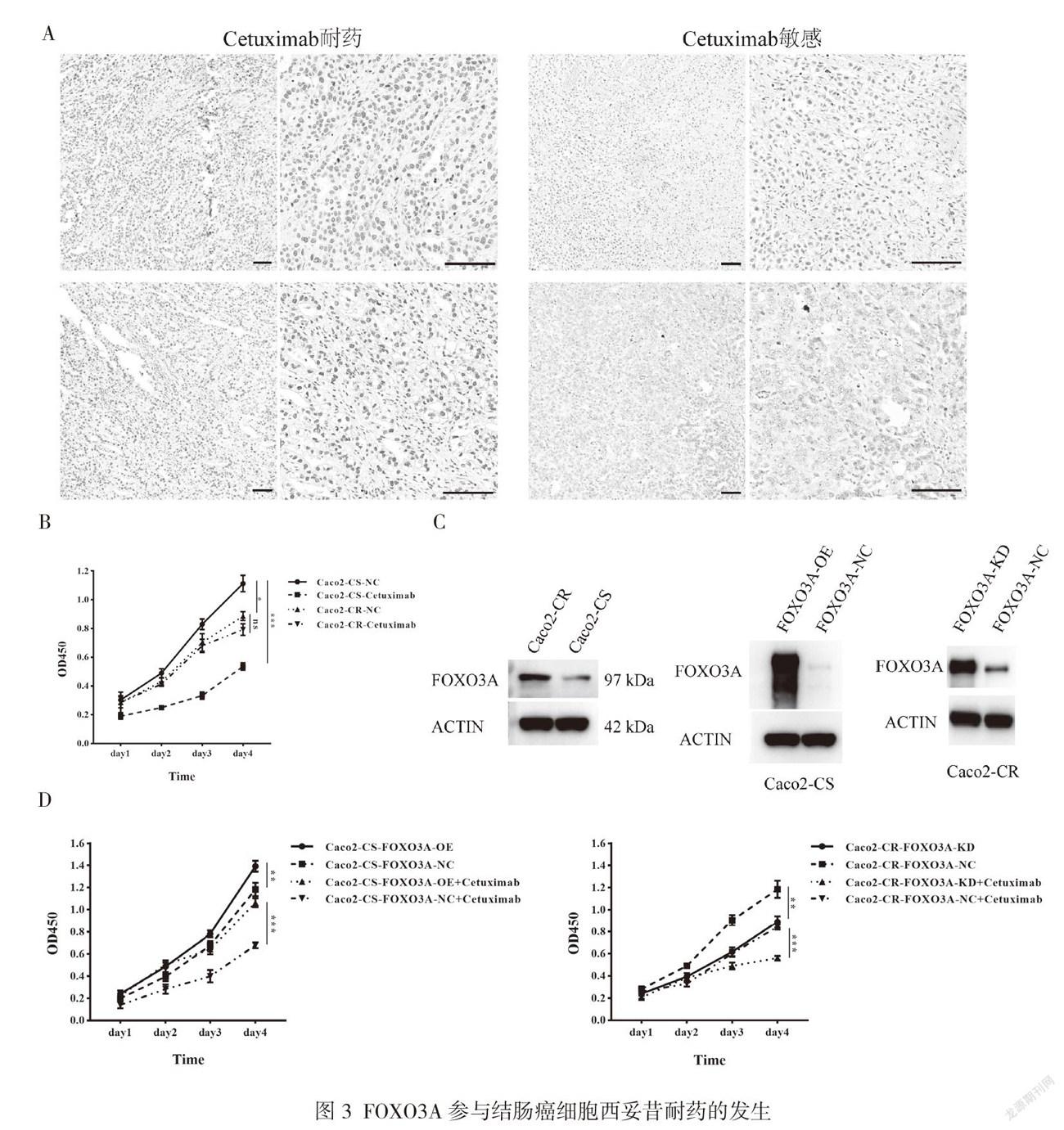
通过分析15例西妥昔单抗治疗的结肠癌患者(KRAS/NRAS野生型)术前切片FOXO3A的表达,6/15患者为西妥昔单抗耐药,9/15患者为西妥昔单抗敏感。在6例西妥昔单抗耐药的患者中,5例患者FOXO3A表达水平较高;而9例西妥昔单抗敏感患者中,6例患者FOXO3A表达水平低,3例患者表达水平中等,见图3A。
在西妥昔单抗敏感的细胞系中,加入西妥昔单抗处理后可显著抑制细胞增殖(P<0.001);与西妥昔单抗敏感细胞系相比,Caco-2-CR细胞的增殖速度在第4 d明显更低(P<0.05);西妥昔单抗不会影响西妥昔单抗耐药细胞的增殖,见图3B。
西妥昔单抗耐药细胞系中FOXO3A的蛋白表达水平高于西妥昔单抗敏感细胞系,见图3C。通过慢病毒成功构建过表达FOXO3A的西妥昔单抗敏感细胞系和敲减FOXO3A的西妥昔单抗耐药细胞系,见图3C。过表达FOXO3A的西妥昔单抗敏感细胞系的增殖速度较对照组细胞明显更快(P<0.01),见图3D;加入西妥昔单抗处理后,过表达FOXO3A的西妥昔单抗敏感细胞系的增殖速度显著快于对照组细胞系(P<0.001),见图3D。敲减FOXO3A的西妥昔单抗耐药细胞系,其增殖速度明显慢于对照组(P<0.01),见图3D;西妥昔单抗能够显著抑制FOXO3A的西妥昔单抗耐药细胞增殖(P<0.001),见图3D。
3 讨论
本研究结果显示,在西妥昔耐药的结肠癌患者中,FOXO3A表达水平上调。FOXO3A的高表达可能是西妥昔单抗在结肠癌患者治疗中疗效的预测生物标志物。FOXO3A是中央转录因子,相对分子质量约为71Kd,包含5个结构域,具有多种功能:①通过诱导多种靶基因转录(包括细胞凋亡、细胞周期和DNA损伤修复)调节多个生理和病理过程;②与人类寿命密切相关;③参与调节肌肉和癌细胞的自噬过程。本研究表明,FOXO3A的表达和/或活性的失调与一系列恶性肿瘤高度相关,如乳腺癌、前列腺癌、甲状腺癌、膀胱癌等。FOXO3A最近已成为诊断、预后和治疗多发性恶性肿瘤的潜在生物标志物,其表达已被确定为霍奇金淋巴瘤的癌细胞生物标志物。FOXO3A的表达水平与预后相关,其过表达与三阴性乳腺癌、肝癌、胶质母细胞瘤和胃癌患者的预后相关,而其低表达在胶质瘤和卵巢癌患者中与不良预后相关。磷酸化FOXO3A的表达在卵巢癌和急性髓系白血病中也被确定为预后生物标志物。FOXO3A的核定位被证明是一种乳腺癌的预后标志物。此外,FOXO3A的亚细胞定位被确定为预测宫颈癌、乳腺癌和食道癌化疗和放疗反应的生物标志物。
尽管西妥昔单抗和化疗对大部分转移性结直肠患者有很好的疗效,但在临床中对西妥昔单抗治疗产生应答的持续时间仅为8~10个月,主要原因为西妥昔单抗耐药的出现。西妥昔耐药受多种因素的调控[4-6]。内源性机制包括表皮生长因子受体配体过表达、表皮生长因子受体突变、RAS/RAF/PI3K基因突变、ERBB2/MET/IGF-1R激活、代谢重塑、微卫星不稳定及自噬增强等。外源性机制主要是肿瘤微环境的可塑性,特别是免疫细胞、肿瘤相关成纤维细胞和血管生成等,使得肿瘤对西妥昔单抗出现耐药。PI3K-Akt是表皮生长因子受体下游的经典信号通路,是参与肿瘤细胞增殖的关键细胞表面受体。本研究发现,FOXO3A通路对胶质瘤细胞的放疗耐药至关重要,抑制其表达可增强对患者的放疗应答。在乳腺癌中,拉帕替尼可通过诱导FOXO3A转录因子表达,进而上调c-Myc的表达,使其与表观遗传调控因子合作,抑制乳腺癌细胞对拉帕替尼的敏感性。在肺癌中,SIRT3/FOXO3A影响肺癌细胞对放疗的敏感性。这些发现表明FOXO3A可能是产生耐药性的一个潜在因素,高表达的FOXO3A及p38 MAPK可以预测KRAS野生型结直肠癌患者对西妥昔单抗的治疗反应[7-8]。长期使用西妥昔单抗处理的细胞系中FOXO3A的表达水平上调,其可进一步通过诱导c-Myc转录促进丙酮酸激酶肌肉同工酶M2的表达上调。研究发现,同时下调FOXO3A和c-Myc能够显著抑制肿瘤的增殖[9-10]。c-Myc是肿瘤发生发展中调控细胞存活、代谢的关键调控因子。有研究发现[11],FOXO3A与c-Myc有关,可促进缺氧代谢适应。因此,FOXO3A是结直肠癌对西妥昔耐药的关键调控因子。此外,FOXO3A使得树突状细胞对肿瘤抗原特异性CD8+T细胞耐受,提示其可能与肿瘤免疫微环境相关。综上,FOXO3A在西妥昔单抗耐药中发挥重要作用,其确切机制还需要进一步深入研究。
参考文献
[1]Marzi L, Combes E, Vie N, et al. FOXO3a and the MAPK p38 are activated by cetuximab to induce cell death and inhibit cell proliferation and their expression predicts cetuximab efficacy in colorectal cancer[J]. Br J Cancer,2016,115(10):1223-33.
[2]钟振,刘益飞,刘俊华.FOXO3a基因在癌症中的研究进展[J].中国肿瘤外科杂志,2013,5(3):184-186.
[3]刘鑫,胡皆乐,李佑,等.FOXO3在结直肠癌组织中的表达及临床意义[J].实用癌症杂志,2016,31(11):1773-1777.
[4]胡珊珊,宋彥,罗玉明,等.MiR-150-5p靶向HIF1α调控结直肠癌细胞西妥昔单抗耐药的相关机制研究[J].四川医学,2020,41(7):688-691.
[5]苏昊,刘文杰,包满都拉,等.转移性结直肠癌西妥昔单抗耐药的分子机制[J].国际肿瘤学杂志,2020,47(5):308-311.
[6]吴军,计骏,张俊,等.结肠癌K-ras突变与对西妥昔单抗耐药的实验研究[J].外科理论与实践,2009,14(4):396-402.
[7]Zhou J, Ji Q, Li Q. Resistance to anti-EGFR therapies in metastatic colorectal cancer: underlying mechanisms and reversal strategies[J]. J Exp Clin Cancer Res,2021,40(1):328.
[8]方庆亮,董昌盛,陈荣,等.SIRT3/FOXO3通路在肺癌A549细胞放疗抵抗中的作用机制研究[J].中国现代医学杂志,2021,31(12):28-34.
[9]滕春媛,李梅,范清玲.常规化疗方案联合西妥昔单抗治疗消化道肿瘤的效果分析[J].医药前沿,2021,11(27):90-91.
[10]熊峰,陶敏,段卫明,等.西妥昔单抗联合伊立替康三线治疗晚期结直肠癌的疗效观察[J].中华肿瘤防治杂志,2008,15(22):1759-1760.
[11]Ferber E C, Peck B, Delpuech O, et al. FOXO3a regulates reactive oxygen metabolism by inhibiting mitochondrial gene expression[J]. Cell Death Differ 2012,19(6):968-979.

