东北地区养殖淡水鱼有机氯和拟除虫菊酯农药残留及健康风险评价
黄晓丽,高磊,汤施展,黄丽,霍堂斌,王鹏,陈中祥,覃东立*
(1.中国水产科学研究院黑龙江水产研究所, 黑龙江 哈尔滨 150076;2.农业农村部黑龙江流域渔业生态环境监测中心, 黑龙江 哈尔滨 150076)
集约化种植业中农药类化学品的大量使用导致了此类物质在环境中,特别是湖泊、河流及地下水中的迁移、扩散与累积[1-3]。难降解农药在环境中代谢时间长,可沿食物链逐级放大并在生物体内累积,能够在环境中远距离迁移导致全球范围的污染,对环境和生物体的潜在危害不容忽视,是全球最重要的环境有机污染物之一[4-5]。此类污染物可通过各种途径进入地表或地下水,最终通过生物累积作用在淡水鱼类等水生生物体内富集[6-7],不仅会影响水产品的品质,还会通过食物链威胁到人类的健康[1-2, 4]。因此,水生生物体内农药残留的检测方法、残留水平及其食用健康风险仍然受到了广泛关注[3, 8]。
有机氯农药(Organochlorine pesticides,OCPs)是一类具有高持续性和生物蓄积性并对生物体产生致癌、致畸、致突变效应的有毒物质[9-10]。虽然OCPs中的六六六(HCHs)、滴滴涕(DDTs)、艾氏剂、狄氏剂、硫丹等从20世纪80年代开始就陆续被中国禁止/限制生产和使用,但是由于此类化合物降解缓慢,目前仍然能在不同区域的自然环境中检测出[11-12]。关于淡水水生生物体内OCPs残留的研究主要集中在湖泊、河流、水库等天然水域中[13-15],对人工养殖水体中水产品的研究相对较少。池塘养殖是中国主要的淡水养殖方式,其水源一般来自于临近地表水或地下水。在有OCPs施用或污染的区域,地表水与地下水可能会残留一定量的OCPs,而且养殖池塘多与农田距离较近,土壤中残留的OCPs可能通过地表径流的方式进入到池塘水体中,进而在养殖鱼类体内累积蓄存。拟除虫菊酯农药(Pyrethroid pesticides, PYRs)是一种广谱、高效、低毒的新型杀虫剂,在农田果蔬杀虫和水产养殖清塘、毒杀有害生物等过程中被广泛应用。养殖过程中施用的及通过地表径流进入池塘水体中的拟除虫菊酯农药不仅会威胁鱼类的生长,还可通过食物链进入人体,造成潜在危害。关于水产品中PYRs残留和风险评价报道较少,现有研究也主要集中在天然水体[16]。渔业养殖中施用PYRs后,不可避免地会残留在水中,进而对水生态安全造成威胁。因此,有必要深入研究池塘养殖水产品中的OCPs和PYRs残留状况及其健康风险。
东北地区种植业发达,历史上曾大量使用过OCPs[17],同时该地区水资源丰富,水产养殖业发展较好。本研究选择位于吉林省和黑龙江省的24个养殖渔场的养殖鱼类为研究对象,对鱼体肌肉中的OCPs(HCHs、DDTs、六氯苯、七氯、异狄氏剂、艾试剂、氯丹和狄试剂)和PYRs(氯氰菊酯、氰戊菊酯和溴氰菊酯)残留量进行检测,分析不同种类鱼体中OCPs和PYRs的残留特征,并评价了其食用的健康风险。研究结果为掌握OCPs和PYRs在水产品中残留特征及保障水产品质量安全提供科学依据与参考。
1 材料与方法
1.1 采样区域与样品采集
样品采集自黑龙江省哈尔滨市、佳木斯市、齐齐哈尔市和牡丹江市,吉林省长春市和四平市。鲤(Cyprinuscarpio)、鲫(Carassiusauratus)、草鱼(Ctenopharyngodonidella)和鳙(Aristichthysnobilis)样品共计284份,来自24家渔场。调查采集鱼类的体长和体重见表1。
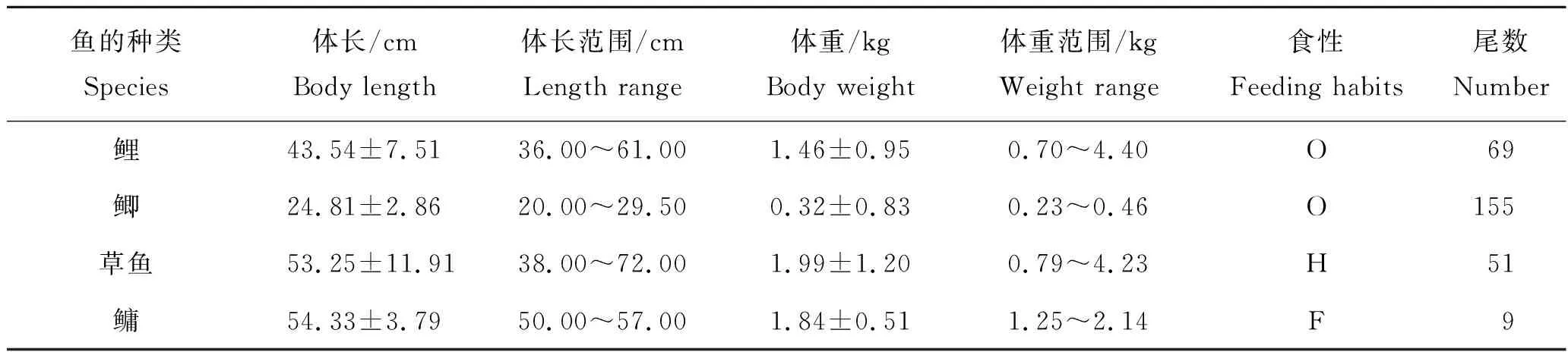
表1 采集鱼类样品的生物学参数Tab.1 Biological parameters of collected fish samples
1.2 材料与仪器
检测目标污染物为α-HCH、β-HCH、γ-HCH、δ-HCH、p,p′-DDE、p,p′-DDD、o,p′-DDT、p,p′-DDT、六氯苯、七氯、异狄氏剂、氯氰菊酯-Ⅰ、氯氰菊酯-Ⅱ、氯氰菊酯-Ⅲ、氯氰菊酯-Ⅳ、氰戊菊酯、溴氰菊酯、艾试剂、氯丹和狄试剂(表2);标准品购自国家标准物质研究中心。实验中使用的丙酮、石油醚、环己烷、乙酸乙酯等有机溶剂均为色谱纯,购自上海安谱公司;氯化钠、无水硫酸钠为分析纯,购自国药集团化学试剂有限公司;超纯水(电阻率≥18.2 MΩ·cm);氮气纯度高于99.999%。
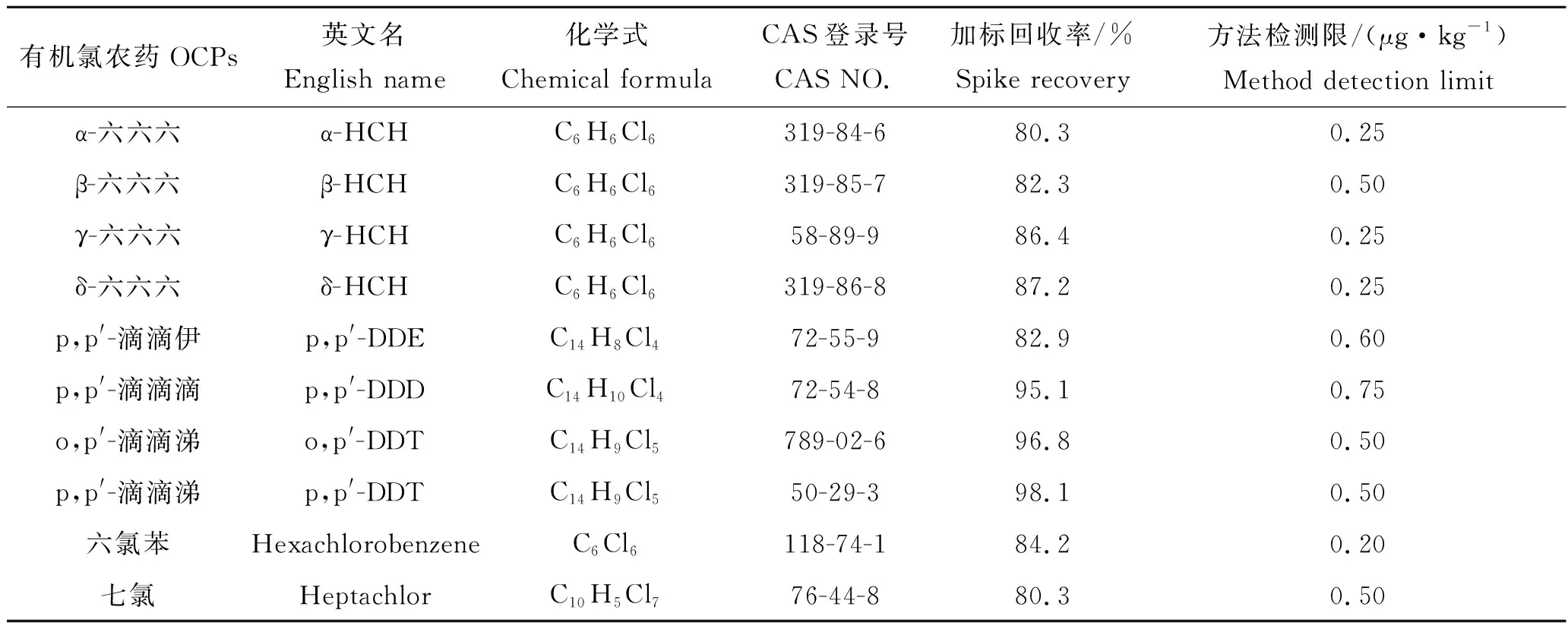
表2 目标农药的详细信息Tab.2 Detail information of the target pesticides
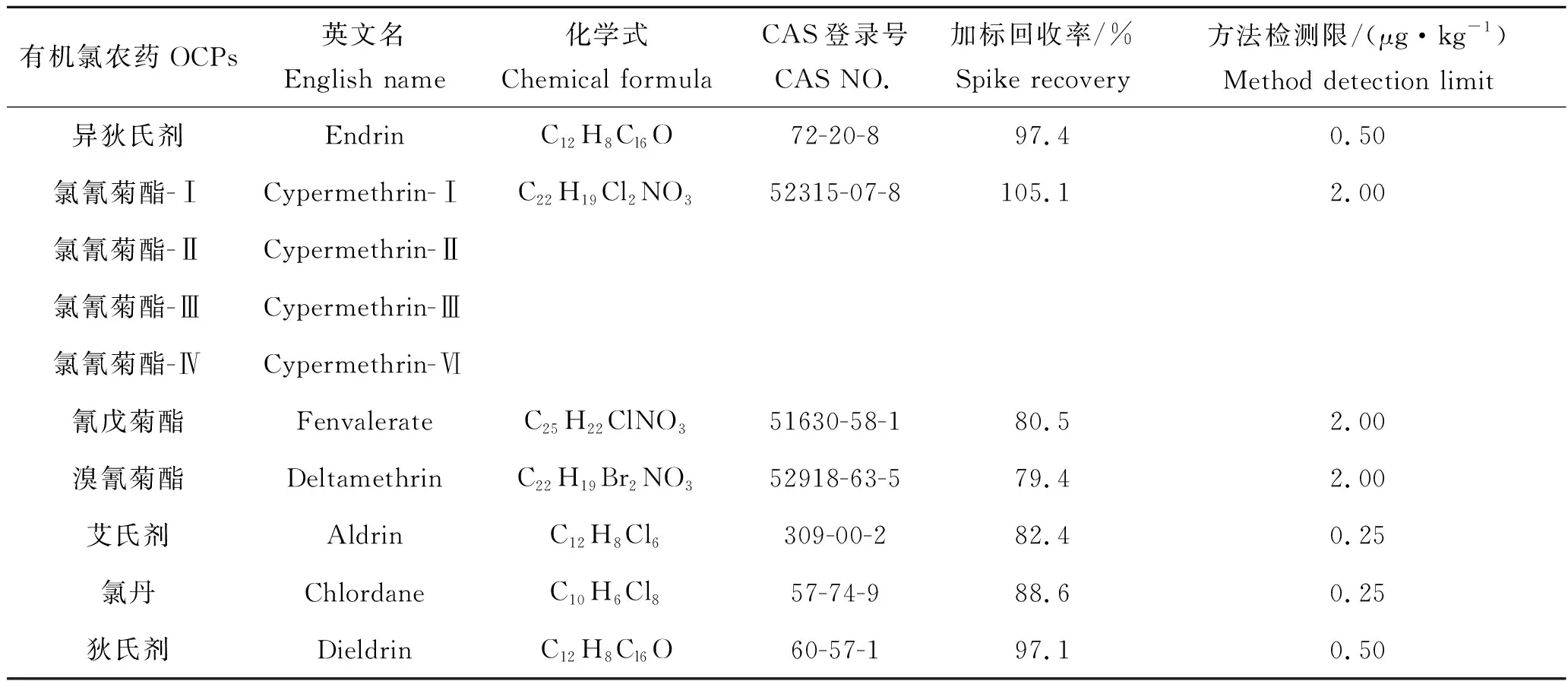
续表2,Tab 2 Continued
GC-6890N气相色谱(配有7683 自动进样器、63Ni电子捕获检测器ECD,安捷伦,美国)。IKA RV10旋转蒸发仪(IKA,德国)。凝胶净化柱:长30 cm、内径2.5 cm具活塞玻璃层析柱,柱底垫少许玻璃棉,用洗脱剂乙酸乙酯-环己烷(1∶1)浸泡的凝胶以湿法装入柱中,柱高约26 cm,使凝胶始终保持在洗脱液中。PB602-N电子天平(梅特勒-托利多,瑞士)。Milli-Q超纯水机(密理博,美国);移液器(Scientific,美国)。
1.3 样品处理与检测方法
采集的鱼类样品去鳞,取可食部分(皮+肉),捣碎匀浆后-20 ℃冷冻保存。检测方法参考国家标准GB/T 5009.162—2008[18]。称取匀浆样品20 g (精确至0.01 g),于100 mL具塞三角瓶中,加入6 mL水和40 mL 丙酮,振摇30 min,加氯化钠6 g,充分摇匀,再加30 mL石油醚,振摇30 min。取35 mL上清液,经无水硫酸钠过滤于旋转蒸发瓶中,浓缩至约1 mL,加2 mL乙酸乙酯-环己烷(1∶1)溶液再浓缩,如此重复3次,浓缩至约1 mL。将此浓缩液经凝胶净化柱以乙酸乙酯-环己烷(1∶1)溶液洗脱,弃去0 mL~35 mL流分,收集35 mL~70 mL流分,将其旋转蒸发至约1 mL。重复净化一次,收集35 mL ~ 70 mL流分,蒸发浓缩,用氮气吹除溶剂,以石油醚定容至1 mL,待GC分析。
色谱柱DB-5MS (30 m×0.25 mm×0.25 μm);进样口温度270 ℃;色谱柱升温程序为60 ℃ 保持1 min,以40 ℃/min的速度升至170 ℃,以2 ℃/min的速度升至235 ℃,以40 ℃/min的速度升至280 ℃ 保持10 min;载气为氮气,纯度99.999%,流速1.0 mL/min,尾吹50.0 mL/min。检测器为电子捕获检测器(ECD),检测温度300 ℃。进样量为1 μL。
1.4 质量控制与保证
本研究中样品的采集、保存和前处理等全过程都严格按照USEPA 的QA/QC 要求进行操作和监控。检测过程中加入平行样品、溶剂空白样品和加标回收率检测。空白样品目标化合物浓度绝大多数低于检测限。本研究中目标物质的加标回收率范围是79.4%~ 105.1%,平均值为(88.5±7.8)%,回收率满足实验要求。该方法对鱼肉OCPs和PYRs残留检测限为0.25~2.00 μg/kg。
1.5 食用风险评价
采用通用的危险系数法(Target hazard quotient,THQ)对人体摄入OCPs残留的健康风险进行评价,计算公式如下:
EDI=F×R/W
式(1)
THQ=EDI/ADI
式(2)
式(1)中EDI为OCPs的实际摄入量估算值,μg/kg体重/day;F为日均鱼类摄入量,kg/(人·d),本研究取0.023 7 kg/(人·d);R为鱼样中OCPs的实际残留量(μg/kg),本研究取各污染物的最大值;W为平均体重(kg),本研究以60 kg计。式(2)中THQ指目标危险系数;ADI(Acceptable daily intake)为每日允许摄入量。当THQ<1,认为暴露人群无明显健康风险;当THQ>1时,则认定暴露人群存在健康风险。THQ值越大,相应的风险越大。
1.8 数据分析
实验数据以平均值±标准误差(X±SE)表示,利用Prism 7.0软件绘制数据图,SPSS 19.0软件进行统计学分析。用单因素方差分析法(One-way ANOVA)分析不同种类鱼体内有机氯农药残留量差异,以P<0.05为差异显著水平。
2 结果与分析
2.1 不同养殖淡水鱼肌肉中OCPs和PYRs残留水平
α-HCH、β-HCH、γ-HCH、δ-HCH、p,p′-DDE、o,p′-DDT、p,p′-DDT、六氯苯、七氯、异狄氏剂、氯氰菊酯-Ⅲ和狄试剂12种农药在养殖鱼类体内均有检出,而p,p′-DDD、氯氰菊酯-Ⅰ、氯氰菊酯-Ⅱ、氯氰菊酯-Ⅳ、氰戊菊酯、溴氰菊酯、艾试剂和氯丹8种农药未检出(表3)。检出率占前3名的目标物分别为七氯(98.94%)、六氯苯(84.15%)和β-HCH(78.17%);养殖鱼类体内各农药的检出平均含量为0.06~19.13 μg/kg,其中氯氰菊酯-Ⅲ的含量最高(19.13 μg/kg),其次为七氯(4.75 μg/kg)。养殖淡水鱼体内农药含量平均值按由大到小排列前5 种分别为氯氰菊酯-Ⅲ、七氯、o,p′-DDT、p,p′-DDE 和狄试剂(表3)。个别渔场采集的样品中氯氰菊酯残留量较高,这可能与养殖过程中使用其治疗由寄生虫引起的淡水鱼疾病有关。
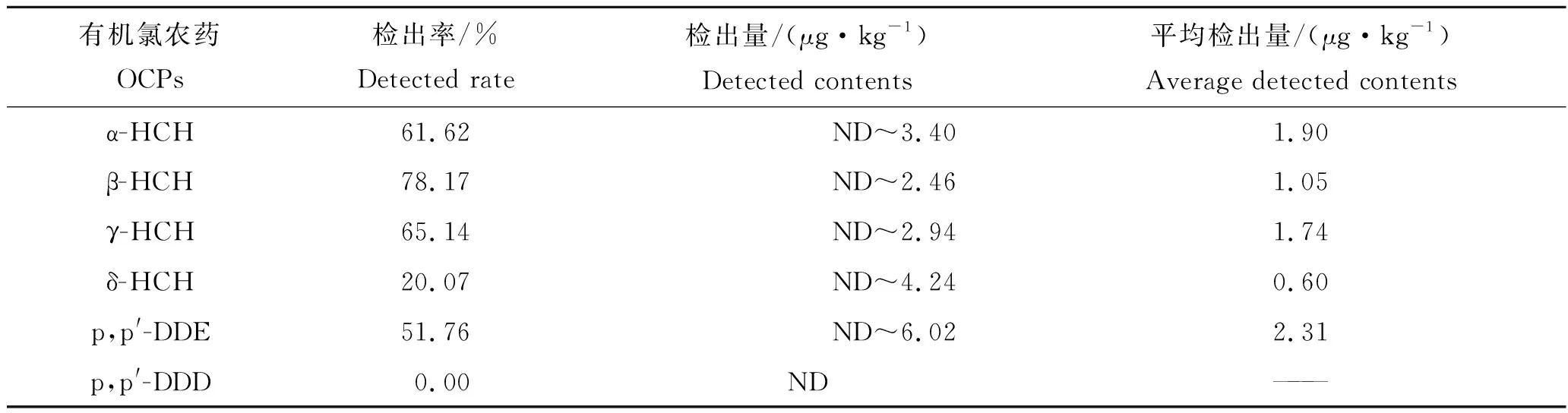
表3 样品中农药残留情况Tab.3 Pesticide residues in fish samples
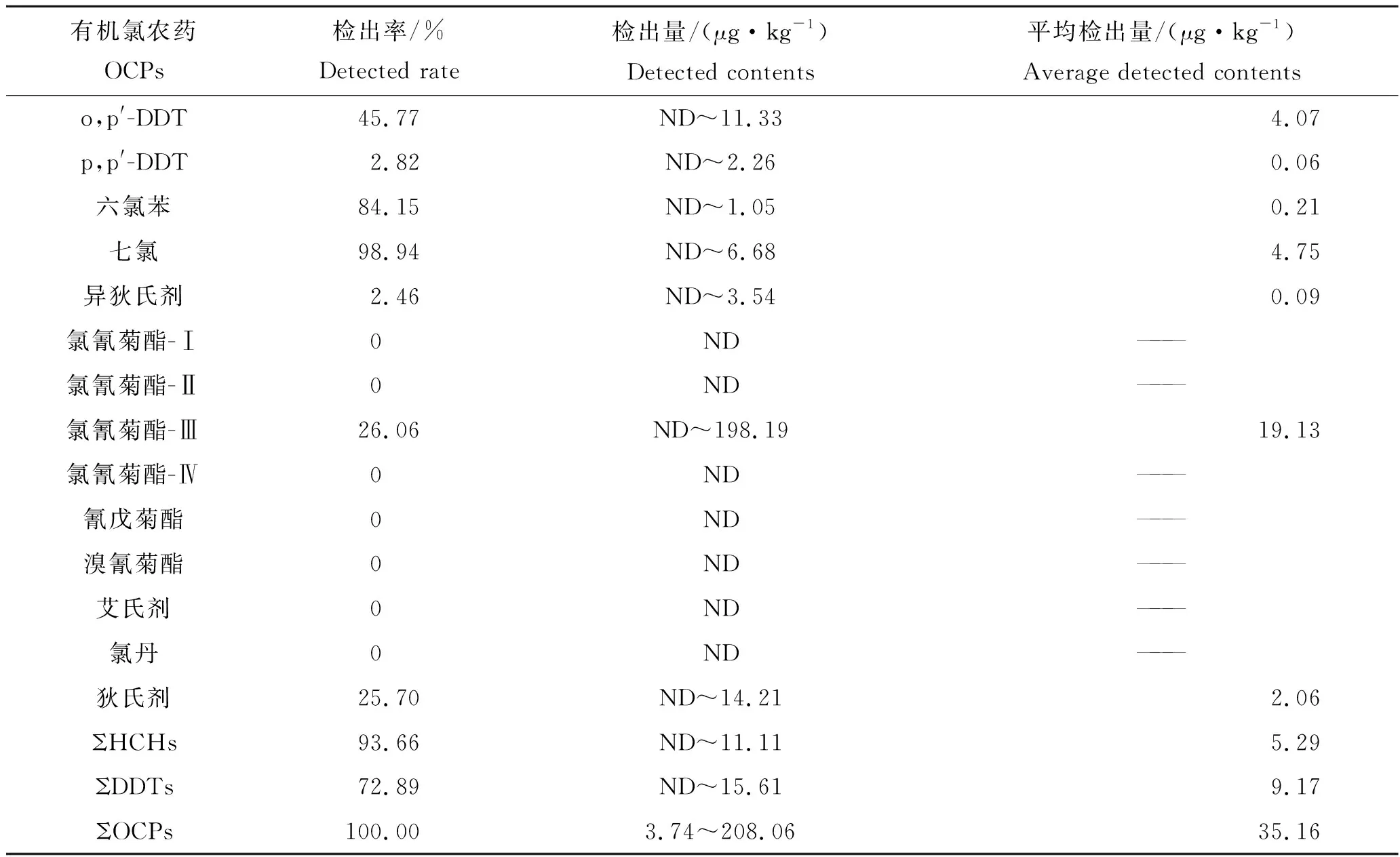
续表3,Tab.3 Continued
从农药残留整体水平看,4 种鱼类体内农药残留总量排序为:鲫>草鱼>鲤>鳙,农药总量最高的为鲫,检出含量在5.56~191.58 μg/kg之间,平均值为43.56 μg/kg(表4)。不同鱼类中同种农药的残留量有显著性差异,这可能与他们的食性和生活习性有关,滤食性鱼类鳙和草食性鱼类草鱼肌肉中的农药残留的平均水平低于杂食性鱼类。杂食性鱼类鲤和鲫在水体中下层生活,以底栖生物或有机颗粒为食,易于富集沉积物或固体悬浮物中吸附的农药。HCHs、七氯和氯氰菊酯-Ⅲ在鲫中的含量明显高于其他鱼体中的含量,异狄氏剂仅在1个鲫样品中检出;而DDTs在草鱼体内含量最高;六氯苯和狄试剂在鲤体中较多。
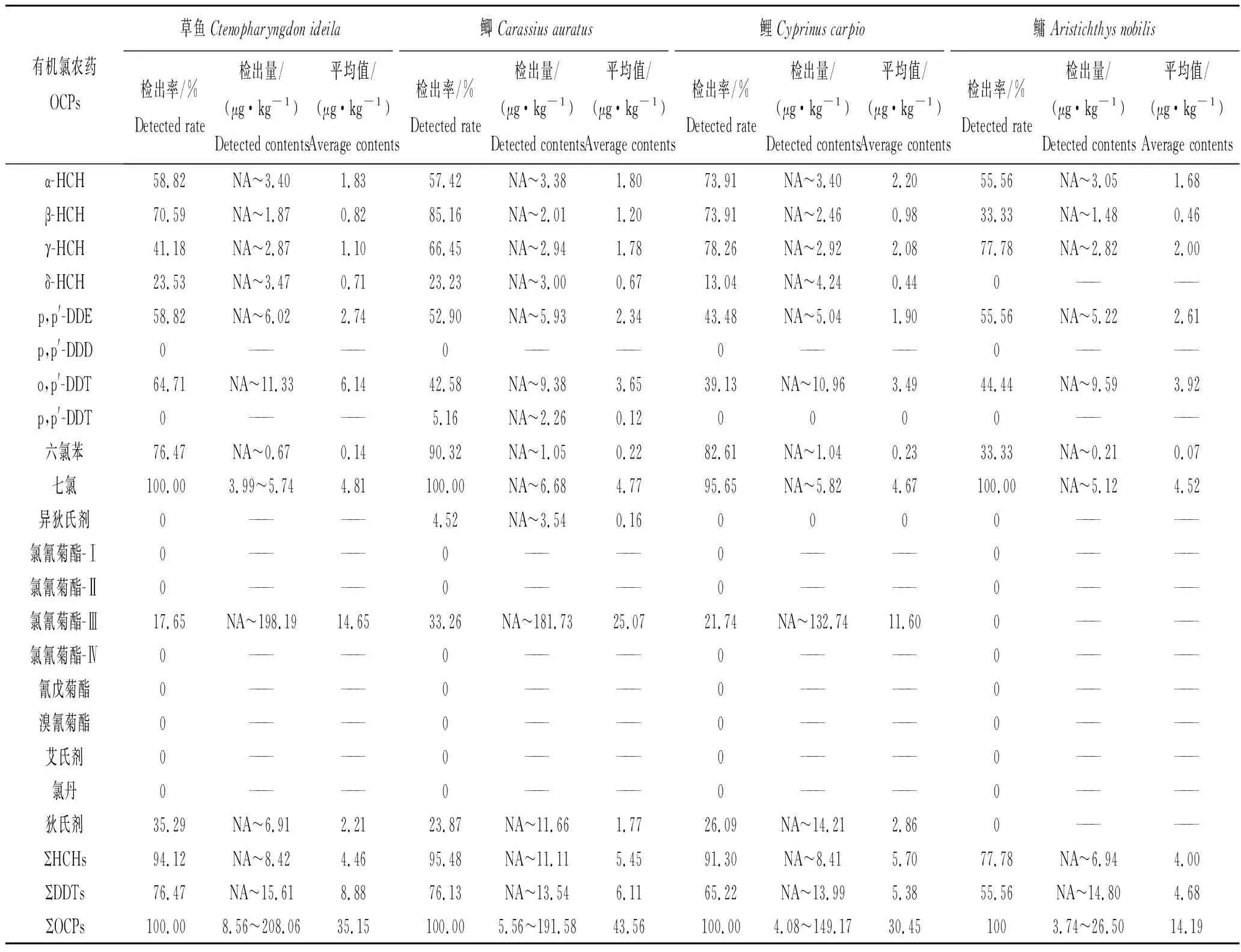
表4 4种鱼体肌肉样品中OCPs农药的残留情况Tab.4 Residual concentrations of OCPs in 4 kinds fish muscle samples
由表4可知,4 种鱼类体内HCHs 的含量在ND~11.11 μg/kg之间,从高到低排列依次是鲫,鲤>草鱼>鳙。鲫和鲤体内HCHs平均残留量较接近,分别为5.45 μg/kg和5.70 μg/kg;鳙体内HCHs平均残留量较低,其残留量在ND~6.94 μg/kg之间,平均残留量为4.00 μg/kg。4种鱼体内HCHs 4种异构体残留均以α (γ) -HCH为主,不同种类之间差异明显。4种鱼类体内DDTs 的含量在ND~15.61 μg/kg之间(仅统计p,p′-DDE和o,p′-DDT;p,p′-DDT仅在1个鲫样品中检出),从高到低排列依次是草鱼>鲫>鲤>鳙。草鱼中DDTs检出含量在ND~15.61 μg/kg之间,平均值为8.88 μg/kg。不同种鱼类体内的o,p′-DDT残留量均大于p,p′-DDE。不同食性鱼体内主要含p,p′-DDE和o,p′-DDT两种异构体,p,p′-DDE占DDTs残留总量的百分比在4种鱼类体内的残留含量没有显著差异。肉食性鱼类鳙的p,p′-DDE/DDTs值(35.24%~100%)比杂食性鱼类鲤和鲫的该比值高(1.35%~95.95%),说明鱼体中DDTs 的代谢产物主要以p, p′-DDE 的形式存在。
4种鱼类体内的六氯苯、七氯和狄试剂残留量差异性不大,且水平较低。鲤体内六氯苯和狄试剂的平均残留量最大,分别为0.23 μg/kg和2.86 μg/kg;鲫体内七氯的平均残留量最大,为4.77 μg/kg。氯氰菊酯-Ⅲ在4 种鱼类体内残留量排序为:鲫>草鱼>鲤,鳙样品中均未检出。
2.2 与其他地区OCPs和PYRs残留水平的比较
本研究中养殖淡水鱼中HCHs 残留量为ND~11.11 μg/kg(表3),低于北京市(ND~174.7 μg/kg)[19]、湖北省(ND~25.07 μg/kg)[20]、长三角地区(41.79~110.00 μg/kg)[21]、东北地区(0.14~20.00 μg/kg)[22]、广东沿海地区[2.00~15.00 μg/kg (dw)][23]流通或养殖环节的水产品中的残留水平,但高于太湖梅梁湾水生生物体内的HCHs残留量(0.14~3.12 μg/kg)[14]和松花江流域鱼类体内的HCHs残留量(0.053~0.500 μg/kg)[13]。目前已知HCHs有8种异构体,其中具有明显杀虫效果的是γ-HCH(99%的γ-HCH称为林丹)。20世纪70~80年代,包括中国在内的世界各国陆续禁止生产混合六六六,仅限量使用林丹。在自然条件下,γ-HCH与α-HCH可互相转化[24]。本次研究结果表明调查的鱼体中HCHs的累积均以α (γ) -HCH为主,α-HCH和γ-HCH残留量分别在ND~2.94 μg/kg和ND~3.40 μg/kg之间。
东北地区池塘养殖淡水鱼中DDTs 残留量相对较低,为ND~15.61 μg/kg(表3)。低于北京市(ND~181.5 μg/kg)[19]、白洋淀[9.2~19.0 μg/kg (dw)][25]、湖北省(ND~559.31 μg/kg)[20]、太湖梅梁湾(1.36~21.90 μg/kg)[14]、广东沿海地区[1.90~140.00 μg/kg (dw)][23]水生生物体内的DDTs 的残留水平,但高于松花江流域鱼类体内的DDTs残留量(0.073~0.220 μg/kg)[13]。DDTs禁用后,不再输入新的污染物,水环境及鱼体中的DDTs残留会逐渐减少。DDTs 4种异构体的残留量无明显分布规律。p,p′-DDT是DDTs的有效成分。已有研究表明,p,p′-DDT在鱼体组织中的半衰期为8个月,DDTs在生物体内的代谢产物主要是p,p′-DDE 和p, p′-DDD。p,p′-DDT/DDTs比值较高表明鱼体可能有新的DDT污染源摄入[15, 26]。
农药总残留浓度范围为3.74~208.06 μg/kg(表3)。南通48个养鳗场中的鳗鱼(Anguillidae)体内10种OCPs浓度平均为58.00 μg/kg (dw)[27],太湖梅梁湾生物样品中OCPs 浓度范围在2.68~31.34 μg/kg之间[14],长三角地区池塘养殖水产品中ΣOCPs 浓度范围为16.00~82.00 μg/kg (dw)[21]。湖北省流通和养殖环节的水产品有机氯农药目标物23 种,检出的为11 种,检出浓度范围为0~488.99 μg/kg,显著高于本研究中农药残留浓度[20]。与这些水产品相比,本研究的水产品体内农药残留同样处于较低水平。
2.2 养殖淡水鱼食用健康风险评价
中国在《食品安全国家标准 食品中农药最大残留限量》(GB 2763—2021)中规定[28],食品中ΣHCHs≤0.1 mg/kg,ΣDDTs≤0.5 mg/kg,本研究中养殖淡水鱼体内HCHs和DDTs含量的平均值和最高值均未超出此标准。在《食品安全国家标准 食品中兽药最大残留限量》(GB 31650—2019)中对鱼(皮+肉)中氯氰菊酯的最高残留限量(MRL)为30 μg/kg。本研究中部分样品的氯氰菊酯残留量超出此限量,有检出的样品超标率为66.67%。六氯苯、七氯、异狄氏剂和狄试剂在中国已明令禁止使用三十多年。
根据鱼体内HCHs、DDTs、六氯苯、七氯、异狄氏剂、氯氰菊酯-Ⅲ和狄氏剂残留的最大值计算的EDI值分别为4.39、6.17、0.41、2.64、1.40、78.29和5.61 ng/kg体重/day(表5)。在本研究中,检出的有机氯农药的EDI值均低于每日允许摄入量ADI值,THQ值分别为0.000 9、0.000 6、0.000 7、0.026 4、0.007 0、0.003 9和0.056 1。本研究中OCPs和PYRs残留的THQ值均远小于1,表明食用东北地区淡水养殖鱼类,在该污染物下暴露的人群无健康风险。按THQ值对检出的残留农药进行风险排序为:狄试剂>七氯>异狄氏剂>氯氰菊酯-Ⅲ>HCHs>六氯苯>DDTs。狄试剂、七氯、异狄氏剂、六氯苯、HCHs、DDTs虽已被禁用多年,但在环境中仍有残留,导致健康风险较高。草鱼、鲫和鲤的氯氰菊酯健康风险值得今后持续关注。

表5 OCPs残留风险评价Tab.5 Residual risk assessment of OCPs
3 结论
本研究考察了中国东北地区养殖淡水鱼体内OCPs和PYRs农药的残留情况,结果表明所调查鱼类中普遍存在两类农药残留问题。在监测的21种农药中,检出七氯、六氯苯、β-HCH、γ-HCH等12种农药,其中七氯(98.94%)、六氯苯(84.15%)和β-HCH(78.17%)检出率较高,氯氰菊酯-Ⅲ(19.13 μg/kg)和七氯(4.75 μg/kg)检出含量最高。p,p′-DDD、氯氰菊酯-Ⅰ、氰戊菊酯、溴氰菊酯、艾氏剂等8种农药未检出。OCPs和PYRs在不同种类鱼体中残留量不同,残留总量排序为:鲫>草鱼>鲤>鳙,检出含量在5.56~191.58 μg/kg之间,目标农药残留总量最高的为鲫,这可能与其食性和生活习性有关。消费者通过食用东北地区养殖淡水鱼摄入OCPs和PYRs的风险较低。按THQ值对检出农药进行风险排序为:狄试剂>七氯>异狄氏剂>氯氰菊酯-Ⅲ>HCHs>六氯苯> DDTs。氯氰菊酯的健康风险是今后值得关注的问题。

