急性温度胁迫对双带隐带丽鱼免疫指标及相关酶活性的影响
黄成裕,高世科,张家锐,王凌霄,张 硕,2,3
(1.上海海洋大学海洋科学学院,上海 201306;2.大洋渔业资源可持续开发省部共建教育部重点实验室,上海 201306;3.长江口水生生物监测与保护联合实验室,上海 201306)
酶是催化生物反应的一类特殊的蛋白质,生物体中的化学反应绝大部分都是在催化剂的作用下进行。酶的活性可以被调节,且与不同能量形式的转化密切相关。在酶系统中,超氧化物歧化酶(Superoxide dismutase,SOD)、过氧化氢酶(Catalase,CAT)、谷胱甘肽过氧化物酶(Glutathione peroxidase,GSH-PX)等抗氧化酶具有清除生物体活性氧自由基的功能,对增强细胞防御能力、提高生物体免疫力具有重要作用。而温度是影响抗氧化酶活性高低的重要因素之一,过高或过低的温度都会导致酶活性下降。因此,研究急性温度胁迫下抗氧化酶的变化,可以深入了解生物体对环境胁迫的响应。
双带隐带丽鱼()隶属于辐鳍鱼纲(Actinopterygii)鲈形目(Perciformes)丽鱼科(Cichlidae)。在我国,双带隐带丽鱼具有良好的商业价值,近年来随着生活水平的提高,越来越多人开始尝试饲养这一体型小、色彩艳丽的鱼种,但因其对繁殖和生长环境要求较高,尤其是对于温度等环境因子的适应性,国内未能形成规模化繁育,因此绝大部分商品鱼依靠进口,常因水质环境的不适导致较高的运输损耗,因此价格居高不下,阻碍了该鱼种在国内观赏鱼市场的普及和发展。作为变温动物的鱼类广泛栖息于不同的温度环境中,环境温度对其影响更加剧烈。当生存水域改变时,高温和低温环境下都会导致鱼类免疫力下降,容易生病甚至死亡。因此,环境温度直接影响到双带隐带丽鱼的生长和生存,并且双带隐带丽鱼的人工养殖过程也会经常出现因季节更替、气候变化及人为因素等原因导致水温出现节律性或突发性的温度骤变,从而对其造成一定程度的高温或低温胁迫影响。已有研究表明,丽鱼科鱼类的栖息水温在22~32 ℃之间,但目前尚无双带隐带丽鱼的急性温度胁迫和免疫应答及酶活性方面的研究。
本试验研究了双带隐带丽鱼在急性温度胁迫环境中的免疫相关酶活性变化,分析了急性温度胁迫对双带隐带丽鱼抗氧化及免疫指标活性的影响,以期为推动和加深双带隐带丽鱼的人工养殖技术,为优化双带隐带丽鱼的运输技术提供重要的参考依据,为后续深入研究双带隐带丽鱼对环境的适应性提供参考。
1 材料与方法
1.1 试验鱼及暂养条件
2021年4月于辽宁Apisto Family水族工作室购进规格为(3.0±0.3)cm、平均体重(1.5±0.5)g的双带隐带丽鱼500尾,随机挑选体质健壮、规格均匀、体表干净无病症且游动正常的150尾为试验对象。在规格为0.8 m×0.5 m×0.6 m的水槽中暂养1周。暂养条件设定为:水温为26 ℃,pH为7.50±0.15,溶解氧含量高于8 mg/L,暂养用水使用曝气过的自来水(充气暴晒3 d),每周换水1/5。暂养期间按每条双带隐带丽鱼体重的10%的投喂足量饲料,饲料采用小型慈鲷科专用饵料(德国莫斯特),投饵于早上8:00和晚上6:00进行,试验开始前24 h停止投喂。光照周期采用12L:12D。
1.2 试验设计
试验采用规格为0.3 m×0.3 m×0.3 m的方形玻璃水槽,水槽注入25 L预先曝气过的自来水,每组水槽放置恒温设备和气动式过滤。试验开始前将水槽遮光封闭处理,试验共三组,试验温度设置为20、26、32 ℃(由预实验可知,26 ℃为鱼体最佳生存温度,当双带隐带丽鱼处于22 ℃、30 ℃时,鱼体机能开始出现下降趋势,表现为行动力下降,日摄食率、日生长率均开始下降),其中20 ℃、32 ℃两组为试验组,26 ℃组为对照,试验开始后,将暂养的双带隐带丽鱼随机放入3个温度组各50尾,试验组匀速升/降温至32 ℃、20 ℃,对照组保持26 ℃水温,试验期间暂停投喂。本实验使用自动控温系统对各水槽升/降温,速率为1 ℃/h,直至达到试验目标温度保持1 d后以相同速率降/升温至26 ℃进行恢复培养,分别在升/降温试验前及试验后0 h、6 h、12 h、24 h、48 h、72 h进行采样,每次每组取6尾,三组共18尾,试验做2次重复。
1.3 样品采集与酶活指标测定
将双带隐带丽鱼称重后快速杀死后放入20 mL玻璃匀浆器,按比例加入预冷的0.65%生理盐水,冰浴匀浆制成10%的匀浆液,按照试剂盒说明进行离心取上清液,最后将其稀释成不同种酶测试所需的最适浓度,置于-20 ℃冰箱待测。
试验采用试剂盒(南京建成生物工程研究所)进行相关指标测定,包括免疫球蛋白M(IgM)测定、酸性磷酸酶(Acid phosphatase,ACP)、碱性磷酸酶(Alkaline phosphatase,ALP)、SOD、GSH、CAT、丙二醛(Malondialdehyde,MDA)和溶菌酶(Lysozyme,LZM)。其中,组织匀浆酶活性用U/g可溶性蛋白(prot)表示,个别酶含量单位以试剂盒为准。
1.4 统计分析
采用SPSS 25.0进行单因素方差分析,差异的显著性以<0.05为标准,所得数据以平均值±标准差(mean±SD)表示,运用Excel 2020绘制图表。
2 结果
2.1 急性温度胁迫对双带隐带丽鱼抗氧化指标的影响
2.1.1 ACP活性
温度胁迫下双带隐带丽鱼样品ACP活性的变化如图1所示,可以看出,随着时间的变化,在20 ℃和32 ℃处理组的ACP活性出现先下降后上升的趋势,26 ℃时各处理组间差异均不显著;20 ℃组在试验后0 h ACP含量最低,为0.009 3 U/gport;32 ℃组在胁迫6 h时ACP含量最低,为0.010 8 U/gport,20 ℃组ACP含量变幅较大。在所有温度组下,双带隐带丽鱼样品的ACP活性均在48 h后趋于平衡。
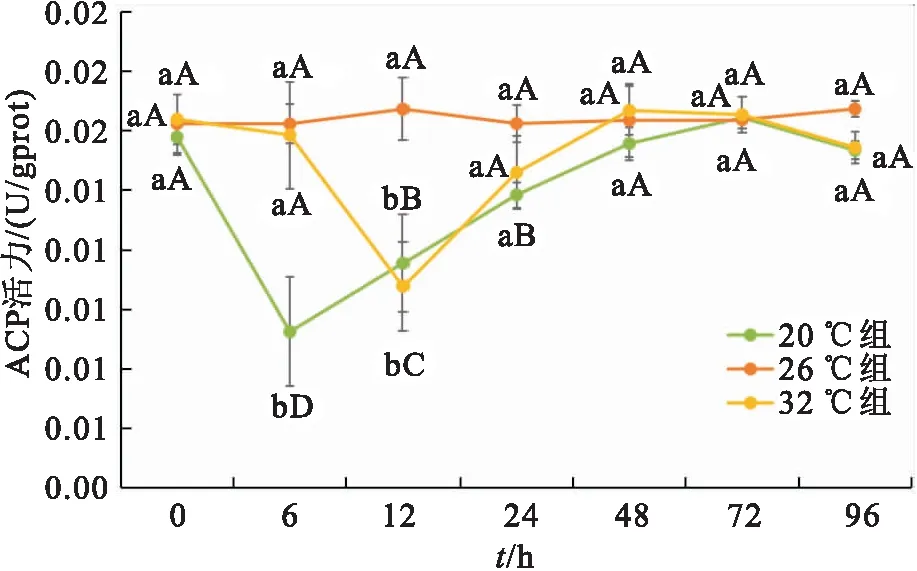
图1 急性温度胁迫下双带隐带丽鱼的ACP活性变化
2.1.2 ALP活性
温度胁迫下双带隐带丽鱼样品ALP活性的变化如图2所示。与ALP活性的变化趋势一致,在20 ℃和32 ℃处理组的ALP活性出现先下降后上升的趋势,26 ℃各处理组差异均不显著20 ℃组在试验后0 h ALP含量最低,为0.010 4 U/gport;32 ℃组则在胁迫6 h ALP含量最低,为0.003 8 U/gport,32 ℃组ALP变幅较大。但是,在刚开始实验阶段,20 ℃处理组的ALP活性的下降程度不如ACP活性。在所有温度组下,双带隐带丽鱼样品的ALP活性均在24 h后趋于平衡。

图2 急性温度胁迫下双带隐带丽鱼的ALP活性变化
2.1.3 CAT活性
温度胁迫下双带隐带丽鱼样品CAT活性的变化如图3所示。不同于ALP和ACP活性,CAT活性在20 ℃处理组出现先下降后上升再下降的趋势,在32 ℃处理组出现先下降后上升的趋势,26 ℃各处理组差异均不显著;20、32 ℃组CAT最低值均在胁迫6 h时出现,分别为0.329 4 U/gport、0.968 0 U/gport,32 ℃组恢复水平相对较差。而在所有温度组下,双带隐带丽鱼样品的CAT活性均是在48 h后趋于平衡。
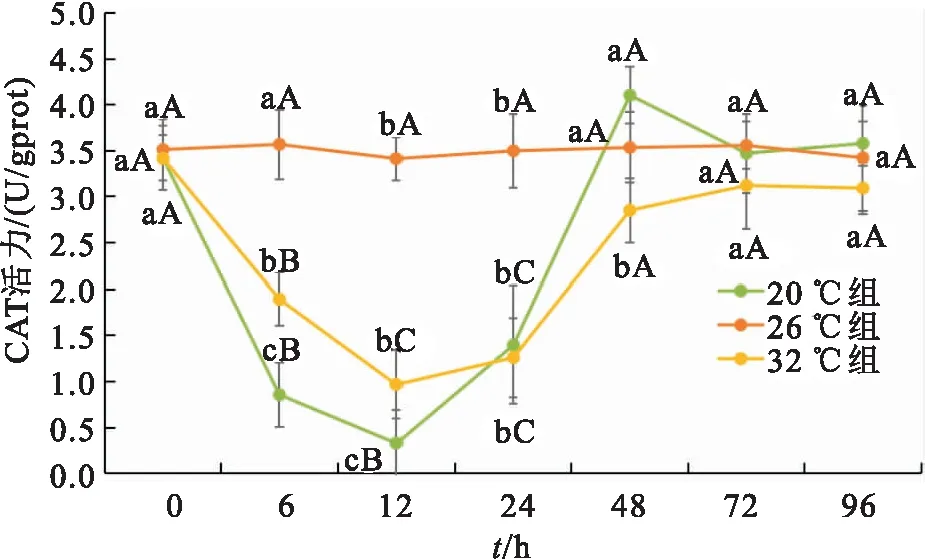
图3 急性温度胁迫下双带隐带丽鱼的CAT活性变化
2.1.4 SOD活性
温度胁迫下双带隐带丽鱼样品SOD活性的变化如图4所示。SOD活性在20 ℃处理组和32 ℃处理组的变化趋势一致,均是出现先下降后上升的趋势,26 ℃各处理组差异均不显著;试验后0 h、6 h、12 h时20 ℃与32 ℃ SOD含量较低。在所有温度组下,双带隐带丽鱼样品的SOD活性在48 h后趋于平衡,但均出现潜在上升的趋势。
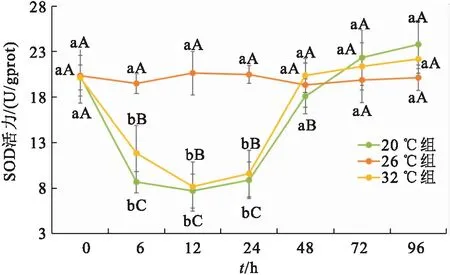
图4 急性温度胁迫下双带隐带丽鱼的SOD活性变化
2.1.5 GSH含量
温度胁迫下双带隐带丽鱼样品GSH含量的变化如图5所示。与MDA含量的变化趋势一致,GSH含量在20 ℃处理组和32 ℃处理组出现先上升到12 h达到最高值,而后出现下降的趋势;在26 ℃时,试验前后0 h及6~72 h GSH含量变化较为平缓,各处理组差异均不显著;在胁迫6 h后20 ℃与32 ℃组GSH含量均达到峰值且相近,分别为63.57 U/gport、60.42 U/gport,随后随时间逐步恢复。在所有温度组下,双带隐带丽鱼样品的GSH含量均可能在48 h甚至72 h后趋于平衡。
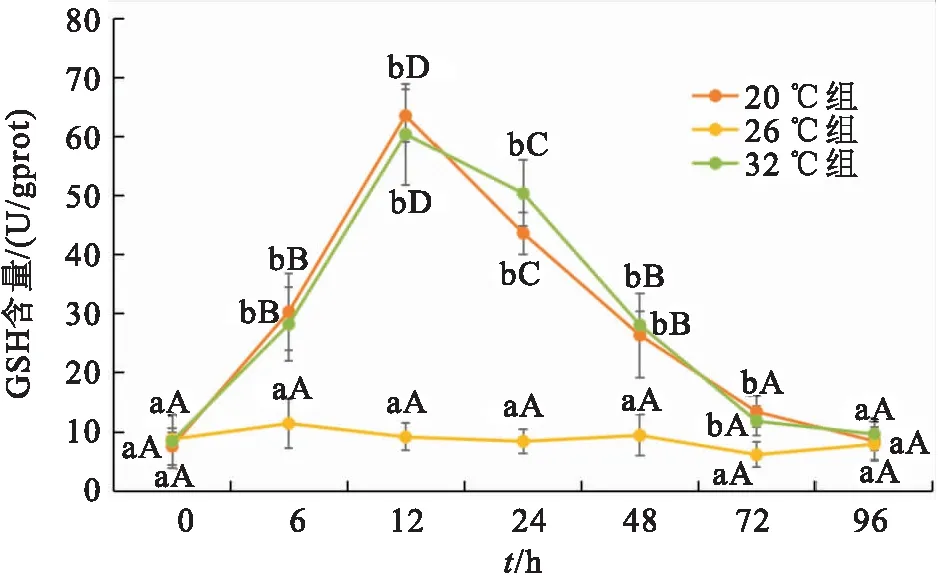
图5 急性温度胁迫下双带隐带丽鱼的GSH含量变化
2.1.6 MDA含量
温度胁迫下双带隐带丽鱼样品MDA含量的变化如图6所示。与酶活性的趋势不同,MDA含量在20 ℃处理组和32 ℃处理组出现胁迫6 h时先上升到达到最高值,而后出现下降的趋势,两温度组峰值分别为28.15 U/gport、23.16 U/gport;26 ℃各处理组差异均不显著。在所有温度组下,双带隐带丽鱼样品的MDA含量均是在48 h后趋于平衡。

图6 急性温度胁迫下双带隐带丽鱼的MDA含量变化
2.2 急性温度胁迫对双带隐带丽鱼免疫能力的影响
2.2.1 LZM活性
温度胁迫下双带隐带丽鱼样品LZM活性的变化如图7所示。与MDA含量的变化趋势一致,LZM活性在20 ℃处理组出现胁迫6 h时先上升到达到最高值而后下降的趋势,峰值为20.35 U/gport,在32 ℃处理组最高值出现在胁迫6 h时,然后呈下降的趋势,峰值为18.34 U/gport,26 ℃各处理组差异均不显著。在所有温度组下,LZM活性均是在24 h后趋于平衡。

图7 急性温度胁迫下双带隐带丽鱼的LZM活性变化
2.2.2 IgM含量
温度胁迫下双带隐带丽鱼样品IgM含量的变化如图8所示。在26 ℃处理组下,IgM含量随着时间的变化呈现上升趋势,而在20 ℃处理组和32 ℃处理组下IgM含量在胁迫温度达到目标温度后随时间呈先下降后上升的趋势。3个温度组的IgM含量随时间增加,IgM含量趋于集中,在48 h后均有上升趋势。

图8 急性温度胁迫下双带隐带丽鱼的IgM含量变化
3 讨论
3.1 急性温度胁迫对双带隐带丽鱼抗氧化指标的影响
温度与鱼类的各项生理活动密不可分,水温变化会对鱼类的行为、抗氧化防御系统和免疫系统等产生间接或直接影响。有研究表明水温的突变(骤增或骤降)对双带隐带丽鱼产生了较强的胁迫作用,打破了鱼体的内环境稳态,导致产生大量活性氧自由基(ROS),进而对鱼体造成一定程度的损伤。
SOD和CAT是抗氧化酶防御体系中非常重要的功能酶,联合起来拥有清除ROS的能力,其酶活性下降意味着机体清除ROS的能力下降。在本研究中,20 ℃处理组下SOD和CAT活性随时间的变化趋势与32 ℃处理组基本相同,且恢复至正常状态所需时间也基本一致,说明与正常温度的温差越大,对双带隐带丽鱼SOD和CAT活性的影响越大。强俊等在研究温度与盐度对吉富品系尼罗罗非鱼幼鱼生长和肝脏抗氧化酶活性的协同影响时发现,温度高于29 ℃时,吉富品系尼罗罗非鱼幼鱼SOD和CAT活性明显下降;在温度16 ℃时,SOD和CAT活性最低,与本研究结果一致。在试验后0-24 h这个阶段,20 ℃和32 ℃处理组的SOD和CAT活性显著低于26 ℃处理组,因此鱼体可以通过提高SOD和CAT活性来应对急性温度变化产生的应激反应对鱼体的影响。但是在12-24 h这个时间段中,32 ℃处理组的CAT活性上升的幅度比SOD活性更大,说明高温胁迫下双带隐带丽鱼体内的CAT活性调控机制可能比SOD活性更快速。
GSH是一种低分子自由基清除剂,是清除ROS非常重要的非酶抗氧化物质,其与SOD和CAT的作用机理一致,都是清除细胞中ROS和过氧化氢(HO)。在本实验双带隐带丽鱼在20 ℃和32 ℃处理组的GSH含量的变化趋势一致,说明高、低胁迫温度使得双带隐带丽鱼处于应激状态,机体产生越多的ROS,SOD和CAT活性会下降,使得底物GSH的含量上升,但与SOD和CAT活性的变化趋势不同点在于,GSH含量是在48h后才达到平衡。这可能是由于SOD将机体内产生的ROS分解成过多的HO,而CAT未完全将HO分解为氧分子和水,导致GSH作为底物继续被GSH-Px消耗,以此清除剩余的HO。
MDA是细胞膜脂质发生过氧化作用的产物之一,它能加剧细胞膜的损伤,反映组织细胞受ROS攻击的程度,从而间接反映机体抗氧化能力的强弱。尽管MDA在20 ℃和32 ℃处理组的GSH含量的变化趋势一致,但试验后6~24 h内,20 ℃处理组的MDA含量显著高于32 ℃处理组,说明低温胁迫对双带隐带丽鱼造成的氧化损伤高于高温胁迫,由此生成大量的SOD和CAT来抵抗过量的ROS。这与谢明媚等和管敏等的研究急性温度胁迫对银鲳()幼鱼和史氏鲟()幼鱼抗氧化和免疫指标中的MDA变化趋势均不同,这可能与鱼类的物种、年龄及应激时间等不同有关。
3.2 急性温度胁迫对双带隐带丽鱼磷酸酶活性的影响
ACP和ALP是两种参与免疫防御系统的重要水解酶,普遍存在于生物体内,可催化各种含磷化合物的水解过程,在生物体抵抗疾病、免疫反应和细胞损伤与修复过程中起着重要的作用。ACP和ALP活性的降低表明生物体可能在低温胁迫下机体生命代谢能力减弱或免疫调节功能下降。本研究中,随着胁迫温度的变化和时间的迁移,20 ℃和32 ℃处理组双带隐带丽鱼的ACP和ALP活性均呈现先降低后上升的趋势,这与白海文等研究温度对史氏鲟以及金一春等研究湿度对白斑狗鱼()免疫功能影响的变化趋势一致。这表明短时间内(24 h)的高温或低温胁迫会显著抑制双带隐带丽鱼体内的ACP和ALP活性,出现免疫疲劳,降低机体的免疫防御能力,而经过较长时间的高、低温胁迫,双带隐带丽鱼的ACP和ALP活性变化趋于与26 ℃处理组一致,说明双带隐带丽鱼很有可能通过调节机体的免疫防御能力,使其能够尽快适应这种极端的温度环境变化,但这是否对该种鱼类之后的行为、生理或代谢水平产生不良影响,有待进一步研究。
3.3 急性温度胁迫对双带隐带丽鱼免疫指标的影响
LZM是鱼体非常重要的免疫因子,它可以破坏革兰氏阳性菌细胞壁中的肽聚糖,从而瓦解细菌细胞,其活性与水温、盐度等环境因子密切相关。本研究中LZM活性在20 ℃和32 ℃处理组的变化趋势一致,但在试验后0~24 h内,20 ℃处理组的LZM活性显著高于32 ℃处理组,说明低温胁迫比高温胁迫更能促使双带隐带丽鱼产生更多的LZM,从而形成保护机制,对机体的免疫功能产生了显著的抑制作用。这与管敏等和童燕等的研究结果类似,即随着温度和盐度的增加,史氏鲟血清中的LZM活性先上升后下降。但是,这一保护机制也可能与鱼种以及胁迫强度有关,还有待进一步研究。
IgM是鱼体内一种重要的免疫球蛋白,是机体受抗原刺激后最先产生的抗体,其在血液中的含量是评价鱼体免疫应答反应的一项重要指标。本研究中,26 ℃组双带隐带丽鱼的IgM含量变化无规律性,但数值变动较大,可能是由于应激反应造成的结果,20 ℃、32 ℃组呈先降低后升高的趋势,且随时间变化,IgM含量趋于集中,20 ℃处理组的变化幅度更大一些,表明高温胁迫的作用较为明显,而低温胁迫可能会对双带隐带丽鱼的免疫功能产生抑制作用。这与谢明媚等、管敏等、何杰等的研究结果相同。
4 结论
本实验研究表明,高温或是低温胁迫下,双带隐带丽鱼的ACP、ALP、CAT和SOD显著降低,GSH、LZM和MDA含量显著增加,在恢复培养过程中逐步趋于与对照组相近,环境变动会影响鱼体的抗氧化防御系统和免疫机能。因此,在24 h之内,养殖过程中遇到急性温度变化时作出补救措施是着实有效的,运输过程中保持26 ℃左右的水温有助于保护鱼类的身体机能,避免造成不必要的经济损失。

