茶组植物新资源元宝山茶的毒理学安全性评价
陈涛林 陈美丽 葛智文 廖寅平 杨雪梅 王熙富 曾宏亮 李明丹 张征 罗军武
摘要:【目的】評价茶组植物新资源元宝山茶(Camellia yungkiangensis var. Yuanbaoshanica)的饮用安全性,为该资源的高效开发利用提供科学依据。【方法】以元宝山茶资源的鲜叶固定样和红茶工艺样为材料,参照食品毒理学安全性评价程序,通过经口急性毒性试验、小鼠骨髓细胞微核试验、Ames试验和慢性喂养(30 d)亚急性毒性试验对其毒理学安全性进行评价。【结果】元宝山茶具有较高的茶多酚、可溶性糖及可可碱含量,但咖啡碱和游离氨基酸含量相对较低。元宝山茶鲜叶固定样提取物对ICR小鼠的半数致死剂量(LD50)为5.123 g/kg,其红茶工艺样提取物对小鼠的LD50为7.573 g/kg;元宝山茶(红茶工艺样提取物)各剂量组在添加S9与不加S9时均未导致测试菌株(TA97a、TA98、TA100和TA102)出现致突变作用,即Ames试验结果呈阴性;在5.00 g/kg剂量(相当于人体推荐食用量的144倍)条件下,元宝山茶(红茶工艺样提取物)对小鼠骨髓细胞无明显毒性作用,表明小鼠骨髓细胞微核试验结果呈阴性。按0.87、1.74和3.47 g/kg的剂量经口灌胃红茶工艺样提取物给SD大鼠30 d,试验期间各剂量组大鼠的精神状态、行为活动、摄水、粪便、尿液及各腔道分泌物等均未见异常,也无大鼠死亡;其体重增重、摄食量、食物利用率、血液指标、血清生化指标、脏器湿重及脏/体比值等除个别指标与阴性对照组相比差异显著(P<0.05)或极显著(P<0.01)外,绝大部分指标均无明显的剂量—反应关系,且均在正常范围内波动;剖检观察及组织病理学检查也未发现元宝山茶对大鼠产生明显毒性意义的病理变化。【结论】元宝山茶属于典型的高茶多酚、高可溶性糖、高可可碱及低咖啡碱的特异性资源,且具有很高的饮用安全性,按食品毒理学安全性评价标准属于无毒级食品,作为代茶饮料植物具有广阔的应用前景。
关键词: 元宝山茶;茶组植物;毒理学安全性评价;茶多酚;半数致死剂量(LD50)
中图分类号: S571.1 文献标志码: A 文章编号:2095-1191(2022)02-0299-15
Toxicological safety evaluation of the new resource in Sect. Thea plant—Camellia yungkiangensis var. Yuanbaoshanica
CHEN Tao-lin CHEN Mei-li GE Zhi-wen LIAO Yin-ping YANG Xue-mei WANG Xi-fu ZENG Hong-liang LI Ming-dan ZHANG Zheng LUO Jun-wu
(1Tea College, Guizhou University, Guiyang 550025, China;2Key Laboratory of Ministry of Tea Science Education, Hunan Agricultural University, Changsha 410128, China;3Greening Construction Development Center of Liuzhou, Liuzhou, Guangxi 545001, China;4Agricultural Technology Extension Center of Liuzhou, Liuzhou, Guangxi 545003, China;5Agricultural and Rural Bureau of Rongshui County, Liuzhou, Guangxi 545300, China;6Forestry Research Institute of Liuzhou, Liuzhou, Guangxi 545300, China;7Institute of Chinese Medicine, Hunan Academy of Chinese Medicine, Changsha 410006;8Hunan Drug Safety Evaluation Research Center/Key Laboratory of Hunan Province
for Efficacy and Safety Evaluation of New Drugs, Liuyang, Hunan 410331, China)
Abstract:【Objective】To evaluate the drinking safety of the new resource—Camellia yungkiangensis var. Yuanbaoshanica in Sect. Thea plant, so as to provide scientific basis for the efficient development and utilization of the resource. 【Method】The fresh leaf fixed samples and black tea samples of the resource were used as materials, and the food toxicological safety evaluation program was taken as referenced to evaluate the toxicological safety of the resource through oral acute toxicity test, mouse bone marrow cell micronucleus test, Ames test and 30-day chronic feeding subacute toxicity test. 【Result】The results showed that C. yungkiangensis var. Yuanbaoshanica had high content of tea polyphenols, soluble sugar and theobromine, but relatively low content of caffeine and free amino acids. The median lethal dose (LD50) of the fresh leaf fixed sample extract of C. yungkiangensis var. Yuanbaoshanica to ICR mice was 5.123 g/kg. While the LD50of its black tea sample extract to mice was 7.573 g/kg. The addition of S9and no S9in each dose group of C. yungkiangensis var. Yuanbaoshanica (black tea sample extract) did not cause mutagenic effects on the test strain, indicating that the Ames test result was negative. And at a dose of 5.00 g/kg (equivalent to 144 times the recommended dosage of the human body), C. yungkiangensis var. Yuanbaoshanica (black tea sample extract) had no obvious toxic effect on mouse bone marrow cells, indicating that the results of the mouse bone marrow cell micronucleus test were negative. SD rats were given the tested samples (black tea sample extract) at doses of 0.87, 1.74 and 3.47 g/kg for 30 days through oral gavage. During the experiment, no abnormalities had been found in the mental state, behavioral activity, water intake, feces, urine and secretions of each cavity in each dose group, and no rats died. And the weight gain, food intake, food utilization, hematology index, blood biochemical indicators, wet weight of organs, organ-body ratio, etc. of the rats in each dose group were significantly different (P<0.05) or extremely significantly different (P<0.01) from that of the negative control group, but most of the indicators had no significant dose response relationship, and the values fluctuated within the normal range. Moreover, no pathological changes with significant toxic effects on rats were found through gross anatomical observation and histopathological examination.【Conclusion】C. yungkiangensis var. Yuanbaoshanica is a typical and specific resource with high content of tea polyphenols, soluble sugar, theobromine and low content of caffeine, with high drinking safety. According to the food toxicological safety evaluation standards, it belongs to the non-toxic food, with a prospect as a substitute tea beverage plant.
Key words:Camellia yungkiangensis var. Yuanbaoshanica; Sect. Thea plant; toxicological safety evaluation; tea polyphenols; median lethal dose (LD50)
Foundation items: Science and Technology Project of Guizhou Province(QKHZC〔2021〕General 188); Science and Technology Project of Guangxi Zhuang Autonomous Region(Guikegong 1598006-5-3); Talent Introduction Project of Guizhou University (GDRJHZ〔2019〕No.25); Hunan Provincial Postgraduate Research Innovation Project(CX2016 B284)
0 引言
【研究意义】食品毒理学安全性不仅是评价食品安全性的重要指标,还是认识和开发食品新资源的前提和基础(李宁,2007)。元宝山茶(Camellia yungkiangensis H. T. Chang var. Yuanbaoshanica Z. W. Ge,Y. P. Liao et T. L. Chen)是分布在广西融水县境内元宝山海拔1000 m以上区域的一种野生茶资源,被当地老百姓称为原生茶,其叶片光泽性强,芽叶茸毛较多,在叶片大小、叶形、叶色及育芽力等方面均明显区别于当地的其他茶树(C. sinensis)资源类型,经鉴定属于榕江茶(C. yungkiangensis H. T. Chang)的变种,是茶组植物的又一新资源(陈涛林,2019)。长期以来,当地老百姓和企业都习惯将元宝山茶制作成烘青类绿茶饮用,其成品茶汤色泽浅绿明亮,有清花香且香气持久,滋味鲜爽、醇厚、回甘明显。元宝山茶在品种选育及茶叶深加工等方面具有极高的开发潜力和利用价值,但至今未见关于其毒理学安全性评价的研究报道,严重制约着该资源的开发利用。因此,准确评价元宝山茶的毒理学安全性,对其高效开发利用具有重要意义。【前人研究进展】目前,已有较多有关代茶植物毒理学安全性评价的研究报道,包括沙棘Hippophae rhamnoides L.(胡颓子科Elaeagnaceae)(张小民等,2001)、显齿蛇葡萄(又名藤茶)Ampelopsis grossedentata (Hand.-Mazz.) W. T. Wang(葡萄科Vitaceae)(周月婵等,2001)、罗布麻Apocynum venetum L.(夹竹桃科Apocynaceae)(虞颖映和王海明,2006)、肋果茶Sladenia celastrifolia Kurz(肋果茶科Sladeniaceae)(杨卫等,2010)、苦茶槭Acer ginnala Maxim. subsp. theiferum (Fang) Fang(槭树科Aceraceae)(王海燕等,2011)、肉苁蓉Herba Cistanche(列当科Orobanchaceae肉苁蓉属Cistanche)(彭亮等,2011)、杜仲Eucommia ulmoides Oliver(杜仲科Eucommiaceae)(蔡铁全等,2016)、黄背勾儿茶(又名甜茶)Berchemia flavescens (Wall.) Brongn.(鼠李科Rhamnaceae)(欧春丽等,2017)等。山茶属(Camellia)植物中用作食品原料的物种相对较多,最常见的有油茶[C. oleifera Abel.]、茶[C. sinensis (L.) O. Kuntze]及其变种等(王治会等,2020;王春波等,2021),其毒理安全性研究主要集中在以茶为原料加工的各类茶叶产品上,且以黑茶类产品最多(郑子新等,2005;肖文军等,2007;吴文亮等,2017);也有少量关于油茶的安全性毒性研究(贾玉巧等,2005;龙正海等,2007)。除此之外,未见其他山茶属物种食用安全性毒理研究的相关报道。【本研究切入点】同一原料按不同加工工艺制成的不同茶叶产品,因所含成分发生不同转变,其毒理学安全性也有可能发生改变,但至今未见针对元宝山茶毒理学安全性评价的研究报道。【拟解决的关键问题】以元宝山茶资源的鲜叶固定样和红茶工艺样为材料,参照食品毒理学安全性评价程序,通过经口急性毒性试验、小鼠骨髓细胞微核试验、Ames试验和慢性喂养(30 d)亚急性毒性试验等对其毒理学安全性进行评价,以期为该资源的高效开发利用提供科学依据。
1 材料与方法
1. 1 试验材料
选取元宝山茶的鲜叶固定样和红茶工艺样为受试材料。采集无病虫害的标准一芽二叶嫩梢,红茶工艺样按鲜叶→萎凋→揉捻→发酵→初烘→摊凉→复烘→摊凉的工艺进行加工;鲜叶固定样采用蒸青固样法进行固样,具体操作方法:将采集的新鲜嫩叶置于煮沸的蒸锅上,利用蒸汽进行快速杀青,以叶色变暗、嫩茎折而不断为宜,时间90~120 s;将杀青后的鲜叶摊凉至室温后置于75 ℃烘箱中烘至足干,-20 ℃保存备用。取上述红茶工艺样6000 g和鲜叶固定样500 g,以沸水按料液比1∶10(g/v)浸提3次,合并3次浸提的茶汤,真空浓缩后冷冻干燥,得到提取物干粉1786 g(红茶工艺样)和192 g(鲜叶固定样),提取率分别为29.8%(红茶工艺样)和38.4%(鲜叶固定样)。SPF级ICR小鼠和SD大鼠均购自湖南斯莱克景达实验动物有限公司,实验动物生产许可证号SCXK(湘)2016-0002;饲养于湖南省实验动物中心(湖南省药物安全评价研究中心)SPF级屏障环境中,光照周期为12 h明暗交替,室温20.0~26.0 ℃,相对湿度40%~70%。鼠饲料购自北京科澳协力饲料有限公司,饲料生产许可证号SCXK(京)2014-0010;饮水由纯水仪(BIOPURE300型中央供水系統)制备。
1. 2 供试样品常规化学成分测定
水分测定参照国家标准GB/T 8304—2013《茶 水分测定》,水浸出物含量测定参照国家标准GB/T 8305—2013《茶 水浸出物测定》,茶多酚含量测定参照国家标准GB/T 8313—2008《茶叶中茶多酚和儿茶素类含量的检测方法》,游离氨基酸总量测定参照国家标准GB/T 8314—2013《茶 游离氨基酸总量的测定》,黄酮类物质含量测定采用三氯化铝比色法(马陶陶等,2008;蒋睿等,2018),可溶性糖含量测定采用硫酸—蒽酮比色法(魏晓明等,2000;王治会等,2020)。生物碱含量测定采用HPLC法,色谱柱:ECOSIL C18 4.6×150 mm 5 μm C/N EC181546 S/N 4I7501-11;流动相:A相为超纯水,B相为N,N-二甲基甲酰胺∶甲醇∶冰醋酸=39.5∶2∶1.5(v/v/v);检测波长:278 nm;柱温:30.0 ℃;流速:1 mL/min;进样体积:10 μL;梯度洗脱程序如表1所示。
1. 3 试验设计依据及动物伦理保护
根据《保健食品检验与评价技术规范》(2003年版)的小鼠急性毒性试验和30 d喂养检验方法及保健食品安全性毒理学评价的目的和结果判定,采用半数致死量法进行元宝山茶(鲜叶固定样提取物和红茶工艺样提取物)的急性毒性试验;并以受试样品日推荐摄入量的100倍作为30 d喂养高剂量组的给样剂量,综合小鼠急性毒性试验结果,设定小鼠骨髓细胞微核试验最高剂量为5.00 g/kg。动物毒性试验经湖南省实验动物中心实验动物管理(伦理)委员会审查、批准后实施,完全按照国家相关实验动物福利法规执行,实验动物使用许可证号SYXK(湘)2015-0016
1. 4 试验分组及剂量设计
1. 4. 1 小鼠急性毒性试验 选用检疫合格的4~6周龄SPF级ICR小鼠60只,雌雄各半,禁食不禁水16 h后的体重范围为17.6~22.3 g,平均体重19.8 g,按性别体重随机分为6个剂量组,每组10只,雌雄各半,各剂量组小鼠分别按12.00、7.90、5.20、3.40、2.30和1.50 g/kg经口灌胃元宝山茶(鲜叶固定样提取物)。同时选取50只检疫合格的4~6周龄SPF级ICR小鼠,按性别体重随机分为5个剂量组,每组10只,雌雄各半,然后按12.00、10.00、8.00、6.00和4.00 g/kg的剂量分别经口灌胃元宝山茶(红茶工艺样提取物)。各剂量组均灌胃2次,间隔4 h。
1. 4. 2 Ames试验 采用平板掺入法,选用经鉴定符合要求的组氨酸缺陷型鼠伤寒沙门氏菌TA97a、TA98、TA100和TA102菌株进行试验,以多氯联苯(PCB)诱导的SD大鼠肝微粒体酶(S9)作为体外代谢活化系统。试验设2个剂量,分别为5000和1000 g/皿,同时设自发回变对照、溶剂对照和阳性诱变剂对照。样品配制时精确称取受试样品(红茶工艺样提取物)1.25 g加DMSO(二甲基亚砜)定容至25.0 mL,其浓度为50 mg/mL,以此为原液;量取5.0 mL原液加DMSO定容至25.0 mL,配制成10 mg/mL的样品液,高压灭菌(0.105 MPa,20 min)后以无菌DMSO补足溶液量备用。试验时于顶层琼脂培养基中依次加入0.1 mL受试样品液、0.1 mL试验菌株增菌液和0.5 mL磷酸盐缓冲液或S9混合液(代谢活化),混匀后迅速倾入底层琼脂培养基上,转动培养基使之分布均匀,水平放置待冷凝固化后,置于37 ℃培养箱中倒置培养48 h。
1. 4. 3 小鼠骨髓细胞微核试验 采用间隔24 h的2次经口灌胃法,选用检疫合格的SPF级ICR小鼠30只(体重范围24.6~29.2 g),按性别体重随机分为3组,每组10只,雌雄各半。元宝山茶(红茶工艺样提取物)剂量设为5.00 g/kg,相当于人体推荐食用量的144倍,以纯化水为阴性对照,40 mg/kg环磷酰胺为阳性对照。每次灌胃前按剂量设计称取相应红茶工艺样提取物,加纯化水配制成0.25 g/mL的受试样品液,并按20.0 mL/kg的剂量灌胃;环磷酰胺用生理盐水配制成4 mg/mL,按10.0 mL/kg腹腔注射给样。第2次给样6 h后颈椎脱臼处死小鼠,快速采集两侧股骨,取骨髓液用大鼠血清稀释后推片,甲醇固定5 min,姬姆萨染色液染色20 min,纯水冲洗,自然干燥后采用双盲法阅片。
1. 4. 4 30 d喂养试验 选用检疫合格的SPF级SD大鼠80只(体重范围74.5~88.4 g),按性别体重随机分为阴性对照组和红茶工艺样提取物低、中、高剂量组,每组20只,雌雄各半。受试样品低、中、高剂量分别设为0.87、1.74和3.47 g/kg,相当于人体推荐食用量的25、50和100倍。根据体重变化,试验前称取相应受试样品加纯化水配制成0.347 g/mL的受試样品液(高剂量),按剂量倍数逐级稀释配制成中剂量(0.174 g/mL)和低剂量(0.087 g/mL)受试样品液,按10.0 mL/kg的剂量灌胃,阴性对照组灌胃等体积纯化水,每天1次,连续灌胃30 d。
1. 5 检测指标及方法
1. 5. 1 小鼠急性毒性试验 给样后4 h内仔细观察并记录各剂量组小鼠是否出现毒性反应、毒性反应症状、症状出现时间及死亡情况等,连续观察14 d,记录小鼠死亡情况及其体重变化。于给样后第14 d颈椎脱臼处死存活的小鼠,进行解剖观察,肉眼检查是否存在明显病理变化;并以SPSS 22.0统计半数致死剂量(LD50)。
1. 5. 2 小鼠骨髓细胞微核试验 光学显微镜下,每只小鼠计数1000个嗜多染红细胞(PCE),微核发生率以含有微核的PCE千分率计;统计含200个PCE视野内的成熟红细胞数(RBC),然后计算PCE/RBC比值。
1. 5. 3 Ames试验 每个剂量设3个平行皿,计数每皿回变菌落数。若受试样品的回变菌落数超过自发回变菌落数的2倍以上,且存在剂量—反应关系,即判定该受试样品诱变试验结果呈阳性。整套试验在相同条件下重复1次。
1. 5. 4 30 d喂养试验 试验期间所有SD大鼠单笼饲养,自由摄食饮水,每天观察并记录大鼠的一般表现、行为活动及生长情况,每周称重1次,加食2次,记录加食量、撒食量和剩余量,计算摄食量及食物利用率。喂养30 d后禁食不禁水16 h采血,禁食前和禁食后(采血前)称量大鼠体重;按5 mL/kg腹腔注射20%乌来糖(乌拉坦)麻醉后腹主动脉采血,抗凝血采用BC-5000Vet兽用五分类血液细胞分析仪测定血红蛋白(HGB)、红细胞容积(HCT)、红细胞计数(RBC)、血小板(PLT)、白细胞计数(WBC)及WBC五分类;非抗凝血分离血清,以LABOSPECT003型自动生化分析仪测定谷丙转氨酶(ALT)、谷草转氨酶(AST)、白蛋白(ALB)、总蛋白(TP)、总胆红素(TbiL)、肌酐(Cre)、尿素氮(BUN)、血糖(Glc)和總胆固醇(TC)。剪断腹主动脉放血处死大鼠,解剖观察并称取肝脏、肾脏、脾脏和睾丸的湿重,计算脏/体比值;取肝脏、肾脏、脾脏、胃、十二指肠、结肠、卵巢及睾丸等脏器进行组织病理学检查。根据剖检观察结果及血液生化学指标检测结果等判断是否需要对受试样品中、低剂量组进行组织病理学检查。若无异常情况,仅对受试样品高剂量组和阴性对照组进行组织病理学检查;如果发现病变则需对中、低剂量组大鼠相应器官及组织进行检查。
1. 6 统计分析
试验数据采用SPSS 22.0进行统计分析。采用Levens Test检验方差齐性,若无统计学意义(P>0.05),则以单因素方差分析(One-way ANOVA)进行统计分析,当单因素方差分析具有统计学意义(P<0.05),运用LSD-t或Dunnett-t检验进行比较分析;若方差不齐(P<0.05)则对原始数据进行适当的变量转换,满足方差齐性后,再以转换后的数据进行统计分析;若数据进行变量转换后仍未达方差齐性,则采用Tamhanes T2进行统计分析。
2 结果与分析
2. 1 供试样品的常规化学成分测定结果
为准确认识和了解元宝山茶的化学成分及含量情况,本研究对2个供试样品的常规化学成分进行测定,结果显示,元宝山茶鲜叶固定样的水浸出物、茶多酚、游离氨基酸、可溶性糖、黄酮、可可碱、咖啡碱含量分别为(47.37±0.08)%、(31.33±0.44)%、(1.17±0.16)%、(10.96±0.59)%、(0.41±0.02)%、(2.84±0.12)%和(0.39±0.01)%,元宝山茶红茶工艺样的水浸出物、茶多酚、游离氨基酸、可溶性糖、黄酮、可可碱、咖啡碱含量分别为(41.18±0.13)%、(22.08±0.52)%、(1.55±0.18)%、(6.30±0.39)%、(1.35±0.05)%、(3.98±0.20)%和(0.20±0.01)%。总体而言,元宝山茶含有较高的茶多酚、可溶性糖及可可碱,但咖啡碱和游离氨基酸含量相对较低。
2. 2 小鼠急性经口毒性试验结果
2. 2. 1 一般临床观察 鲜叶固定样提取物:灌胃当天4 h内,12.00和7.90 g/kg剂量组小鼠均出现身体蜷缩、活动减少及闭眼等临床症状,5.20和3.40 g/kg剂量组有部分小鼠出现身体蜷缩、活动减少及闭眼等临床症状,2.30和1.50 g/kg剂量组小鼠行为未见异常;各剂量组小鼠均未出现死亡。灌胃次日,12.00和7.90 g/kg剂量组雌性和雄性小鼠全部死亡,5.20 g/kg剂量组有4只(1只雌性和3只雄性)小鼠死亡,3.40 g/kg剂量组有1只雄性小鼠死亡,2.30和1.50 g/kg剂量组小鼠均未出现死亡。剖检死亡小鼠,肉眼观察其胸腔内未见积液,也未发现器官异常现象。
红茶工艺样提取物:灌胃当天4 h内,12.00、10.00和8.00 g/kg剂量组小鼠出现身体蜷缩、活动减少及闭眼等临床症状,6.00 g/kg剂量组部分小鼠呈现身体蜷缩、活动减少等现象,4.00 g/kg剂量组小鼠行为未见异常。灌胃次日,12.00 g/kg剂量组有9只(5只雌性和4只雄性)小鼠死亡,10.00 g/kg剂量组也有9只(4只雌性和5只雄性)小鼠死亡,8.00 g/kg剂量组有6只(3只雌性和3只雄性)小鼠死亡,6.00 g/kg剂量组有2只(1只雌性和1只雄性)小鼠死亡,4.00 g/kg剂量组雌性和雄性小鼠均无死亡;剖检死亡小鼠,肉眼观察其胸腔内未见积液,也未发现器官异常现象。
2. 2. 2 动物体重 如表2所示,鲜叶固定样提取物3.40、2.30和1.50 g/kg剂量组存活小鼠的体重变化均在正常范围内,红茶工艺样提取物4.00 g/kg剂量组存活小鼠的体重变化也在正常范围内。
2. 2. 3 剖检观察 最后1次观察结束后,颈椎脱臼处死所有存活小鼠并进行剖检,肉眼观察脏器的位置、大小、色泽、粘连、表面和切面质地等,均未见积液或肿瘤等异常病变。
2. 2. 4 半数致死剂量(LD50) 如表3所示,鲜叶固定样提取物对小鼠的LD50为5.123 g/kg,其中对雌性小鼠的LD50为5.842 g/kg、对雄性小鼠的LD50为4.555 g/kg;红茶工艺样提取物对小鼠的LD50为7.573 g/kg,其中对雌性小鼠的LD50为7.574 g/kg、对雄性小鼠的LD50为7.570 g/kg。
2. 3 Ames试验结果
2. 3. 1 测试菌株遗传特性鉴定 TA97a、TA98、TA100和TA102等4株测试菌株均具有组氨酸缺陷、脂多糖屏障缺陷(Rfa突变)及氨苄青霉素抗性(R因子),TA102菌株还携带有四环素抗性(PAQL因子),TA97a、TA98和TA100菌株则具有uvrB修复突变(紫外线敏感)。4株测试菌株的自发回变率均在正常范围内,表明其符合Ames试验要求。各菌株遗传特性鉴定结果详见表4。
2. 3. 2 Ames试验 如表5所示,受试样品各剂量组对TA97a、TA98、TA100和TA102等4株测试菌株在非活化(?S9)与活化(+S9)条件下的回变菌落数均未超过自发回变菌落数的2倍,也不存在剂量—反应关系;2次重复试验结果均一致。可见,元宝山茶(红茶工艺样提取物)各剂量组在添加S9与不加S9时均未出现致突变作用,Ames试验结果呈阴性。
2. 4 小鼠骨髓细胞微核试验结果
由表6可知,受试样品组小鼠骨髓细胞微核率与阴性对照组相比无显著差异(P>0.05,下同),而阳性对照组与阴性对照组间存在极显著差异(P<0.01,下同);受试样品组小鼠的PCE/RBC比值未低于阴性对照组的20%,表明在5.00 g/kg剂量(相当于人体推荐食用量的144倍)条件下,元宝山茶(红茶工艺样提取物)对小鼠骨髓细胞无明显毒性作用,小鼠骨髓细胞微核试验结果呈阴性。
2. 5 30 d喂养试验结果
2. 5. 1 一般临床观察 试验期间,各处理组SD大鼠的精神状态、行为活动、摄水、粪便、尿液及各腔道分泌物等均未见异常,也无大鼠死亡。
2. 5. 2 对大鼠体重及食物利用率的影响 如表7所示,受试样品各剂量组雌性大鼠各称重时间点的体重与阴性对照组相比均无显著差异;低、中剂量组雄性大鼠各称重时间点的体重与阴性对照组相比也无显著差异,但高剂量组雄性大鼠在第14 d后其体重极显著或显著(P<0.05,下同)低于阴性对照组。
由图1可看出,除第1周中、高剂量组雌性大鼠摄食量呈极显著下降趋势,第3周高剂量组雌性大鼠摄食量显著升高外,其他时间点的摄食量与阴性对照组相比均无显著差异,且各剂量组雌性大鼠的体重增重和食物利用率与阴性对照组间也无显著差异;对于雄性大鼠而言,第2周高剂量组的摄食量和体重增重极显著低于阴性对照组、食物利用率则显著低于阴性对照组,第4周高剂量组的摄食量极显著低于阴性对照组、体重增重和食物利用率则显著低于阴性对照组。此外,雌性大鼠的总摄食量、体重总增重及总食物利用率与阴性对照组相比差异均不显著;高剂量组雄性大鼠的总摄食量及体重总增重极显著低于阴性对照组,而低、中剂量组雄性大鼠的总摄食量、体重总增重及总食物利用率与阴性对照组相比也无显著差异。
2. 5. 3 对大鼠血液指标的影响 如表8所示,除低剂量组雌性大鼠的酸性粒细胞、中劑量组雌性大鼠的嗜碱性粒细胞及高剂量组雄性大鼠的红细胞、血红蛋白浓度和红细胞压积与阴性对照组相比差异显著或极显著外,其余各剂量组雌、雄性大鼠的各项血液学指标与阴性对照组间均无显著差异。
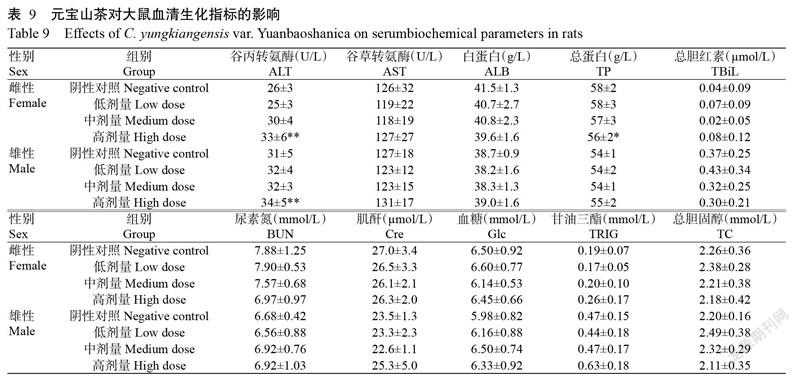
2. 5. 4 对大鼠血清生化指标的影响 与阴性对照组相比,除高剂量组雌、雄性大鼠的血清谷丙转氨酶活性极显著升高,高剂量组雌性大鼠的血清总蛋白含量显著降低外,其余各剂量组雌、雄性大鼠的各项血清生化指标均无显著变化(表9)。
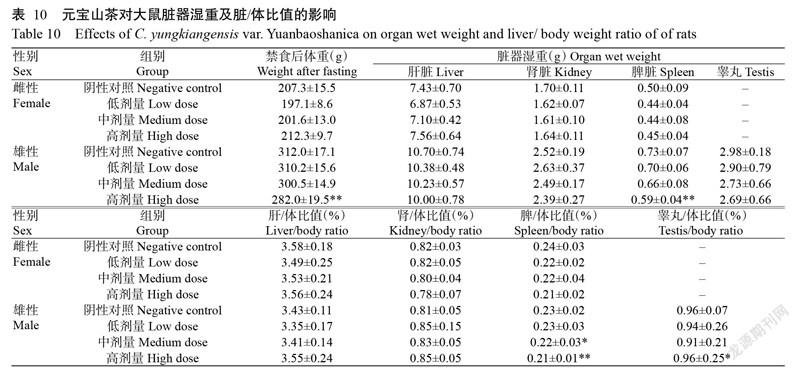
2. 5. 5 对大鼠脏器湿重及脏/体比值的影响 由表10可看出,除高剂量组雄性大鼠禁食后的体重、脾脏湿重及脾/体比值较阴性对照组极显著降低,中剂量雄性大鼠禁食后的脾/体比值、高剂量组雄性大鼠禁食后的睾丸/体比值与阴性对照组间存在显著差异外;其余各剂量组雌、雄性大鼠禁食后的脏器湿重及脏/体比值与阴性对照组相比均无显著差异。
2. 5. 6 剖检观察及组织病理学检查结果 剖检各处理组的大鼠共80只,肉眼观察大鼠胸腔和腹腔内均无积液、异物及肿瘤,各脏器的解剖学位置正常,肝脏、脾脏、胃、十二指肠、结肠、肾脏、睾丸(卵巢)及唾液腺等主要脏器的颜色、形态、结构、体积及质地等均未见明显的异常病变。组织病理学镜检发现:①肝脏:阴性对照组1F06、1M06和1M07号大鼠的肝细胞空泡变性(+),1M06和1M07号大鼠肝细胞小灶性坏死,伴有纤维细胞增生(+),其他大鼠肝脏均未见明显病理变化;高剂量组4F04、4F10和4M10号大鼠的肝细胞空泡变性(+),4F08和4M02号大鼠肝细胞小灶性坏死,伴有纤维细胞增生(+),其他大鼠的肝细胞索排列有序,肝细胞未见变性、坏死,肝窦未见淤血等病理变化(图2)。②肾脏:阴性对照组及高剂量组大鼠肾脏皮质、髓质结构清晰,肾单位形态结构正常,间质未见炎症细胞浸润(图3)。③脾脏:阴性对照组及高剂量组大鼠脾脏的白髓、红髓结构清楚,未见淤血及纤维组织增生(图4)。④胃:阴性对照组及高剂量组大鼠的胃黏膜完整,黏膜下层未见水肿、血管充血及炎细胞浸润(图5)。⑤十二指肠:阴性对照组及高剂量组大鼠十二指肠黏膜完整,黏膜未见糜烂、溃疡及炎症细胞浸润,黏膜下层未见水肿、血管充血及炎症细胞浸润(图6)。⑦结肠:阴性对照组及高剂量组大鼠结肠黏膜上皮结构完整,可见大量杯状细胞,间质未见充血、水肿及炎症细胞浸润(图7)。⑧卵巢:阴性对照组及高剂量组雌性大鼠卵巢各级卵泡形态结构清楚,未见变性坏死,间质未见出血及炎症细胞浸润(图8)。⑨睾丸:阴性对照组及高剂量组雄性大鼠睾丸曲细精管内不同发育阶段的生精细胞排列清楚、形态正常,间质未见炎症细胞浸润(图9)。由此判定,以元宝山茶红茶工艺样提取物喂养SD大鼠30 d未见有明显毒性意义的病理变化。
3 讨论
本研究对元宝山茶(鲜叶固定样和红茶工艺样)水提物的毒理学安全性评价结果显示,鲜叶固定样提取物对小鼠的LD50为5.123 g/kg,红茶工艺样提取物对小鼠的LD50为7.573 g/kg。根据世界卫生组织(WHO)颁布的食品毒性分级标准(付立杰,2001),2种水提物样品的LD50均大于5000 mg/kg,因此可判定元宝山茶鲜叶固定样和红茶工艺样的水提物均为实际无毒。根据样品水提物提取率换算可知,元宝山茶鲜叶固定样和红茶工艺样干茶对小鼠的LD50分别为13.341和25.413 g/kg,明显高于以茶(C. sinensis)或其变种鲜叶为原料加工而成的烘青绿茶(LD50为7.5 g/kg)(刘勤晋等,2003)、普洱茶(LD5012.2 g/kg)(刘勤晋等,2003)及六堡茶(LD50为9.38 g/kg)(吴文亮等,2017)等,说明元宝山茶具有更高的饮用安全性;根据食品毒性分级标准,与沙棘茶(张小民等,2001)、藤茶(周月婵等,2001;陈玉琼等,2005)、罗布麻茶(虞颖映和王海明,2006)、肉苁蓉茶(彭亮等,2011)及杜仲茶(蔡铁全等,2016)等代茶饮料植物均属于实际无毒或无毒物。在小鼠急性经口灌胃毒性试验中,高剂量的元宝山茶鲜叶固定样提取物和红茶工艺样提取物均导致小鼠死亡,究其原因可能是元宝山茶含有较高浓度的茶多酚所引起。杨贤强等(1992)、宋小鸽等(1999)、陆益等(2005)、袁根良等(2015)先后研究报道了茶多酚的急性经口毒性LD50,分别为2496、2499、2640和2710 mg/kg。在本研究中,元宝山茶鲜叶固定样提取物和红茶工艺样提取物在LD50灌胃剂量下对应的茶多酚剂量分别为4180和5611 mg/kg,已远高于茶多酚的LD50,因此推断小鼠死亡的原因与高剂量的茶多酚中毒有关。
此外,Ames试验和小鼠骨髓细胞微核试驗结果均呈阴性。按0.87、1.74和3.47 g/kg的剂量经口灌胃元宝山茶红茶工艺样提取物给大鼠30 d,试验期间各剂量组大鼠的体重增重、摄食量、食物利用率、血液指标、血清生化指标、脏器湿重及脏/体比值等除个别指标与阴性对照组相比差异显著或极显著外,绝大部分指标均无明显的剂量—反应关系,且均在正常范围内波动。剖检观察及组织病理学检查也未发现以元宝山茶红茶工艺样提取物灌胃30 d对大鼠产生明显毒性意义的病理变化。可见,元宝山茶鲜叶固定样和红茶工艺样的水提物均无致突变作用,对哺乳类动物的体细胞染色体也无损伤作用,且对大鼠的生长发育、造血功能和各脏器组织无明显毒性,进一步说明元宝山茶具有较高的饮用安全性。但值得注意的是,任何食物达到一定剂量均有可能致死,本研究的30 d喂养试验高剂量组的剂量已达人体日常推荐饮用量(7 g/d)的100倍,正常情况下也不可能达到该饮用剂量。因此,按照食品毒理学安全性评价标准可判定元宝山茶属于无毒级食品。
元宝山茶不仅具有高含量的茶多酚,还富含可溶性糖和可可碱,鲜叶固定样的可溶性糖含量高达(10.96±0.59)%,红茶工艺样的可可碱含量高达(3.98±0.20)%,远高于常规茶树品种资源。其中,可可碱含量远高于李金(2013)测定的25个茶树品种的可可碱含量(0.04%~0.34%),但咖啡碱含量较常规茶树品种资源低,远低于李金(2013)对25个茶树品种的测定结果(2.74%~5.28%),也远低于李文萃等(2020)对以鸠坑种为原料加工绿茶的测定结果(2.6%~2.7%)及宋加艳等(2021)对碧香早鲜叶原料的测定结果(3.67%)。这也充分说明元宝山茶属于典型的高茶多酚、高可溶性糖、高可可碱及低咖啡碱的特异性资源,具有广阔的应用前景。
4 结论
元宝山茶属于典型的高茶多酚、高可溶性糖、高可可碱及低咖啡碱的特异性资源,且具有很高的饮用安全性,按食品毒理学安全性评价标准属于无毒级食品,作为代茶饮料植物具有广阔的应用前景。
参考文献:
蔡铁全,马伟,曾里,程健,胡坚,曾凡骏. 2016. 杜仲茶的安全毒理学评价[J]. 公共卫生与预防医学,27(6):9-12. [Cai T Q,Ma W,Zeng L,Cheng J,Hu J,Zeng F J. 2016. Study on safety toxicology evaluation of Eucommia tea[J]. Journal of Public Health and Preventive Medi-cine,27(6):9-12.]
陈涛林. 2019. 广西元宝山一种特异茶饮植物的系统学鉴定与综合评价研究[D]. 长沙:湖南农业大学. [Chen T L. 2019. Systematic identification and comprehensive evalua-tion research on a specific tea plant of Yuanbao Mountain in Guangxi[D]. Changsha:Hunan Agricultural University.] doi:10.27136/d.cnki.ghunu.2019.000444.
陈玉琼,向班贵,倪德江,吴谋成,周继荣,余志,曾维超. 2005. 恩施富硒藤茶安全性毒理学实验研究[J]. 茶叶科学,25(4):295-299. [Chen Y Q,Xiang B G,Ni D J,Wu M C,Zhou J R,Yu Z,Zeng W C. 2005. Study on the toxi-cology of Se-enriching Ampelopsis grossedentata from Enshi[J]. Journal of Tea Science,25(4):295-299.] doi:10.3969/j.issn.1000-369X.2005.04.010.
付立杰. 2001. 现代毒理学及其应用[M]. 上海:上海科学技术出版社. [Fu L J. 2001. Modern toxicology and its applications[M]. Shanghai:Shanghai Scientific &Technical Publishers.]
贾玉巧,杨东伟,赵晓红. 2005. 茶油遗传毒性的评价[J]. 北京联合大学学报(自然科学版),19(3):66-68. [Jia Y Q,Yang D W,Zhao X H. 2005. The assessment of the genetic toxicity of tea oil[J]. Journal of Beijing Union University (Natural Sciences),19(3):66-68.] doi:10.3969/j.issn.1005-0310.2005.03.016.
蒋睿,罗理勇,常睿,曾亮. 2018. 普洱生茶和熟茶的品质化学成分分析比较[J]. 西南大学学报(自然科学版),40(6):38-47. [Jiang R,Luo L Y,Chang R,Zeng L. 2018. Comparative analysis of quality-related chemical components of raw Pu-erh tea and ripe Pu-erh tea[J]. Journal of Southwest University(Natural Science),40(6):38-47.] doi:10.13718/j.cnki.xdzk.2018.06.006.
李金. 2013. 茶树咖啡碱与可可碱含量、关键酶基因表达量及cSNP相关性分析[D]. 合肥:安徽农业大学. [Li J. 2013. A correlation study of caffeine contents with theobromine contents,transcriptional expression and cSNP of key enzyme genes in tea plants[D]. Hefei:Anhui Agricultural University.]
李宁. 2007. 国内食品安全性毒理学评价的现状和发展[J]. 毒理学杂志,21(5):368-370. [Li N. 2007. Current situation and development of toxicological evaluation of food safety in China[J]. Journal of Toxicology,21(5):368-370.] doi:10.3969/j.issn.1002-3127.2007.05.008.
李文萃,高华峰,范起业,王家鹏,唐小林. 2020. 不同炒干条件下夏季日照绿茶的品质变化及香气成分比较[J]. 现代食品科技,36(11):255-262. [Li W C,Gao H F,Fan Q Y,Wang J P,Tang X L. 2020. Comparison of the qua-lity and aroma components of Rizhao green tea harvested in summer dried under different roasting conditions[J]. Modern Food Science and Technology,36(11):255-262.] doi:10.13982/j.mfst.1673-9078.2020.11.0495.
刘勤晋,陈文品,白文祥,李清泽. 2003. 普洱茶急性毒性安全性评价研究报告[J]. 茶叶科学,23(2):141-145. [Liu Q J,Chen W P,Bai W X,Li Q Z. 2003. Acute toxicity eva-luation of Puer tea[J]. Journal of Tea Science,23(2):141-145.] doi:10.3969/j.issn.1000-369X.2003.02.011.
龙正海,杨再昌,杨雄志. 2007. 油茶树嫩枝挥发油皮肤毒理及其促透作用研究[J]. 中国中药杂志,32(17):1780-1783. [Long Z H,Yang Z C,Yang X Z. 2007. Study on skin toxicology and penetration enhancement of skin absorption of volatile oil extracted from tender branchers of Camellia oleifera[J]. China Journal of Chinese Materia Medica,32(17):1780-1783.] doi:10.3321/j.issn:1001-5302.2007.17.016.
陸益,杨帆,梁宁生,崔英,张丽生,李艳,蒙子卿. 2005. 茶多酚毒理学实验研究[J]. 广西医科大学学报,22(6):831-834. [Lu Y,Yang F,Liang N S,Cui Y,Zhang L S,Li Y,Meng Z Q. 2005. Toxicological study of tea polyhenols[J]. Journal of Guangxi Medical University,22(6):831-834.] doi:10.3969/j.issn.1005-930X.2005.06.001.
马陶陶,张群林,李俊,孟晓明,黄成,陈玉璞. 2008. 三氯化铝比色法测定中药总黄酮方法的探讨[J]. 时珍国医国药,19(1):54-56. [Ma T T,Zhang Q L,Li J,Meng X M,Huang C,Chen Y P. 2008. AlCl3 colorimetry for determination of total flavonoids[J]. Lishizhen Medicine and Materia Medica Research,19(1):54-56.] doi:10.3969/j.issn.1008-0805.2008.01.029.
欧春丽,王硕,侯小利,周小雷,龚小妹,缪剑华. 2017. 甜茶多酚毒理学研究[J]. 亚太传统医药,13(10):3-7. [Ou C L,Wang S,Hou X L,Zhou X L,Gong X M,Miu J H. 2017. Review of pharmacology and toxicology of Rubus suavissirnus S. Lee[J]. Asia-Pacific Traditional Medicine,13(10):3-7.] doi:10.11954/ytctyy.201710002.
彭亮,赵鹏,李彬,张洁宏,覃辉艳,姚思宇,王彦武. 2011. 肉苁蓉茶的毒理学安全性实验研究[J]. 应用预防医学,17(1):47-49. [Peng L,Zhao P,Li B,Zhang J H,Qin H Y,Yao S Y,Wang Y W. 2011. Study on safety and toxicological assessment toxicological safety of Herba Cistanche tea[J]. Journal of Applied Preventive Medicine,17(1):47-49.] doi:10.3969/j.issn.1673-758X.2011.01.018.
宋加艳,何加兴,欧伊伶,蒋平利,薄佳慧,宫连瑾,肖力争. 2021. 碧香早夏季鲜叶加工乌龙茶过程中品质成分动态变化[J]. 现代食品科技,37(2):238-248. [Song J Y,He J X,Ou Y L,Jiang P L,Bo J H,Gong L J,Xiao L Z. 2021. Dynamic changes in quality and composition of oolong tea made with fresh Bixiangzao summer tea leaves during processing[J]. Modern Food Science and Technology,37(2):238-248.] doi:10.13982/j.mfst.1673-9078.2021.2.0688.
宋小鸽,袁静,唐照亮,侯正明,陈全珠,章复清,余新欣. 1999. 茶多酚急性、慢性毒性实验研究[J]. 安徽中医学院学报,18(2):38-40. [Song X G,Yuan J,Tang Z L,Hou Z M,Chen Q Z,Zhang F Q,Yu X X. 1999. Acute and chronic toxicity test of tea polyphenols[J]. Journal of Anhui TCM College,18(2):38-40.] doi:10.3969/j.issn. 1000-2219.1999.02.032.
王春波,吕辉,韦玲冬,郭治友. 2021. 不同产地都匀毛尖茶代谢组学研究[J]. 河南农业大学学报,55(3):422-428. [Wang C B,Lü H,Wei L D,Guo Z Y. 2021. Metabolomics study on Duyun Maojian tea from different geographical origins[J]. Journal of Henan Agricultural University,55(3):422-428.] doi:10.16445/j.cnki.1000-2340. 20210316.003.
王海燕,龙子江,袁艺,徐燕. 2011. 皋茶急性毒性安全性评价研究[J]. 食品工业科技,32(2):316-318. [Wang H Y,Long Z J,Yuan Y,Xu Y. 2011. Acute toxicity evaluation of Gaocha[J]. Science and Technology of Food Industry,32(2):316-318.] doi:10.13386/j.issn1002-0306.2011. 02.112.
王治会,岳翠男,李琛,蔡海兰,彭华,李文金,胡瑶根,杨普香. 2020. 江西省茶树种质化学特性多样性分析与鉴定评价[J]. 江苏农业学报,36(1):172-179. [Wang Z H,Yue C N,Li C,Cai H L,Peng H,Li W J,Hu Y G,Yang P X. 2020. Diversity analysis and evaluation of chemical characteristics of tea germplasms in Jiangxi Province[J]. Jiangsu Journal of Agricultural Sciences,36(1):172-179.] doi:10.3969/j.issn.1000-4440.2020.01.024.
魏曉明,符红,万幼平. 2000. 硫酸蒽酮比色法测定鹿龟酒中多糖的含量[J]. 中成药,22(5):380-382. [Wei X M,Fu H,Wan Y P. 2000. Content determination of polysaccharides in Lu Gui tincture by colorimetry of sulfuric acid anthrone[J]. Chinese Traditional Patent Medicine,22(5):380-382.] doi:10.3969/j.issn.1001-1528.2000.05.027.
吴文亮,林勇,刘仲华,黄建安,龙志荣,滕翠琴,马士成,邱瑞瑾,曹中环. 2017. 六堡茶急性和亚急性毒性安全性评价研究[J]. 茶叶科学,37(2):173-181. [Wu W L,Lin Y,Liu Z H,Huang J A,Long Z R,Teng C Q,Ma S C,Qiu R J,Cao Z H. 2017. Research on acute and subacute toxi-city evaluation of Liupao tea[J]. Journal of Tea Science,37(2):173-181.] doi:10.13305/j.cnki.jts.2017.02.007.
肖文军,傅冬和,任国谱,龚志华,萧力争,刘仲华. 2007. 茯茶毒理学试验报告[J]. 茶叶科学,27(4):307-310. [Xiao W J,Fu D H,Ren G P,Gong Z H,Xiao L Z,Liu Z H. 2007. Study on the toxicity experiments of Fuzhuan tea[J]. Journal of Tea Science,27(4):307-310.] doi:10. 3969/j.issn.1000-369X.2007.04.007.
杨卫,何蓉,祁荣频,陈鹏,李丽红. 2010. 肋果茶毒性测定及安全性评价[J]. 农药,49(10):753-754. [Yang W,He R,Qi R P,Chen P,Li L H. 2010. Determination of toxicity and safety evaluation for Sladenia celastrifolia Kurz[J]. Agrochemicals,49(10):753-754.] doi:10.16820/j.cnki. 1006-0413.2010.10.016.
杨贤强,贾之慎,沈生荣,刘明哲,曹明富,黄品篯. 1992. 茶多酚类毒理学试验及其评价[J]. 浙江农业大学学报,18(1):23-29. [Yang X Q,Jia Z S,Shen S R,Liu M Z,Cao M F,Huang P J. 1992. Toxicology test and evaluation of tea polyphenols[J]. Acta Agriculturae Universitis Zhe-jiangensis,18(1):23-29.] doi:10.3321/j.issn:1008-9209. 1992.01.007.
虞颖映,王海明. 2006. 罗布麻茶的饮用安全性评价[J]. 同济大学学报(医学版),27(5):24-26. [Yu Y Y,Wang H M. 2006. Food safety assessment on concentrated tea of Apocynum venetum leaf[J]. Journal of Tongji University (Medical Science),27(5):24-26.] doi:10.3969/j.issn. 1008-0392.2006.05.007.
袁根良,蔣丽,殷光玲. 2015. 茶多酚急性毒性试验研究[J]. 食品安全质量检测学报,6(9):3730-3733. [Yuan G L,Jiang L,Yin G L. 2015. Experimental study on acute toxi-city of tea polyphenols[J]. Journal of Food Safety and Quality,6(9):3730-3733.] doi:10.19812/j.cnki.jfsq11-5956/ts.2015.09.077.
张小民,翼颐之,张吉科,林美珍. 2001. 沙棘茶叶毒理学研究[J]. 沙棘,14(1):38-40. [Zhang X M,Yi Y Z,Zhang J K,Lin M Z. 2001. Study on toxicology of seabuckthorn tea[J]. Hippophae,14(1):38-40.]
郑子新,宋瑞霞,邱继红,薛长勇. 2005. 绿茶提取物的安全性分析评价[J]. 中国公共卫生,21(5):583-584. [Zheng Z X,Song R X,Qiu J H,Xue C Y. 2005. Safety assessment of extract from green tea[J]. Chinese Journal of Public Health,21(5):583-584.] doi:10.3321/j.issn:1001-0580. 2005.05.033.
周月婵,胡怡秀,臧雪冰,胡余明,丘丰,刘秀英,聂焱,吴丽霞. 2001. 藤茶安全性毒理学评价及其免疫调节作用实验研究[J]. 实用预防医学,8(6):412-414. [Zhou Y C,Hu Y X,Zang X B,Hu Y M,Qiu F,Liu X Y,Nie Y,Wu L X. 2001. Toxicological assessment on Ampelopsis grossedentata and its immune regulation study[J]. Practical Preventive Medicine,8(6):412-414.] doi:10.3969/j.issn. 1006-3110.2001.06.006.
(责任编辑 兰宗宝)

